lncRNA DLGAP1-AS2靶向miR-1193调控非小细胞肺癌A549细胞增殖和凋亡的机制研究①
曹淑琴 朱朝勇 陈维英 祁永花 张晓媛 徐建国 (青海红十字医院肿瘤二病区,西宁 810000)
肺癌是最常见的恶性肿瘤之一,非小细胞肺癌(non-small cell lung cancer,NSCLC)约占肺癌总发病率的85%,分子生物学技术和分子靶向治疗的发展及实体肿瘤靶向治疗水平的不断提高给NSCLC患者带来了希望[1-2]。长链非编码RNA(long non-coding RNA,lncRNA)表达失调与NSCLC进展有关,且在多种癌症类型中发挥抑癌或癌基因作用[3]。DLGAP1反义RNA 2(DLGAP1 antisense RNA 2,DLGAP1-AS2)是一种胞质lncRNA,研究报道lncRNA DLGAP1-AS2 在神经胶质瘤中上调,且与神经胶质瘤患者的不良预后密切相关;敲低DLGAP1-AS2 不仅在体外抑制细胞的增殖和迁移,诱导细胞凋亡,也在体内抑制异种移植神经胶质瘤的生长[4]。抑制DLGAP1-AS2可通过调节miR-154-5p甲基化抑制肝癌细胞的迁移和侵袭[5]。然而DLGAP1-AS2在NSCLC 中的作用及机制尚不明确。本实验通过在线软件预测DLGAP1-AS2 的靶基因,发现DLGAP1-AS2 与miR-1193 存在结合位点。研究报道miR-1193 通过直接靶向跨膜9 超家族3(TM9SF3)抑制人T 细胞白血病细胞的增殖和侵袭[6]。LINC00963 通过调控通过miR-1193/SOX4 轴抑制皮肤鳞状细胞癌进展[7]。miR-1193 对NSCLC 的影响也不明确。本实验旨在研究lncRNA DLGAP1-AS2 和miR-1193 对NSCLC 的影响及DLGAP1-AS2是否调控miR-1193。
1 材料与方法
1.1 材料
1.1.1 组织样本 选取青海红十字医院收治的49 例肺癌患者的癌组织及癌旁组织,距离癌组织边缘2~5 cm 处切除的组织为癌旁组织,所有患者经病理诊断确诊,有完整的临床病理资料,均知情同意。49例患者包含男30例,女19例,年龄39~76岁。鳞癌14例、腺癌23 例、大细胞癌2 例、混合细胞癌10 例。根据TNM 分期,Ⅰ期5 例、Ⅱ期9 例、Ⅲ期17 例、Ⅳ期18例。
1.1.2 实验试剂 NSCLC 细胞株A549 购自美国ATCC;RPMI1640 培养基购自美国Hyclone 公司;SYBR Premix ExTaqTM试剂盒自日本TaKaRa 公司;MTT 试剂盒、凋亡检测试剂盒购自日本同仁研究所;全蛋白提取试剂盒、双荧光素酶报告基因检测试剂盒购自北京百奥莱博科技有限公司。
1.2 方法
1.2.1 细胞处理与分组 NSCLC 细胞A549 常规培养于RPMI1640培养基,将DLGAP1-AS2抑制表达载体质粒及阴性对照、miR-1193 模拟物基因型及对照转染至A549 细胞,记为si-DLGAP1-AS2 组、si-NC组、miR-1193组、miR-NC组;将DLGAP1-AS2抑制表达载体质粒分别与miR-1193 抑制剂及阴性对照转染至A549 细胞,记为si-DLGAP1-AS2+anti-miR-1193组、si-DLGAP1-AS2+anti-miR-NC组。
1.2.2 RT-qPCR 检测DLGAP1-AS2 和miR-1193 的表达水平 提取癌组织及细胞总RNA,合成cDNA后以其为模板按SYBR Premix ExTaqTM试剂盒说明进行PCR,以GAPDH 和U6为内参。PCR 反应体系:2 µl 反转录产物、10 µl SYBR Green Mix、正反向引物各0.5 µl、7 µl 无菌水;循环条件:95 ℃预变性2 min,95 ℃变性30 s,60 ℃退火30 s,72 ℃延伸30 s,共40 个循环;熔解曲线:95 ℃15 s,60 ℃15 s,95 ℃15 s。相对表达量采用2−ΔΔCt法计算。DLGAP1-AS2正向引物:5'-ACACGGTGAAACCCTGTCTC-3',反向引物:5'-GGAGAACAATGGCGTGATCT-3';GAPDH正向引物:5'-TGTTGCCATCAATCACCCCTT-3',反向引物:5'-CAGGTCACATACACGGTTGC-3';miR-1193正向引物:5'-GGGATGGTAGACCGGTGACGTGC-3',反向引物:5'-CAGTGCGTGTCGTGGAGT-3';U6正向引物:5'-CGCTTCGGCAGCACATATACTA-3',反向引物:5'-CGCTTCACGAATTTGCGTGTCA-3'。
1.2.3 MTT检测细胞增殖活性 各组细胞培养48 h后每孔加入MTT 溶液20µl,继续培养4 h 后弃去各孔液体,再加入200µl二甲基亚砜反应10 min,酶标仪检测490 nm处吸光度(OD)值。
1.2.4 克隆形成实验检测克隆形成数 取对数生长期细胞,消化后调整细胞浓度为1×104个/ml,将其接种于6 孔板,培养2 周出现肉眼可见克隆时终止培养,甲醇固定后采用吉姆萨染色30 min,于低倍光学显微镜下计数大于50个细胞的集落。
1.2.5 流式细胞术检测细胞凋亡 收集各组细胞,用预冷的PBS 洗涤2 次,加入300µl 结合缓冲液悬浮细胞,然后加入5 µl Annexin V-FITC 和PI,混匀,避光孵育15 min,流式细胞仪检测细胞凋亡率。
1.2.6 Western blot 检测凋亡相关蛋白表达 提取细胞总蛋白,取部分蛋白样品进行SDS-PAGE,转移至PVDF 膜,5%脱脂牛奶室温封闭,加入cleavedcaspase3、cleaved-caspase9 一抗在4 ℃下孵育过夜,加入二抗在室温下孵育2 h,曝光显影、定影,分析蛋白条带灰度值,计算蛋白表达水平。
1.2.7 双荧光素酶报告实验 使用PCR 扩增包含miR-1193 结合位点的DLGAP1-AS2 序列片段,并构建至荧光素酶表达载体中,获得DLGAP1-AS2 野生型载体(WT-DLGAP1-AS2),将DLGAP1-AS2 序列AUUUCCAGAACAUACCAUCC 突变为GUUGUAAU‐AAUAGCUAGGAU,获得DLGAP1-AS2 突变型载体(MUT-DLGAP1-AS2),将WT-DLGAP1-AS2、MUTDLGAP1-AS2 分别与miR-NC、miR-1193 共转染至A549 细胞,转染48 h 后,按照试剂盒说明书检测荧光素酶活性。
1.3 统计学分析 采用SPSS20.0软件进行统计学分析,符合正态分布的计量资料用±s表示,两组间比较行t检验,以P<0.05为差异有统计学意义。
2 结果
2.1 DLGAP1-AS2 和miR-1193 在NSCLC 组织中的表达 NSCLC组织中DLGAP1-AS2表达水平高于癌旁组织,miR-1193 表达水平低于癌旁组织(P<0.05,表1)。
表1 DLGAP1-AS2 和miR-1193 在NSCLC 组织中的表达(±s,n=49)Tab.1 Expressions of DLGAP1-AS2 and miR-1193 in NSCLC tissues(±s,n=49)
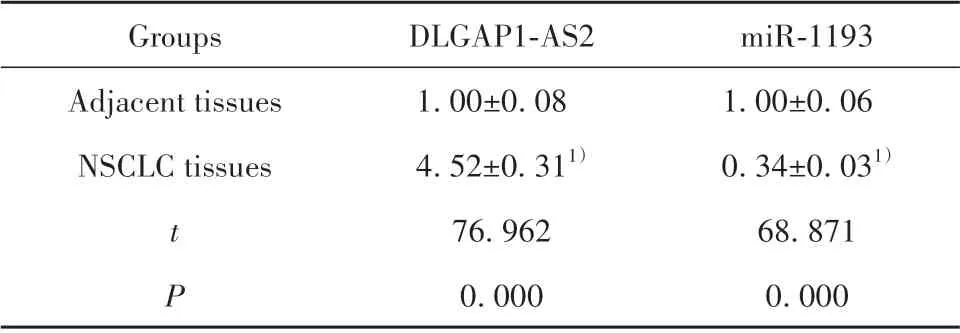
表1 DLGAP1-AS2 和miR-1193 在NSCLC 组织中的表达(±s,n=49)Tab.1 Expressions of DLGAP1-AS2 and miR-1193 in NSCLC tissues(±s,n=49)
Note:Compared with adjacent tissues,1)P<0.05.
miR-1193 1.00±0.06 0.34±0.031)68.871 0.000 Groups Adjacent tissues NSCLC tissues t P DLGAP1-AS2 1.00±0.08 4.52±0.311)76.962 0.000
2.2 抑制DLGAP1-AS2 表达对NSCLC A549 细胞增殖的影响 与si-NC 组相比,si-DLGAP1-AS2 组DLGAP1-AS2 表达水平降低,A549 细胞活性降低,克隆形成数减少(P<0.05,表2)。
表2 抑制DLGAP1-AS2 表达对A549 细胞增殖的影响(±s,n=9)Tab.2 Effect of inhibiting expression of DLGAP1-AS2 on proliferation of A549 cells(±s,n=9)

表2 抑制DLGAP1-AS2 表达对A549 细胞增殖的影响(±s,n=9)Tab.2 Effect of inhibiting expression of DLGAP1-AS2 on proliferation of A549 cells(±s,n=9)
Note:Compared with si-NC group,1)P<0.05.
Cell clone formation 107.59±11.59 43.77±4.591)15.359 0.000 Groups DLGAP1-AS2 si-NC si-DLGAP1-AS2 t P 1.00±0.07 0.34±0.041)24.559 0.000 OD value(490 nm)0.83±0.06 0.43±0.041)16.641 0.000
2.3 抑制DLGAP1-AS2 表达对NSCLC A549 细胞凋亡的影响 与si-NC 组相比,si-DLGAP1-AS2 组A549 细胞凋亡率及cleaved-caspase3、cleaved-cas‐pase9蛋白表达水平均升高(P<0.05,图1、表3)。
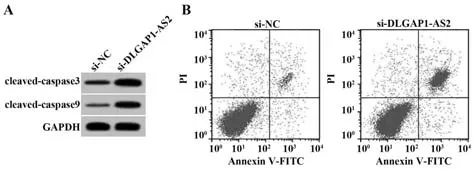
图1 抑制DLGAP1-AS2表达对A549细胞凋亡的影响Fig.1 Effect of inhibiting expression of DLGAP1-AS2 on apoptosis of A549 cell
表3 抑制DLGAP1-AS2 表达对A549 细胞凋亡的影响(±s,n=9)Tab.3 Effect of inhibiting expression of DLGAP1-AS2 on apoptosis of A549 cell(±s,n=9)

表3 抑制DLGAP1-AS2 表达对A549 细胞凋亡的影响(±s,n=9)Tab.3 Effect of inhibiting expression of DLGAP1-AS2 on apoptosis of A549 cell(±s,n=9)
Note:Compared with si-NC group,1)P<0.05.
cleaved-cas‐pase9 protein 0.21±0.02 0.65±0.051)24.512 0.000 Groups si-NC si-DLGAP1-AS2 t P Apoptosis rate(%)7.12±0.68 24.19±2.211)22.119 0.000 cleaved-cas‐pase3 protein 0.31±0.03 0.78±0.061)21.019 0.000
2.4 DLGAP1-AS2 靶向调控miR-1193 表达 Star‐Base 预测显示DLGAP1-AS2 的序列中含有与miR-1193 互补的核苷酸序列(图2);WT-DLGAP1-AS2 与miR-1193 共转染的A549 细胞荧光素酶活性降低(P<0.05),MUT-DLGAP1-AS2 与miR-1193 共转染的A549 细胞荧光素酶活性无明显变化(表4)。过表达DLGAP1-AS2 后miR-1193 表达水平降低,抑制DLGAP1-AS2 表达后miR-1193 表达水平升高(P<0.05,表5)。
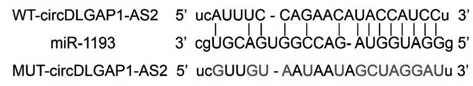
图2 DLGAP1-AS2与miR-1193互补的核苷酸序列Fig.2 Complementary nucleotide sequence of DLGAP1-AS2 and miR-1193
表4 miR-1193 与DLGAP1-AS2 野生型、突变型载体共转染后荧光素酶活性(±s,n=9)Tab.4 Luciferase activity after co-transfection of miR-1193 with DLGAP1-AS2 wild-type and mutant vector(±s,n=9)

表4 miR-1193 与DLGAP1-AS2 野生型、突变型载体共转染后荧光素酶活性(±s,n=9)Tab.4 Luciferase activity after co-transfection of miR-1193 with DLGAP1-AS2 wild-type and mutant vector(±s,n=9)
Note:Compared with miR-NC group,1)P<0.05.
WT-DLGAP1-AS2 1.03±0.08 0.55±0.051)15.264 0.000 MUT-DLGAP1-AS2 1.02±0.07 1.00±0.05 0.697 0.496 Groups miR-NC miR-1193 t P
表5 DLGAP1-AS2调控miR-1193的表达(±s,n=9)Tab.5 DLGAP1-AS2 regulates expression of miR-1193(±s,n=9)

表5 DLGAP1-AS2调控miR-1193的表达(±s,n=9)Tab.5 DLGAP1-AS2 regulates expression of miR-1193(±s,n=9)
Note:Compared with pcDNA group,1)P<0.05;compared with si-NC group,2)P<0.05.
miR-1193 1.00±0.07 0.41±0.031)0.99±0.04 2.58±0.212)606.874 0.000 Groups pcDNA pcDNA-DLGAP1-AS2 si-NC si-DLGAP1-AS2 F P
2.5 miR-1193 过表达对NSCLC A549 细胞增殖和凋亡的影响 与miR-NC 组相比,miR-1193 组A549细胞活性降低,克隆形成数减少,细胞凋亡率及凋亡相关蛋白cleaved-caspase3、cleaved-caspase9 表达水平升高(P<0.05,图3、表6)。
表6 miR-1193过表达对A549细胞增殖和凋亡的影响(±s,n=9)Tab.6 Effect of miR-1193 overexpression on proliferation and apoptosis of A549 cells(±s,n=9)
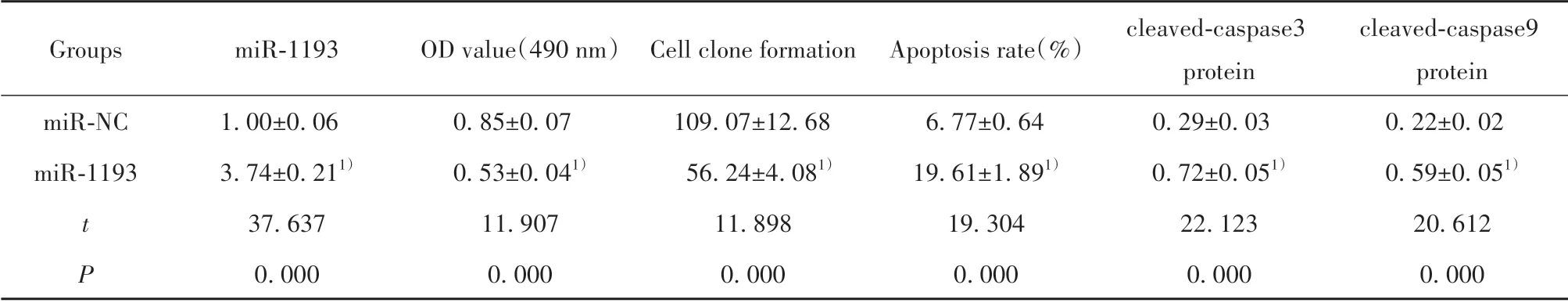
表6 miR-1193过表达对A549细胞增殖和凋亡的影响(±s,n=9)Tab.6 Effect of miR-1193 overexpression on proliferation and apoptosis of A549 cells(±s,n=9)
Note:Compared with miR-NC group,1)P<0.05.
cleaved-caspase9 protein 0.22±0.02 0.59±0.051)20.612 0.000 Groups miR-1193 OD value(490 nm)Cell clone formation Apoptosis rate(%)miR-NC miR-1193 t P 1.00±0.06 3.74±0.211)37.637 0.000 0.85±0.07 0.53±0.041)11.907 0.000 109.07±12.68 56.24±4.081)11.898 0.000 6.77±0.64 19.61±1.891)19.304 0.000 cleaved-caspase3 protein 0.29±0.03 0.72±0.051)22.123 0.000
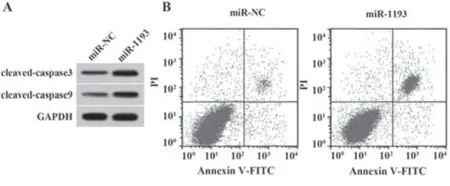
图3 miR-1193过表达对A549细胞凋亡的影响Fig.3 Effect of miR-1193 overexpression on apoptosis of A549 cells
2.6 干扰miR-1193 表达逆转了抑制DLGAP1-AS2表达对NSCLC A549 细胞增殖和凋亡的作用 与si-DLGAP1-AS2+anti-miR-NC 组相比,si-DLGAP1-AS2+anti-miR-1193 组A549 细胞活性升高,A549 细胞的克隆形成数增加,细胞凋亡率及cleaved-cas‐pase3、cleaved-caspase9 表达水平降低(P<0.05,图4、表7)。
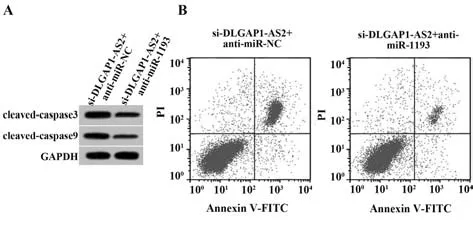
图4 干扰miR-1193 表达逆转了抑制DLGAP1-AS2 表达对A549细胞凋亡的作用Fig.4 Interference with miR-1193 expression reverses the effect of inhibiting DLGAP1-AS2 expression on apoptosis of A549 cells
表7 干扰miR-1193表达逆转了抑制DLGAP1-AS2表达对A549细胞增殖和凋亡的作用(±s,n=9)Tab.7 Interference with miR-1193 expression reverses the effect of inhibiting DLGAP1-AS2 expression on proliferation and apoptosis of A549 cells(±s,n=9)
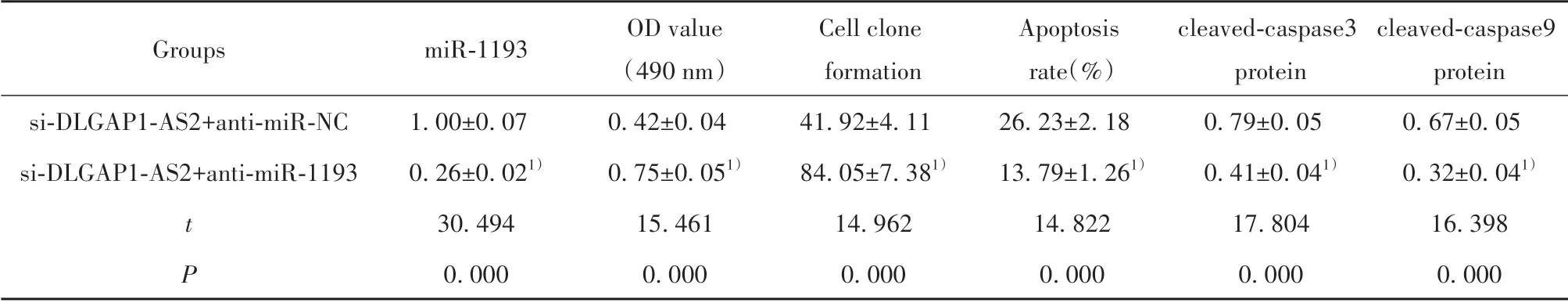
表7 干扰miR-1193表达逆转了抑制DLGAP1-AS2表达对A549细胞增殖和凋亡的作用(±s,n=9)Tab.7 Interference with miR-1193 expression reverses the effect of inhibiting DLGAP1-AS2 expression on proliferation and apoptosis of A549 cells(±s,n=9)
Note:Compared with si-DLGAP1-AS2+anti-miR-NC group,1)P<0.05.
cleaved-caspase9 protein 0.67±0.05 0.32±0.041)16.398 0.000 Groups miR-1193 si-DLGAP1-AS2+anti-miR-NC si-DLGAP1-AS2+anti-miR-1193 t P 1.00±0.07 0.26±0.021)30.494 0.000 OD value(490 nm)0.42±0.04 0.75±0.051)15.461 0.000 Cell clone formation 41.92±4.11 84.05±7.381)14.962 0.000 Apoptosis rate(%)26.23±2.18 13.79±1.261)14.822 0.000 cleaved-caspase3 protein 0.79±0.05 0.41±0.041)17.804 0.000
3 讨论
靶向治疗的出现使NSCLC 的治疗方式发生巨大变化,改善了患者的生活质量及生存期,深入研究NSCLC 机制,开发新的靶点对其靶向治疗具有重要意义[8-9]。lncRNA 和miRNA 均属于非编码RNA,研究表明,非编码RNA 可作为可靠的生物标志物和治疗靶标,从而促进更有效的癌症治疗和更好的患者预后生存[10]。研究报道DLGAP1-AS2 与Wilms 患者的生存率显著相关,可作为其预后标志物[11]。DLGAP1-AS2 的高表达与胆管癌患者的不良预后相关;DLGAP1-AS2 通过调控miR-505 和GALNT10 促进胆管癌进展[12]。DLGAP1-AS2 在胃癌患者癌组织及血浆中的表达水平均明显升高;敲减DLGAP1-AS2 可抑制胃癌细胞的增殖、迁移及侵袭[13]。本实验结果显示,NSCLC 组织中DLGAP1-AS2 表达水平升高,提示DLGAP1-AS2 可能在NSCLC 中发挥促癌作用。进一步抑制DLGAP1-AS2 表达后,A549 细胞活性降低,克隆形成数减少,A549细胞凋亡率升高,cleaved-caspase3、cleaved-caspase9 蛋白表达水平升高,表明抑制DLGAP1-AS2表达可抑制A549细胞增殖,促进细胞凋亡。提示DLGAP1-AS2 在肺癌中与在其他癌症中的作用一致。可能作为肺癌检测、治疗的生物标志物及治疗靶点。
研究报道miR-1193 的强制表达抑制宫颈癌细胞的增殖、侵袭和迁移[14]。miR-1193 还可抑制胶质瘤细胞的增殖、迁移和侵袭[15]。说明miR-1193在不同癌症中均发挥抑癌作用。本实验结果显示,NSCLC 组织中miR-1193 表达水平降低;提示miR-1193 或与NSCLC 的发生有关。本实验过表达miR-1193 后A549 细胞活性降低,克隆形成数减少,A549细胞凋亡率升高,cleaved-caspase3、cleaved-caspase9蛋白表达水平升高,表明过表达miR-1193 可抑制A549 细胞增殖,促进细胞凋亡;提示miR-1193 在NSCLC 中同样起抑癌基因作用。且本研究发现DLGAP1-AS2 可靶向调控miR-1193;而干扰miR-1193 表达则减弱了抑制DLGAP1-AS2 表达对A549细胞增殖和凋亡的作用。提示DLGAP1-AS2可能通过调控miR-1193影响NSCLC细胞的增殖和凋亡。
综上所述,抑制lncRNA DLGAP1-AS2表达可能通过靶向上调miR-1193 抑制NSCLCA549 细胞的增殖,促进凋亡。