Kv1.5蛋白通道阻滞剂DPO-1对LPS诱导的大鼠主动脉内皮细胞损伤的影响①
安 宁 周 贤 张晓霞 杨 涛 许美霞
(华中科技大学同济医学院附属协和医院麻醉与危重病研究所,武汉 430022)
血管内皮细胞损伤在脓毒症的发生发展中发挥重要作用,其不仅是脓毒症发生时受损的靶细胞,而且是炎症反应和继发器官损伤的积极参与者[1-3]。因此,阻断内皮细胞的损伤将可能改变脓毒症的进程。Kv1.5蛋白是电压依赖性氧敏感钾离子通道,广泛表达于多种细胞,其生理功能不仅局限于心肌细胞膜电位的维持,也与细胞的增殖、凋亡等多个病理生理过程有关[4-6]。近年来,研究发现Kv1.5 蛋白参与氧化低密度脂蛋白(OxLDL)、H2O2等诱导的血管内皮细胞氧化应激损伤[7-8]。因此,本研究通过建立脓毒症动物模型,给予Kv1.5 蛋白通道特异性阻滞剂DPO-1(diphenyl phosphine oxide-1)干预后,观察内皮细胞凋亡及氧化损伤情况,探讨Kv1.5 蛋白通道阻滞剂DPO-1 对LPS 诱导的大鼠主动脉内皮细胞损伤的影响。
1 材料与方法
1.1 材料 成年清洁级SD 雄性大鼠80 只,体质量(200±20)g,购于华中科技大学动物研究所。LPS及DPO-1 购于美国Sigma 公司;内皮细胞特异性分子-1(Endocan)、内皮细胞黏附分子-1(vascular cell adhesion molecule-1,VCAM-1)、血管性血友病因子(von Willebrand factor,vWF)、IL-6、IL-1β 及TNF-α试剂盒购于中国上海玉博生物科技有限公司;细胞凋亡检测试剂盒购于北京宝赛生物技术生物有限公司;脂质过氧化物丙二醛(malondialdehyde,MDA)、髓过氧化物酶(myeloperoxidase,MPO)及超氧化物歧化酶(superoxide dismutase,SOD)试剂盒购于南京建成生物工程研究所。
1.2 方法
1.2.1 动物模型制备与分组 SD 大鼠在实验前12 h 开始禁食,实验前4 h 禁水。将大鼠随机分为4组,每组20只。Control组:尾静脉注射0.9%Nacl溶液;LPS组:尾静脉注射5 mg/kg LPS(等渗NaCl溶液稀释至1 ml)制造大鼠脓毒症模型;LPS+DPO-1 1组:先腹腔注射0.3 mg/kg DPO-1,30 min 后尾静脉注射5 mg/kg LPS;LPS+DPO-1 2 组:先腹腔注射3 mg/kg DPO-1,30 min 后尾静脉注射5 mg/kg LPS。各组大鼠均在自然光下继续饲养6 h。
1.2.2 Western blot 检测Kv1.5 蛋白表达情况 采集大鼠胸主动脉于裂解缓冲液。用Brd Frad 法测定蛋白浓度。提取的蛋白依次进行凝胶电泳、转膜、封闭和孵育(加入一抗在4 ℃下孵育过夜),加入辣根过氧化物酶标记的二抗在室温下孵育2 h,ECL显影。
1.2.3 流式细胞术检测主动脉内皮细胞凋亡情况 大鼠取胸主动脉约2 cm,剥取内膜,70%乙醇固定,制备单细胞悬液,按照Annexin V/PI 细胞凋亡检测试剂盒说明书操作,用流式细胞仪检测各组主动脉内皮细胞早期凋亡率。
1.2.4 ELISA 法检测Endocan、VCAM-1、vWF 及炎症因子表达量 大鼠眶后静脉取血,分离血清,按照ELISA 试剂盒方法检测各组Endocan、VCAM-1、vWF及血清炎症因子IL-6、IL-1β及TNF-α表达量。
1.2.5 比色法检测SOD、MDA 及MPO 含量 取大鼠胸主动脉,加入0.9%Nacl,用电动匀浆器制备组织匀浆。匀浆过程于冰水中进行。按照试剂盒说明书操作检测SOD、MDA及MPO含量。
1.3 统计学分析 本实验计量资料以±s表示,采用SPSS26.0软件进行统计学分析,多组间均数比较采用单因素方差分析,两组间均数比较采用t检验,以P<0.05为差异具有统计学意义。
2 结果
2.1 Kv1.5 蛋白在大鼠主动脉内皮细胞中表达情况 Kv1.5 蛋白在Control 组及LPS 组均存在表达,LPS组相对蛋白表达水平为1.042±0.021,与Control组比较,LPS 组Kv1.5 蛋白表达明显增加(P<0.01,图1)。
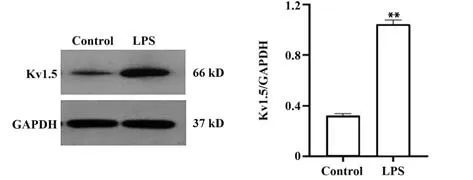
图1 大鼠主动脉内皮细胞Kv1.5蛋白的表达水平Fig.1 Expression of Kv1.5 protein in rats aortic endothe⁃lial cells
2.2 流式细胞术检测各组大鼠主动脉内皮细胞凋亡情况 与Control 组比较,LPS 组内皮细胞凋亡率[(42.29±1.19)%]明显上升(P<0.01),而LPS+DPO-1 1 组及LPS+DPO-1 2 组内皮细胞凋亡率分别为(40.24±1.25)%、(29.68±1.34)%,较LPS 组降低(P<0.01,图2)。

图2 各组大鼠主动脉内皮细胞凋亡情况Fig.2 Apoptosis of rat aortic endothelial cells in each group
2.3 各组大鼠血清Endocan、VCAM-1 及vWF 表达情况 与Control 组比较,LPS 组血清内皮细胞标志物Endocan、VCAM-1 及vWF 水平明显升高(P<0.05);与LPS组比较,LPS+DPO-1 1组及LPS+DPO-1 2 组大鼠血清内皮细胞标志物Endocan、VCAM-1 及vWF 水平降低(P<0.05),且这一效应随DPO-1 剂量增加而加强(表1)。
表1 各组大鼠血清Endocan、VCAM-1、vWF 表达情况(ng/ml,±s,n=20)Tab.1 Expressions of Endocan,VCAM-1 and vWF of rats in each group(ng/ml,±s,n=20)
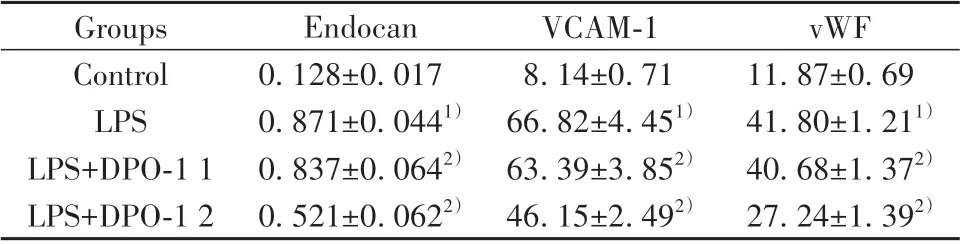
表1 各组大鼠血清Endocan、VCAM-1、vWF 表达情况(ng/ml,±s,n=20)Tab.1 Expressions of Endocan,VCAM-1 and vWF of rats in each group(ng/ml,±s,n=20)
Note:1)P<0.05 vs Control group;2)P<0.05 vs LPS group.
vWF 11.87±0.69 41.80±1.211)40.68±1.372)27.24±1.392)Groups Control LPS LPS+DPO-1 1 LPS+DPO-1 2 Endocan 0.128±0.017 0.871±0.0441)0.837±0.0642)0.521±0.0622)VCAM-1 8.14±0.71 66.82±4.451)63.39±3.852)46.15±2.492)
2.4 各组大鼠血清炎症因子IL-6、IL-1β 及TNF-α水平变化 与Control 组比较,LPS 组血清炎症因子IL-6、IL-1β 及TNF-α 水平明显升高(P<0.05);与LPS组相比,LPS+DPO-1 1组及LPS+DPO-1 2组大鼠血清炎症因子IL-6、IL-1β 及TNF-α 水平降低(P<0.05,表2)。
表2 各组大鼠血清炎症因子IL-6、IL-1β 及TNF-α 水平(±s,pg/ml,n=20)Tab.2 Expressions of IL-6,IL-1β and TNF-α of rats in each group(±s,pg/ml,n=20)

表2 各组大鼠血清炎症因子IL-6、IL-1β 及TNF-α 水平(±s,pg/ml,n=20)Tab.2 Expressions of IL-6,IL-1β and TNF-α of rats in each group(±s,pg/ml,n=20)
Note:1)P<0.05 vs Control group;2)P<0.05 vs LPS group.
TNF-α 58.42±6.49 141.81±7.461)115.37±8.622)80.97±8.852)Groups Control LPS LPS+DPO-1 1 LPS+DPO-1 2 IL-6 50.63±4.40 214 5.39±144.171)180 9.28±157.002)100 7.16±194.642)IL-1β 23.07±1.18 924.39±72.381)634.83±58.002)279.10±30.062)
2.5 各组大鼠主动脉内皮组织SOD、MDA 及MPO含量变化 LPS 组较对照组MDA 、MPO 含量上升,SOD 活性降低(P<0.05),而LPS+DPO-1 1 组及LPS+DPO-1 2组较LPS 组MDA、MPO 含量下降,SOD 活性上升(P<0.05,表3)。
表3 各组大鼠内皮组织SOD、MDA、MPO含量(±s,n=20)Tab.3 Expression of SOD,MDA and MPO in each group(±s,n=20)
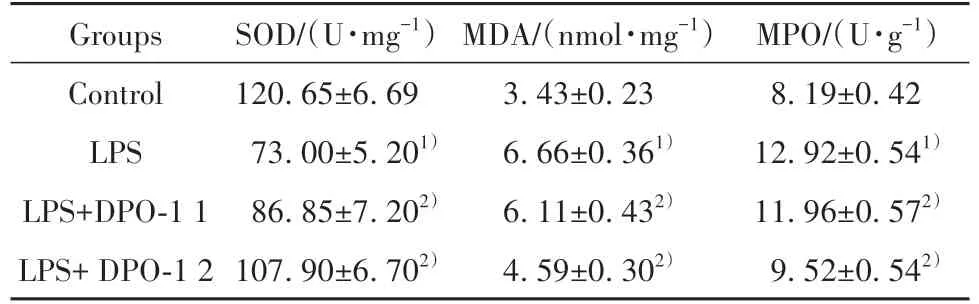
表3 各组大鼠内皮组织SOD、MDA、MPO含量(±s,n=20)Tab.3 Expression of SOD,MDA and MPO in each group(±s,n=20)
Note:1)P<0.05 vs Control group;2)P<0.05 vs LPS group.
?
3 讨论
脓毒症是宿主对感染的反应失调,产生危及生命的器官功能障碍,其中内皮细胞损伤是导致脓毒症发生发展的重要环节[1-3]。研究发现,Kv1.5 通道是电压依赖型钾通道的一种亚型,在平滑肌细胞、神经胶质细胞等细胞中均有表达,通过调控细胞的增殖、凋亡在肺动脉高压、脊髓炎等疾病中发挥重要作用[4-6]。近年来,有关Kv1.5 与内皮细胞间关系的研究越来越得到关注。有研究显示,Kv1.5 蛋白在内皮细胞中存在表达,在高血压、动脉粥样硬化等疾病中,其可能通过参与血管内皮细胞氧化过程影响细胞的增殖、凋亡[7-8]。DPO-1 是一种新型的有效的Kv1.5 通道阻断剂。最新研究发现,DPO-1 通过特异性阻断Kv1.5通道抑制肺动脉平滑肌细胞细胞膜及线粒体膜电位,抑制肺动脉平滑肌细胞的线粒体依赖性凋亡[9]。本研究发现,Kv1.5 蛋白在大鼠主动脉内皮细胞中存在表达,予以Kv1.5 特异性通道阻滞剂DPO-1 后观察内皮细胞凋亡情况,发现给予不同浓度的DPO-1 干预后,LPS 诱导的内皮细胞凋亡减少,提示Kv1.5 蛋白通道阻滞剂DPO-1 可减轻LPS诱导的主动脉内皮细胞损伤。
内皮细胞是血管内膜的屏障,其能通过释放各种生物活性物质对机体内环境的改变做出相应的调节。血管内皮细胞激活、损伤及功能障碍是脓毒症发生发展的关键环节[10-11]。脓毒症时大量内毒素及炎症介质导致内皮细胞异常活化,一方面内皮屏障受损,VCAM-1 等多种黏附分子大量表达,vWF、TM 等活性物质释放入血,引起炎症风暴和凝血功能紊乱[11-12]。另一方面炎症过度活化,炎症因子刺激细胞表面黏附分子表达增加,促进白细胞与内皮细胞相互作用,进一步导致“炎症瀑布”反应[13-14]。目前,用于评判血管内皮细胞激活或功能受损的生物标志物包含Endocan、VCAM-1、vWF 等,其含量的高低与内皮细胞损伤程度呈正相关[15]。本研究发现,给予LPS处理后,Endocan、VCAM-1、vWF及炎症因子IL-6、IL-1β、TNF-α 水平增加,而给予不同浓度Kv1.5 通道特异性阻滞剂DPO-1 可减少Endocan、VCAM-1、vWF 及炎症因子IL-6、IL-1β、TNF-α 水平,进一步提示DPO-1 可能通过阻断Kv1.5 通道,减轻LPS诱导的内皮细胞损伤,抑制局部炎症反应。
近期研究发现,Kv1.5 蛋白表达上调,细胞内ROS 水平增加,导致血管内皮细胞损伤是高血压、动脉粥样硬化等心血管疾病的重要原因,Kv1.5 蛋白可能在血管内皮细胞氧化应激调节过程中发挥重要作用[14-15]。而脓毒症时,组织细胞缺血缺氧,细胞氧超载,加重炎症反应,导致组织细胞坏死、凋亡[16]。SOD 是机体清除氧自由基最重要的酶之一,其含量可反映机体内抗氧化酶的活性及其清除氧自由基的能力。MPO、MDA 含量的高低常用于评估机体脂质过氧化损伤的程度[17-18]。本研究发现,LPS作用于内皮细胞后,SOD 含量减少,MPO、MDA 含量增加,而Kv1.5 通道阻滞剂DPO-1 可对抗LPS 产生的效应,减轻内皮细胞氧化应激损伤,增加细胞内SOD水平,并降低细胞内MPO、MDA含量。
综上所述,DPO-1 通过阻断Kv1.5 通道减轻内毒素诱导的大鼠主动脉内皮细胞氧化应激损伤,抑制炎症反应。证实Kv1.5蛋白通道阻滞剂DPO-1在脓毒症相关内皮细胞损伤中发挥重要作用。