柴胡皂苷d通过AKT/mTOR信号通路调控胶质瘤C6细胞自噬
张静 于慧玲 赵鹏伟 尹华夏 刘晓熙
作者单位:010000 呼和浩特 内蒙古医科大学基础医学院
胶质瘤是一种起源于脑或脊柱神经胶质细胞的肿瘤,约占成年人常见恶性原发性颅内肿瘤的75%[1]。尽管手术技术和辅助治疗不断发展,但高级别胶质瘤的治疗效果仍然较差,恶性原发性脑肿瘤目前仍是最难治疗的恶性肿瘤之一,其5年总生存率低于35%[1-2]。因此,目前亟需探索更有效的治疗策略以改善这类患者的预后。近年来,中医药抗肿瘤治疗取得了长足的发展。柴胡具有十分复杂的化学活性成份,以柴胡皂苷类最具代表性,其主要包含柴胡皂苷a、柴胡皂苷b、柴胡皂苷c、柴胡皂苷d(saikosaponin d,Ssd)等单体成分。药理实验证实柴胡皂苷d是柴胡皂苷提取物中药理活性最强的单体[3],其在抗肿瘤方面具有显著的生物活性[4]。自噬与肿瘤的形成和发展紧密相关,目前已有研究显示柴胡皂苷d能调控肿瘤细胞自噬[5]。本课题组前期实验也发现小柴胡汤能有效促进胶质瘤C6细胞凋亡并抑制其增殖[6]。基于此,本研究进一步观察柴胡皂苷d能否诱导胶质瘤C6细胞发生自噬并初步探讨其作用机制。
1 材料与方法
1.1 主要材料与试剂
胶质瘤C6细胞购自武汉普诺赛生命科技有限公司。柴胡皂苷d购自中国食品药品检定研究院(HPLC≥96.3%)。FBS、DMEM培养基、0.25%胰蛋白酶购自美国Gibco公司。青霉素/链霉素双抗购自美国Hyclone公司。GAPDH、Beclin1、LC3A/B、mTOR、p-mTOR抗体均购自美国CST公司。AKT、p-AKT抗体均购自武汉三鹰技术有限公司。GAPDH、LC3、Beclin1、AKT、mTOR引物设计及合成由上海生工生物工程股份有限公司完成。RIPA裂解液、SDS-PAGE凝胶试剂盒、BCA蛋白定量试剂盒、ECL发光液、CCK-8试剂盒均购自上海碧云天生物技术有限公司。0.1%结晶紫染料购自北京索莱宝科技有限公司。总RNA提取试剂盒购自北京天根生化科技有限公司。反转录试剂盒及实时荧光定量PCR试剂盒均购自北京全式金生物技术有限公司。
1.2 实验方法
1.2.1 细胞培养 胶质瘤C6细胞用含有10%FBS和1%双抗的DMEM高糖培养基放置在37℃、5% CO2培养箱中培养。每天观察细胞生长状态,待细胞长至70%~80%时进行传代处理。
1.2.2 CCK-8实验检测胶质瘤C6细胞的增殖能力取对数生长期的胶质瘤C6细胞,以4×103/孔接种于96孔板中,待培养至细胞贴壁后,分别加入含柴胡皂苷d的终浓度为0 μmol/L(Control组)、2 μmol/L、4 μmol/L、6 μmol/L、8 μmol/L、10 μmol/L、12 μmol/L 的 100 μL完全培养基并置于37℃、5% CO2培养箱中培养12 h、24 h、48 h。然后按照每100 μL加入10 μL的CCK-8试剂依次加入96孔板中,培养1 h后用酶标仪检测450 nm波长处的光密度(OD)值。细胞抑制率(%)=[(对照组OD值-实验组OD值)/(对照组OD值-空白组OD值)]×100%,未经柴胡皂苷d处理的细胞抑制率设定为0。
1.2.3 克隆形成实验检测胶质瘤C6细胞的增殖能力 取对数生长期的胶质瘤C6细胞,用完全培养基配制成1×104/mL的细胞悬液,按1∶20比例稀释至500/mL后接种于6孔板中,待细胞生长至贴壁后,分别加入含柴胡皂苷d终浓度为0 μmol/L、8 μmol/L的2 mL完全培养基培养1周。待细胞形成明显集落(细胞数>50个)后用0.1%结晶紫染色,于显微镜下拍照计数。
1.2.4 划痕实验检测胶质瘤C6细胞的迁移能力 取对数生长期的胶质瘤C6细胞,以5×105/孔接种到6孔板中,待细胞生长至90%后进行划痕,用1 mL无菌枪头垂直于孔板底部划1~3条直线,分别加入含柴胡皂苷d终浓度为0 μmol/L、8 μmol/L的2 mL无血清培养基并置于37℃、5% CO2培养箱培养24 h后拍照,用Image J软件计算细胞的迁移距离。
1.2.5 Western blot检测胶质瘤C6细胞中Beclin1、LC3-Ⅱ/LC3-Ⅰ、p-AKT和p-mTOR的蛋白表达 胶质瘤 C6细胞分别经0 μmol/L、8 μmol/L柴胡皂苷d处理24 h后,按照试剂说明书提取细胞总蛋白,根据BCA调整样品浓度至统一上样量,加入5×蛋白上样缓冲液,沸水煮15 min后分装保存于-80℃冰箱。取20 μg总蛋白并用SDS-PAGE分离,转移到NC膜上,用5%脱脂奶粉封闭1 h,在4℃条件下孵育一抗过夜。次日用TBST洗涤,二抗室温孵育1 h,再用TBST洗涤。用ECL化学发光剂显影,按A∶B=1∶1比例配置发光液并均匀滴加在NC膜上反应5~10 s后,在凝胶成像系统上采集照片,并用Image J软件计算灰度值。
1.2.6 qRT-PCR检测胶质瘤C6细胞中Beclin1、LC3、AKT和mTOR mRNA的表达 胶质瘤C6细胞分别经0 μmol/L、8 μmol/L柴胡皂苷d作用24 h后提取细胞总RNA并反转录为cDNA模板,后续进行qRTPCR检测Beclin1、LC3、AKT和mTOR mRNA的表达水平。引物序列(5'-3'):Beclin1上游为TCAAGATCCTGGACCGAGTGACC,下游为CTCCTCTCCTGAGTTAGCCTCTTCC;LC3上游为GCCTTCTTCCTCCTGGTGAAT,下游为TTTTTGCCTTGGTAGGGGCTT;AKT上游为CACAGGTCGCTACTATGCCATGAAG,下游为GCAGGACACGGTTCTCAGTAAGC;mTOR上游为CCTTCGTGCCTGTCTGATTCTTACC,下游为AACCTTTCTCTGCTTCTTCAAATGTGTG;GAPDH上游为CACTGAGCATCTCCCTCACAA,下游为TGGTATTCGAGAGAAGGGAGG。以GAPDH作为内参,取Ct值后转化为2-ΔΔCt计算目的基因mRNA的相对表达量。
1.3 统计学方法
采用SPSS 25.0软件进行统计学分析,实验均重复3次以上,实验数据采用均数±标准差表示。两组间数据比较采用独立样本t检验;多组间数据比较采用单因素方差分析(ANOVA),两两比较采用LSD-t检验。以双侧P<0.05为差异有统计学意义。
2 结果
2.1 不同浓度柴胡皂苷d对胶质瘤C6细胞增殖的影响
CCK-8实验结果(图1)显示,与Control组相比,各浓度柴胡皂苷d均能抑制胶质瘤C6细胞增殖,且细胞的增殖抑制率随着柴胡皂苷d药物浓度的升高而升高(均P<0.01)。其中12 h、24 h和48 h的IC50分别为8.4548 μmol/L,8.7748 μmol/L,8.3348 μmol/L,据此以8 μmol/L柴胡皂苷d为后续实验浓度,观察时间点选择24 h。
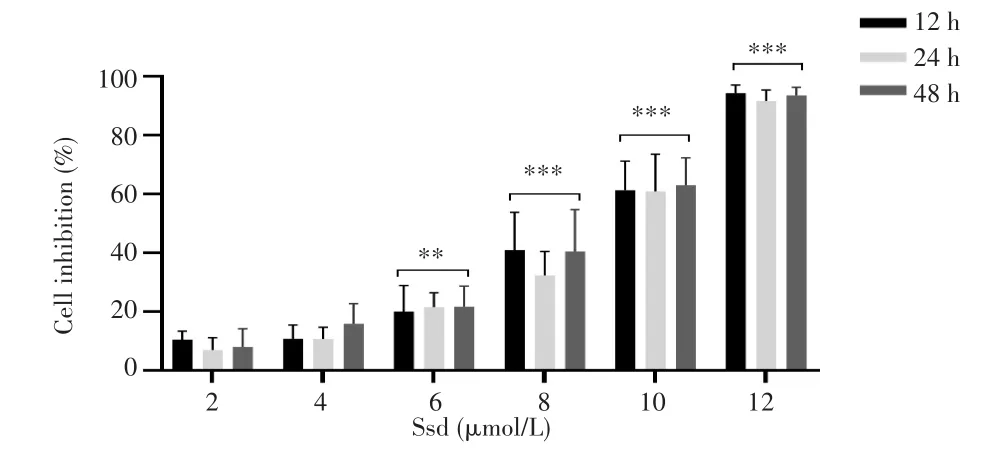
图1 柴胡皂苷d抑制胶质瘤C6细胞的增殖能力Fig.1 Saikosaponin d inhibited the proliferation ability of glioma C6 cells
2.2 柴胡皂苷d能抑制胶质瘤C6细胞的克隆形成能力
克隆形成实验结果(图2)显示,与Control组相比,8 μmol/L柴胡皂苷d作用24 h后胶质瘤C6细胞的克隆形成数目显著减少[(479.33±30.66)个vs(258.66±73.35)个,P<0.01],表明柴胡皂苷d能抑制胶质瘤C6细胞的克隆形成能力。
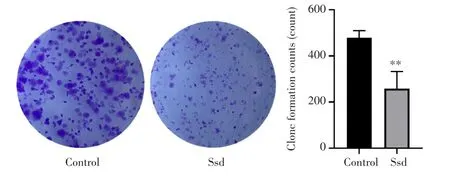
图2 柴胡皂苷d抑制胶质瘤C6细胞克隆形成能力Fig.2 Saikosaponin d inhibited the clone formation ability of glioma C6 cells
2.3 柴胡皂苷d能降低胶质瘤C6细胞的迁移能力
划痕实验结果(图3)显示,与Control组相比,8 μmol/L柴胡皂苷d作用24 h后胶质瘤C6细胞迁移率显著降低[(70.83±4.29)%vs(19.47±1.71)%,P<0.001],表明柴胡皂苷d能抑制胶质瘤C6细胞的迁移能力。
2.4 柴胡皂苷d能诱导胶质瘤C6细胞自噬的发生
Western blot检测结果(图4A)显示,与Control组比较,8 μmol/L柴胡皂苷d作用24 h后胶质瘤C6细胞中的自噬相关因子Beclin1及LC3-Ⅱ/LC3-Ⅰ的蛋白表达水平显著升高(均P<0.01)。qRT-PCR检测结果(图4B)显示,与Control组相比,8 μmol/L柴胡皂苷d作用24 h后胶质瘤C6细胞中的自噬相关因子Beclin1、LC3的mRNA表达水平显著升高(均P<0.01),表明柴胡皂苷d能诱导胶质瘤C6细胞发生自噬。
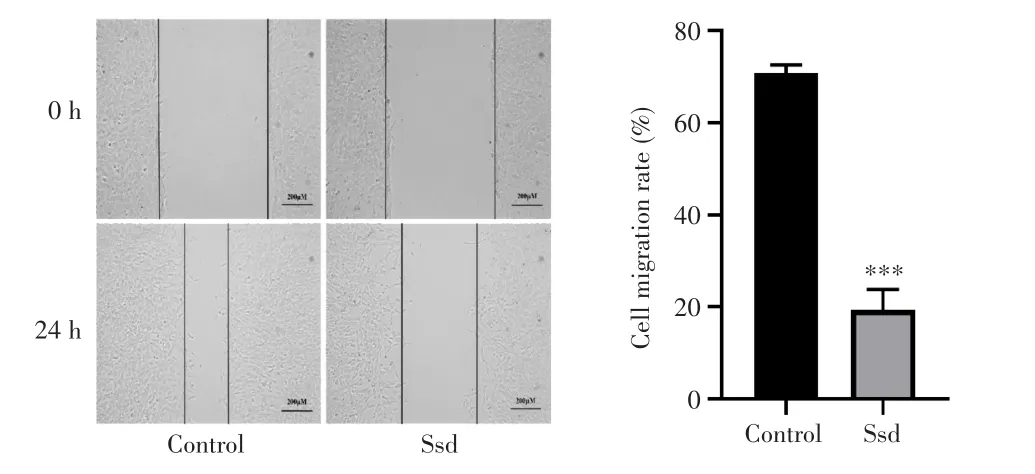
图3 柴胡皂苷d抑制胶质瘤C6细胞的迁移能力(100×)Fig.3 Saikosaponin d inhibited the migration ability of glioma C6 cells(100×)

图4 柴胡皂苷d诱导胶质瘤C6细胞发生自噬Fig.4 Saikosaponin d induced autophagy in glioma C6 cells
2.5 柴胡皂苷d能抑制AKT/mTOR信号通路
Western blot检测结果(图5A)显示,与Control组相比,8 μmol/L柴胡皂苷d作用后胶质瘤C6细胞中p-AKT/AKT和p-mTOR/mTOR的蛋白表达水平显著降低(均P<0.01)。qRT-PCR检测结果(图5B)显示,与Control组相比,8 μmol/L柴胡皂苷d作用后胶质瘤C6细胞中AKT及mTOR的mRNA表达水平均降低(P<0.05),说明柴胡皂苷d可能通过抑制AKT/mTOR信号通路,诱导胶质瘤C6细胞自噬发生。

图5 柴胡皂苷d抑制胶质瘤C6细胞AKT/mTOR通路Fig.5 Saikosaponin d inhibited glioma C6 cells AKT/mTOR pathway
3 讨论
胶质瘤是目前极难治疗的脑部肿瘤之一,因其发病部位的特殊性,以及病灶与周围正常组织边界不清导致手术难以彻底根除,预后极差。随着中药学的不断发展,中药在预防肿瘤的发生及治疗肿瘤的过程中发挥了越来越重要的作用,中医药抗肿瘤的机制也成为医学领域的研究新热点之一。
自噬是一种在进化上古老且高度保守的分解代谢过程,包括从自噬体双膜囊泡的形成,到吞噬细胞蛋白和细胞器以递送到溶酶体,最终降解以供自身所需[7]。自噬过程受多种信号通路和自噬相关基因调控,包括起始、延伸、成熟和降解等连续过程。细胞在接受信号或刺激后,可启动VPS34(vacuolar protein sorting 34)与Beclin1结合形成吞噬泡,吞噬泡在自噬延伸阶段与自噬相关因子(autophagy related gene,ATG)组装对接,形成双模结构的自噬小体,自噬小体成熟后与溶酶体结合最终降解胞内物质。功能延伸是自噬发生的关键步骤,在此阶段2个泛素化结合系统导致LC3-Ⅰ转化为LC3-Ⅱ,LC3-Ⅱ存在于自噬体内外膜上,并作为各种自噬接头的锚,因此LC3-Ⅱ常作为检测自噬的关键指标[8]。既往的药理学实验表明,柴胡皂苷d具有抗肿瘤[5]、抗抑郁[9]、改善肝纤维化[10]等药理作用。在结直肠癌研究中显示,柴胡皂苷d能使人结直肠癌SW480细胞中的LC3-Ⅱ表达含量增高,且LC3蛋白翻转试验呈阳性,在使用自噬抑制剂3-MA后负向调控柴胡皂苷d所诱导的肿瘤细胞自噬[11]。本研究结果显示,经柴胡皂苷d处理后胶质瘤C6细胞的增殖能力和迁移能力显著受到抑制,且自噬相关蛋白Beclin1、LC3-Ⅱ的表达水平明显上升,说明柴胡皂苷d能诱导细胞自噬。
AKT/mTOR信号通路是经典的负向调控自噬途径,磷酸化的AKT可以激活mTOR从而抑制自噬发生,其中mTOR为关键节点,因此通过抑制AKT/mTOR信号通路可以诱导自噬的发生[12-14]。既往研究报道,中药扶正抑瘤汤可通过抑制PI3K/AKT/mTOR信号通路诱导非小细胞肺癌自噬发生并抑制其增殖[15]。在肝癌研究中也显示柴胡皂苷d可通过抑制mTOR信号通路诱导肝癌细胞自噬发生,从而提升机体对肿瘤的抗性[16]。还有研究报道,柴胡皂苷d可通过抑制mTOR信号通路促进肝癌细胞发生自噬从而增强细胞的放射敏感性[17]。但目前鲜有研究报道柴胡皂苷d对胶质瘤细胞自噬影响的作用机制。本研究进一步检测经柴胡皂苷d处理后胶质瘤C6细胞中p-AKT和p-mTOR的表达情况,结果发现两者的表达水平均降低,再次说明柴胡皂苷d能诱导细胞自噬且可能是通过调控AKT/mTOR信号通路实现。
综上所述,本研究在细胞水平上验证了柴胡皂苷d可能通过抑制AKT/mTOR信号通路诱导胶质瘤C6细胞发生自噬,并抑制其增殖与迁移,这为胶质瘤的靶向药物治疗提供了新的理论依据。

