术前碱性磷酸酶与前白蛋白比值对肝细胞癌切除术后总体生存期的影响
梁伟康 莫秋燕 周先果 龚文锋 黄琼广 林秋伶 刘颖春 邱模勤 梁秀妹 陈佩琴 周运香韦雪艳 隆美英 余红平
作者单位:530021 南宁 1广西医科大学附属肿瘤医院;2广西医科大学公共卫生学院
肝细胞癌(hepatocellular carcinoma,HCC)是我国原发性肝癌最常见的病理类型[1],其发病率和死亡率在我国恶性肿瘤中位居前列[2]。肝切除术是患者获得长期生存的重要方式,然而术后5年复发转移率高达70%[3],这导致患者的长期生存状况不乐观。因此,寻找简单可靠的指标用于预测HCC患者的远期生存情况具有重要的临床意义。临床研究表明HCC患者的总生存期(overall survival,OS)与系统免疫炎症指数(systemic immune-inflammation index,SII)和预后营养指数(prognosis nutrition index,PNI)等相关[4],而SII和PNI分别反映出的患者术前炎症及营养状况在肿瘤发生、发展以及转移中的作用越来越受到科研工作者的重视。临床上常用白蛋白、前白蛋白、碱性磷酸酶等血清生物标志物评价患者的炎症及营养状况。其中血清碱性磷酸酶(alkaline phosphatase,ALP)可存在于人体多个组织器官中,但主要存在于肝脏、骨骼以及胆管中。ALP以其水解酶的特性参与一些物质的去磷酸化途径。在肝炎、肝硬化以及肿瘤等肝脏疾病中,血清ALP水平会明显升高,因此血清ALP水平是评估肝功能的重要指标之一[5]。既往研究发现通过检测术后血清ALP水平可有效预测HCC切除术后是否复发[6],其中当ALP水平升高时患者的5年生存率较低[7]。前白蛋白(prealbumin,PA)由肝脏合成,是一个可用于判断癌症患者预后的营养指标[8]。已有研究表明术前碱性磷酸酶和前白蛋白比值(ALP to PA ratio,APR)可作为胃癌的独立预后预测因子,且高APR组患者较低APR组患者预后差[9]。然而,术前APR与HCC切除术后患者OS的关系仍未知。本研究旨在探讨术前APR对HCC患者肝切除术后OS的影响。
1 资料与方法
1.1 一般资料
本研究为回顾性队列研究。将2012年1月至2016年12月在广西医科大学附属肿瘤医院接受肝切除手术的HCC患者纳入本研究。纳入标准:⑴首次HCC切除术于本院进行,且经术后组织病理学检查证实为HCC;⑵术前未进行经肝动脉插管化疗栓塞(transcatheter arterial chemoembolization,TACE)、射频消融、放疗等其他抗肿瘤治疗;⑶肿瘤完整切除;⑷Child-Pugh分级A级或B级。排除标准:⑴术前没有血生化检测资料;⑵合并可导致ALP水平升高的疾病,如佝偻病、软骨病、甲状旁腺功能亢进症及其他恶性肿瘤等;⑶随访资料缺失。所有研究对象均签署知情同意书。本研究通过广西医科大学附属肿瘤医院伦理委员会审批。
1.2 资料收集及随访
通过查阅病历收集患者性别、年龄、吸烟史、饮酒史以及乙型肝炎病毒(hepatitis B virus,HBV)感染情况、BCLC分期、Child-Pugh分级、肿瘤数目、肿瘤大小、是否合并肝硬化、有无癌栓等临床资料。HBV感染的界定是HBsAg阳性。患者出院后2年内每3个月电话随访1次,之后每6个月随访1次,随访截至2021年12月31日。通过电话的方式进行随访。以OS作为研究终点指标,OS为手术之日至患者死亡或末次随访的时间。把失访或最后一次随访仍未死亡的病例作为截尾事件。
1.3 统计学方法
采用SPSS 25.0软件与R 4.0.5软件进行数据分析。分类资料的比较采用χ2检验。计量资料用均数±标准差(x±s)表示。正态或近似正态分布计量资料组间比较用独立样本t检验进行分析,非正态资料用中位数(P25,P75)表示,采用Mann-Whitney进行非参数检验。根据患者术前的ALP和PA的检验结果计算APR(APR=ALP/PA;PA单位mg/L;ALP单位U/L)。通过绘制术前APR预测HCC患者术后5年预后结局的时间依赖的受试者工作特征(receiver operating characteristic,ROC)曲线确定APR的cut-off值,并根据cutoff值将患者分为高APR组(APR≥cut-off值)和低APR组(APR<cut-off值)。采用 Kaplan-Meier绘制不同APR组的生存曲线,组间差异比较采用log-rank检验。单因素Cox比例风险回归分析中P<0.05的因素先做共线性分析,采用容忍值(tolerance's value,Tol)和方差膨胀系数(variance inflation factor,VIF)检验各自变量之间是否存在多重共线性关系(VIF>2表示共线性明显),把不存在共线性关系的自变量纳入多因素模型,再采用多因素Cox比例风险回归模型筛选影响预后的独立因素。以P<0.05(双侧检验)为差异有统计学意义。
2 结果
2.1 APR与HCC患者临床病理特征的相关性
本研究共纳入942例接受肝切除手术的HCC患者,年龄范围为16~84岁。其中,男性822例(87.3%,822/942),有吸烟史322例(34.2%,322/942),有饮酒史261例(27.7%,261/942),HBV感染852例(90.4%,852/942),BCLC分期为0/A期426例(45.2%,426/942),Child-Pugh分级为A级881例(93.5%,881/942),678例(72.0%,678/942)患者肿瘤数目为1个,肿瘤最大径≤5 cm 367例(39.0%,367/942),伴肝硬化606例(64.3%,606/942),有癌栓296例(31.4%,296/942),有腹水29例(3.1%,29/942)。
通过ROC曲线可知APR预测HCC患者术后5年预后结局的ROC曲线下面积(area under the curve,AUC)为 0.656,cut-off值为 0.38 U/mg,见图1。本研究定义APR≥0.38 U/mg为高APR组(569例),APR<0.38 U/mg为低APR组(373例)。两组患者的临床病理特征比较结果显示:与低APR组相比,高APR组患者年龄较大、HBV感染率较高、血清ALB水平较低、ALT和AST水平较高、合并肝硬化的比例较高、BCLC分期为B/C期的比例较大、肿瘤数目≥2个的比例较高、肿瘤最大径>5 cm的比例以及有癌栓的比例较高,差异均有统计学意义(均P<0.05),见表1。
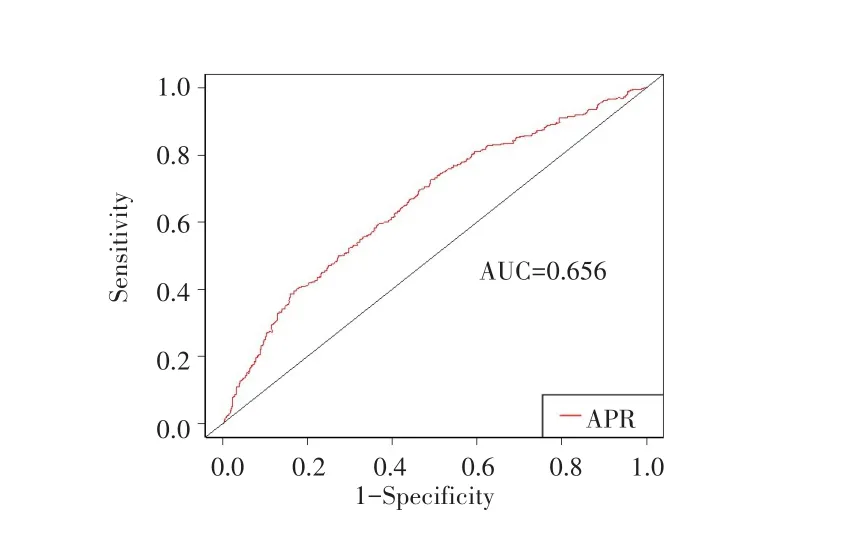
图1 术前APR预测HCC患者术后5年预后结局的ROC曲线Fig.1 ROC curve of preoperative APR for predicting 5-year prognosis of patients with HCC
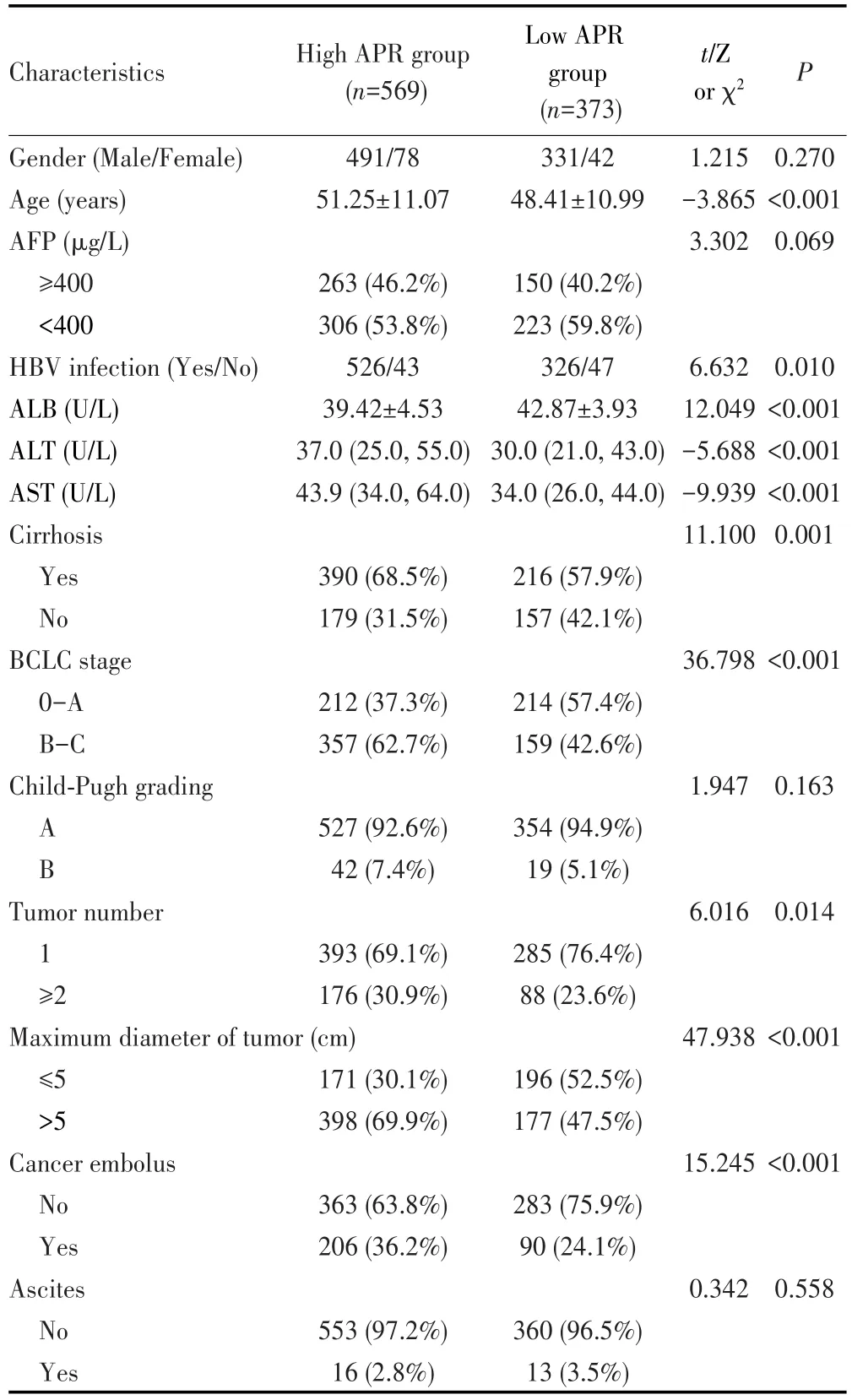
表1 APR与HCC切除术后患者临床特征之间的关系Tab.1 Association between APR and clinical characteristics of patients after HCC resection
2.2 生存分析
942例HCC患者的中位随访时间为48个月(范围:1~120个月),其中186例失访,死亡426例。低APR组术后1、3、5年总体生存率分别为90.3%、75.5%和69.5%,高APR组分别为76.5%、54.5%和46.0%,两组比较差异有统计学意义(P<0.001),见图2。
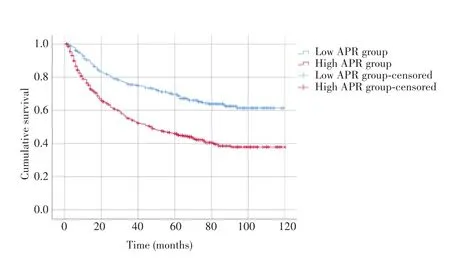
图2 高APR组和低APR组HCC患者的术后生存曲线Fig.2 Postoperative survival curves of HCC patients in high APR group and low APR group
2.3 影响HCC患者肝切除术后OS的危险因素分析
单因素分析结果显示,APR≥0.38 U/mg、AFP≥400 μg/L、BCLC分期(B/C期)、Child-Pugh评分为B级、肿瘤数目(≥2个)、肿瘤最大径(>5 cm)、有癌栓、血清ALT和AST水平较高与较低的OS相关,见表2。进一步对以上变量进行共线性分析,评价有统计学意义的单变量之间是否具有共线性关系。结果显示以上单变量之间不存在共线性关系。然后,将这些指标纳入多因素Cox比例风险回归模型,结果显示,BCLC分期B/C期、肿瘤最大径>5 cm、有癌栓、血清AST水平较高以及APR≥0.38 U/mg是影响HCC患者肝切除术后OS的独立危险因素,见表3。
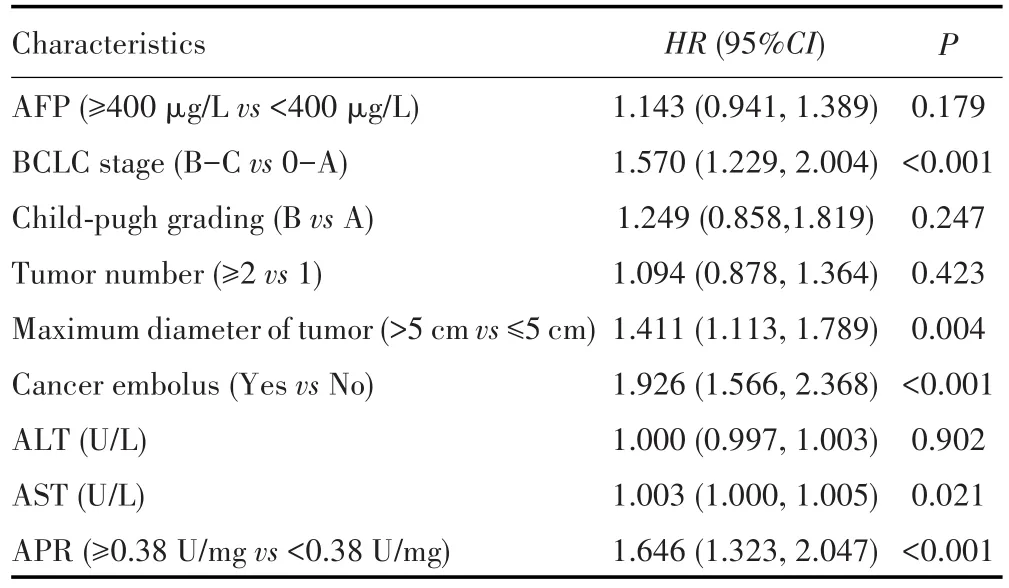
表3 HCC患者肝切除术后的生存预后多因素Cox回归分析Tab.3 Multivariable Cox regression analysis of survival prognosis of patients with HCC after hepatectomy
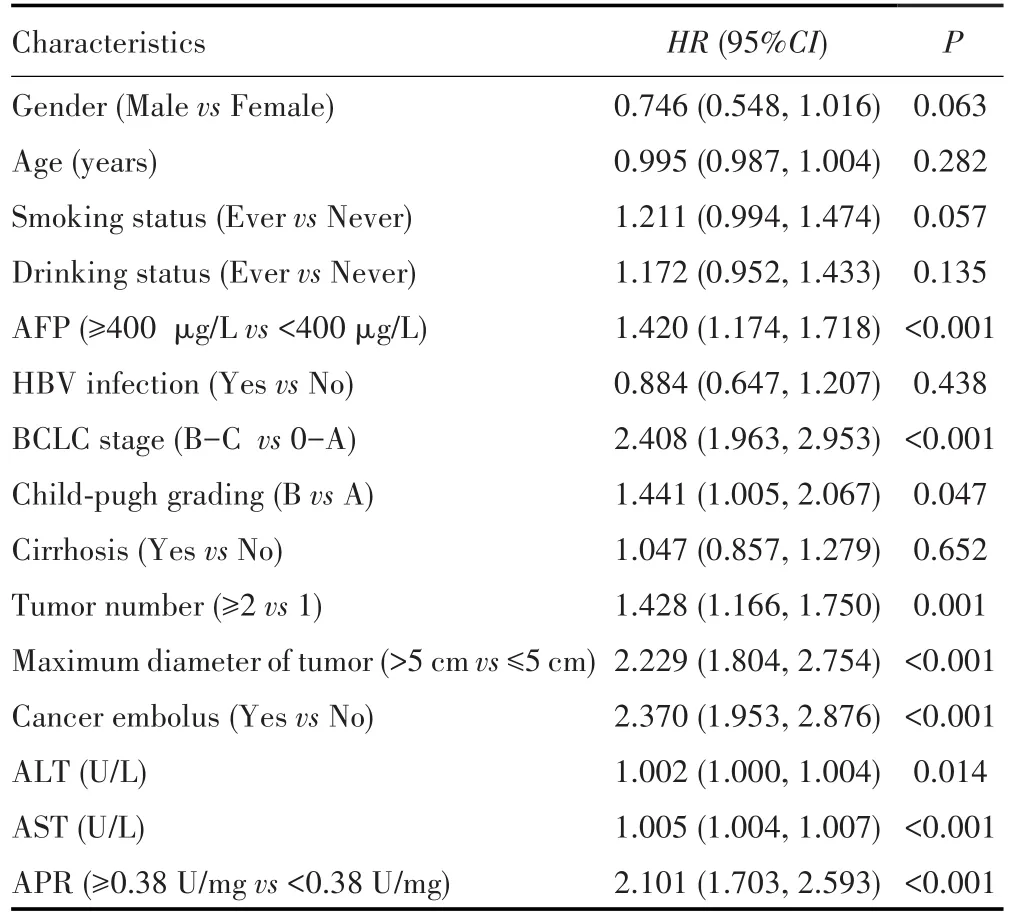
表2 HCC患者肝切除术后的生存预后单因素Cox回归分析Tab.2 Univariable Cox regression analysis of survival prognosis of patients with HCC after hepatectomy
3 讨论
HCC的不良预后与多种因素相关,包括高BCLC分期[10]、肿瘤大小>5 cm[11]、有癌栓[12]、血清较高AST水平[13]等。近年来,肿瘤与炎症的相互作用越来越受到科研工作者的重视。机体微环境里炎症因子浓度的改变对肿瘤细胞的增殖以及转移具有不可忽视的作用[14]。MU等[15]发现不少炎症因子在HCC患者的预后中起着重要作用,如血清白细胞介素6(interleukin 6,IL-6)和肿瘤坏死因子-α(tumour necrosis factor-α,TNF-α)浓度越高,HCC患者预后越差。不同于传统的炎症指标,本研究探索的APR将营养指标与炎症指标结合起来,能更全面地预测患者的术后远期生存状况。
ALP是临床上比较常用的炎症指标,在肝脏疾病中,血清ALP水平明显升高[16]。有学者发现肿瘤细胞的快速增殖与细胞核仁的高ALP活性相关[17]。还有基础研究发现ALP与肿瘤发展中的上皮间质转化(epithelial-mesenchymal transition,EMT)存在关联[18]。与此同时,ALP是氧化应激的可靠指标,其在炎症反应中可产生活性氧,损伤DNA、蛋白质和脂质,从而促进肿瘤的发生发展以及远处转移[19]。而PA由肝脏合成,不仅能参与维生素A和甲状腺素的转运,还能通过加快淋巴细胞成熟从而增强机体免疫应答能力[20]。因PA半衰期较短,且术前静脉输注白蛋白或输血不会对其产生影响,因此PA在血浆中的含量变化能快速灵敏地反映肝脏合成蛋白的能力以及机体的营养状况,是可用于判断癌症患者预后的营养指标[8]。临床研究发现APR可作为胃癌的独立预后指标,且其效能优于中性粒细胞和淋巴细胞比值(neutrophils to lymphocytes ratio,NLR)和其他炎症指标[9]。本研究基于942例术后HCC患者的临床资料分析发现,与低APR组相比,高APR组患者年龄较大、HBV感染率较高、血清ALB水平较低、ALT和AST水平较高、合并肝硬化的比例较高、BCLC分期为B/C期的比例较大、肿瘤数目≥2个的比例较高、肿瘤最大径>5 cm的比例以及有癌栓的比例也更高,生存分析发现低APR组患者术后1年、3年、5年的总体生存率均高于高APR组。考虑可能是由于HCC患者PA降低可能导致患者淋巴细胞的成熟速度减慢和营养状况变差,从而使患者机体的免疫系统功能低下;此外ALP升高可能与肿瘤细胞增长以及远处转移相关,这为肿瘤细胞免疫逃逸创造了有利条件。在两者的共同作用下,患者肿瘤负荷更严重,从而对患者的长期预后产生不利影响。本研究还发现术前血清APR≥0.38 U/mg是影响HCC患者接受肝切除术后OS的独立危险因素,提示在围手术期应更加注重对患者的营养支持,缓解患者的高炎症状态,这对提高患者术后总生存时间具有重要作用。
本研究存在以下局限性;⑴本研究是单中心设计的回顾性队列研究,存在一定选择性偏移;⑵本研究只关注了术前部分血清指标,后期需要结合更多的指标进行联合分析;⑶所收集的临床资料还不够完整,如缺乏患者术后是否接受辅助性治疗的信息以及有效评估,这可能对最终结果产生影响;⑷APR在HCC复发、远处转移中确切的作用及其具体机制尚不清楚,后续还需要大样本前瞻性研究阐明高APR值对HCC患者不良预后的具体分子机制。
综上所述,本研究发现术前高APR与HCC患者的BCLC分期为B~C期、HBV感染、低血清ALB水平、高ALT和AST水平、肿瘤数目≥2个、肿瘤最大径>5 cm以及癌栓等恶性临床特征有关,且术前高APR是HCC患者肝切除术后预后的独立危险因素,提示术前高APR可作为HCC患者肝切除术后不良预后的预测因子。

