miR-449a通过NOTCH1介导铁死亡调控非小细胞肺癌细胞增殖和凋亡
贾晓琼 孙秋颖 刘晓宇 温珍平
作者单位:010020 呼和浩特 内蒙古医科大学附属人民医院肿瘤内科
非小细胞肺癌(non-small cell lung cancer,NSCLC)是肺癌中最常见的病理类型,占肺癌的80%以上,然而大多数患者就诊时已近晚期,预后较差[1-3]。因此,阐明NSCLC发生发展的分子机制对其诊断和治疗具有重要意义。微小RNA(microRNA,miRNA)是一类小的内源性非编码单链RNA,可通过结合靶基因3'-非翻译区中的互补序列来负调控mRNA稳定性和/或抑制mRNA翻译,且大多数miRNA以组织特异性方式作为肿瘤抑制因子或癌基因发挥作用,其失调与人类癌症的发生和进展密切相关[4]。miR-499a是2005年由BENTWICH等[5]利用计算机模拟和miRNA芯片技术发现的一种miRNA。在NSCLC研究中发现miR-499a在癌组织中表达下调,过表达miR-499a可抑制NSCLC细胞增殖和集落形成,阻滞细胞周期于G0/G1期,在裸鼠NSCLC移植模型中过表达miR-499a也可抑制肿瘤形成[6-7]。但是,miR-499a在NSCLC中的作用机制尚不明确。
NOTCH信号传导通路是决定细胞命运的最重要的通路之一,在细胞分化、增殖和凋亡中发挥重要作用[2,8]。既往研究显示,NOTCH信号通路相关蛋白异常表达与NSCLC发生发展密切相关[2]。而人髓核细胞中血红素诱导的铁死亡可能与NOTCH信号通路有关[9]。铁死亡是一种氧化的、铁依赖性的,区别于细胞凋亡、坏死和自噬的新型细胞程序性死亡方式[10-11]。大量研究表明,铁死亡与多种人类疾病有关,包括癌症、神经退行性疾病、缺血性再灌注损伤和肾退化等[10,12]。目前已有研究报道NSCLC细胞对铁死亡诱导剂敏感,且其发生发展与铁死亡密切相关[13]。然而,铁死亡在NSCLC发生发展中的调控机制尚不清楚。本研究通过构建过表达miR-499a的NSCLC细胞株,探索miR-499a是否通过NOTCH信号通路介导铁死亡而影响NSCLC细胞的增殖和凋亡,以期进一步阐明NSCLC发生发展的分子机制及开发新的治疗靶点。
1 材料与方法
1.1 细胞系及主要试剂
人NSCLC细胞株NCI-H1975和胎牛血清(FBS)均购自武汉普诺赛生命科技有限公司;青霉素、链霉素、胰酶、CCK-8试剂盒、β-Actin抗体(GB11001)、Ki67抗体(GB111141)和ECL显影液均购自武汉塞维尔生物科技有限公司;DMEM高糖培养基购自美国Gibco公司;miR-499a过表达类似物Agomir-499a及其阴性对照(NC)干粉、qPCR引物均购自武汉奥克鼎盛生物科技有限公司;LipofectamineTM2000(Lipo2000)购自美国Thermo Fisher Scientific公司;铁死亡抑制剂ferrostatin-1(Fer-1)和谷胱甘肽(GSH)均购自Sellect公司;Annexin V抗体购自美国BD公司;FeRhoNox-1购自日本Dojindo公司;TRIeasy总RNA提取试剂盒、BCA蛋白检测试剂盒和GSH检测试剂盒均购自上海碧云天生物研究所;ReverTra Ace qPCR RT Master Kit购自日本Toyobo公司;SYBR Premix Ex TaqⅡ试剂盒购自日本Takara公司;PTGS2(A1253)、ACSL4(A6826)、COX2(A1253)、SLC7A11(A2413)、NOTCH1(A19090)、JAG1(A12733)、JAG2(A14247)、DLL1(A14277)和HES1(A11718)抗体均购自武汉Abclonal公司。山羊抗兔(SA00001-2)、NICD(20687-1-AP)和山羊抗鼠(SA00001-1)二抗均购自武汉三鹰生物科技有限公司。
1.2 细胞转染和分组
NCI-H1975细胞复苏后加入含10% FBS和1×双抗的DMEM高糖培养基重悬,转至60 mm培养皿中,并置于37℃、5% CO2细胞培养箱中培养。每3 d进行1次传代培养,传代培养3代后进行后续实验。
收集细胞融合度约为80%的NCI-H1975细胞,用含10% FBS和1×双抗的DMEM高糖培养基重悬细胞,以2×104/孔接种于12孔板中,加入10% FBS的DMEM高糖培养基继续培养24 h。实验分为6组:NC组、Agomir-499a组、Fer-1组、Agomir-499a+Fer-1组、Agomir-499a+GSH组和GSH组,其中Agomir-499a组和NC组细胞用Lipo2000转染试剂分别转染50 μmol/L的Agomir-499a和NC,Agomir-499a+Fer-1组和Agomir-499a+GSH组细胞在转染50μmol/L的Agomir-499a时分别加入20 μmol/L铁死亡抑制剂Fer-1和4 mmol/L GSH处理,Fer-1组和GSH组细胞分别加入20 μmol/L铁死亡抑制剂Fer-1和4 mmol/L GSH处理。各组细胞继续培养24 h,收集细胞待用。
1.3 CCK-8实验检测NCI-H1975细胞活力
NCI-H1975细胞以5×103/孔接种至96孔板后,置于37℃、5% CO2细胞培养箱中培养,使用Lipo2000转染试剂分别转染50 μmol/L的Agomir-499a和NC,并分别于培养0 h、24 h、48 h和72 h后加入CCK-8溶液,于37℃继续孵育1 h,采用酶标仪测定450 nm的光密度(OD)值,计算细胞增殖活力。每组设6个复孔,实验重复4次。
1.4 Ki67染色法检测NCI-H1975细胞增殖
取转染后的NCI-H1975细胞,用PBS洗涤,4%多聚甲醛固定15 min,再用PBS洗涤,加入500 μL的1%TritonX-100溶液,室温孵育30 min;PBS洗涤后,加入Ki67抗体(1∶200),室温孵育1 h;PBS洗涤后,加入Alexa Fluor594偶联二抗(1∶200),室温孵育1 h;PBS洗涤后,再加入5μL的DAPI工作液,室温孵育5min;PBS洗涤后,滴加抗荧光淬灭剂并封片。采用Olympus FV1000显微镜拍照,Image Pro Plus 6.0分析细胞增殖比例(Ki67+DAPI+/DAPI+)。
1.5 流式细胞术检测NCI-H1975细胞凋亡
取转染后的NCI-H1975细胞,用PBS洗涤,经乙二胺四乙酸消化液消化2 min后收集细胞,细胞沉淀加入400 μL的1%BSA重悬后,加入5 μL Annexin V-FITC抗体,室温避光孵育30 min,200 g离心5 min,PBS洗涤2次;加入5 μL的DAPI工作液后,立即采用FACS Calibur型流式细胞仪检测细胞凋亡百分比(Annexin V+DAPI-,%)。
1.6 荧光探针法检测NCI-H1975细胞内的Fe2+水平
NC组、Agomir-499a组、Fer-1组及Agomir-499a组+Fer-1组的NCI-H1975细胞用PBS洗涤后,加入含1 μmol/L FeRhoNox-1(Dojindo,Kumamoto,Japan)的Hank's平衡盐溶液,于37℃、5% CO2条件下孵育30 min,立即用荧光显微镜(Leica DMI8,Weztlar,German)成像,使用Cy3 滤光片(ex 514nm,em 525-596)获得图像并用Image Pro Plus 6.0分析Fe2+的荧光强度。
1.7 光学比色法检测NCI-H1975细胞内GSH的含量
NC组、Agomir-499a组、GSH组和Agomir-499a组+GSH组的NCI-H1975细胞用预冷的PBS洗涤后,每孔分别加入400 μL细胞裂解液,冰上孵育10 min,超声破碎5 s后,4℃下以10 000 g离心10 min,收集上清液。取50 μL上清液,然后按照GSH检测试剂盒说明书的操作步骤测定细胞内总GSH水平。
1.8 qRT-PCR 检测 miR-499a、PTGS2、ACSL4、TF、TFRC、STEAP3和DMT1的表达
采用TRIeasy总RNA提取试剂盒分离提取各组细胞中的总RNA,并通过Nanodrop 2000测定RNA纯度和浓度。每个样本取1 μg的总RNA,采用ReverTra Ace qPCR RT Master Kit对其反转录为cDNA,以ACTB为内参,采用SYBR Premix Ex Taq Ⅱ试剂盒检测PTGS2、ACSL4、TF、TFRC、STEAP3和DMT1 mRNA的表达;以U6为内参,采用SYBR Premix Ex Taq Ⅱ试剂盒检测miR-499a的表达。使用LightCycler 96仪器进行检测,反应体系:20 μL;反应条件:95 ℃、3 min,1次循环;95℃、5 s,60℃、15 s,35次循环。PCR各引物序列见表1。采用2-ΔΔCt法计算各目的基因的相对表达水平。

表1 qRT-PCR引物序列Tab.1 qRT-PCR primer sequences
1.9 Western blot检测铁死亡及NOTCH1信号通路相关分子的表达
用RIPA裂解液提取各组细胞中的总蛋白,4℃下以14 000 g离心10 min后,收集上清液,用BCA检测蛋白浓度并于95℃下干热变性10 min。取30 g蛋白上样量,经10%十二烷基磺酸钠-聚丙烯酰胺凝胶电泳分离胶电泳分离后,在200 mA恒流下湿转2 h至聚偏二氟乙烯膜,用含5%BSA的TBST溶液室温封闭 1 h,加 入 PTGS2、ACSL4、COX2、SLC7A11、NOTCH1、NICD、JAG1、JAG2、DLL1、HES1和β-Actin一抗后,4℃摇床孵育12 h后,用TBST室温漂洗;加入含二抗的TBST溶液,继续孵育2 h,TBST漂洗后,加入ECL进行显色。以β-Actin为内参,采用Image J软件分析目的蛋白条带的灰度值。
1.10 统计学方法
采用SPSS 22.0软件进行数据分析。计量资料以均数±标准差()表示,两组间比较采用独立样本t检验;多组间比较采用单因素方差分析,组间两两比较采用LSD-t检验,以双侧P<0.05为差异有统计学意义。统计图均采用GraphPad Prism 8.0软件绘制。
2 结果
2.1 miR-449a对NCI-H1975细胞增殖和凋亡的影响
qRT-PCR检测结果显示,与NC组相比,Agomir-449a组的NCI-H1975细胞中miR-499a表达水平明显增加(P=0.001),表明过表达miR-499a的NCI-H1975细胞构建成功,见图1A。CCK-8检测结果显示,与NC组比较,Agomir-449a组的NCI-H1975细胞在24 h、48 h和72 h的细胞活力均明显降低(P=0.045、0.048、0.039),见图1B。Ki67染色结果也显示,Agomir-449a组Ki67+DAPI-增殖细胞的比例较NC组明显减少(P=0.024),见图1C~D。流式细胞术检测结果显示,相比于NC组,Agomir-449a组的Annexin V+DAPI-细胞比例明显增加(P=0.004),见图1E~F。

图1 miR-449a抑制NCI-H1975细胞增殖和诱导细胞凋亡Fig.1 miR-449a inhibited proliferation and induced apoptosis of NCI-H1975 cells
2.2 miR-449a对NCI-H1975细胞中铁死亡相关因子的影响
qRT-PCR和Western blot检测结果显示,与NC组比较,Agomir-449a组NCI-H1975细胞的铁死亡相关基因PTGS2和ACSL4mRNA与 PTGS2、ACSL4和COX2蛋白的表达均明显增加(均P<0.05),见图2A~D。进一步采用铁死亡抑制剂Fer-1处理后,Agomir-449a+Fer-1组的PTGS2、ACSL4和COX2蛋白表达明显低于Agomir-449a组(均P<0.05),见图2E~F。

图2 miR-449a在NCI-H1975细胞中诱导铁死亡Fig.2 miR-449a induced ferroptosis in NCI-H1975 cells
2.3 miR-449a对NCI-H1975细胞铁稳态的影响
FeRhoNOX-1免疫荧光染色结果显示,相比于NC组,Agomir-449a组的NCI-H1975细胞的Fe2+细胞比例明显增加(P=0.008),见图3A~B。qRT-PCR检测结果显示,Agomir-449a组铁稳态相关基因TF、STEAP3、TFRC和DMT1mRNA的表达均较NC组明显增加(P=0.004、0.042、0.003、0.003),见图3C~F。进一步采用铁死亡抑制剂Fer-1处理后,相比于Agomir-449a组,Agomir-449a+Fer-1组的Fe2+细胞比例明显降低(P=0.049),见图3A~B;TF和STEAP3 mRNA表达明显降低(P=0.048、0.039),但TFRC和DMT1 mRNA表达差异无统计学意义(P=0.852、0.426),图3C~F。
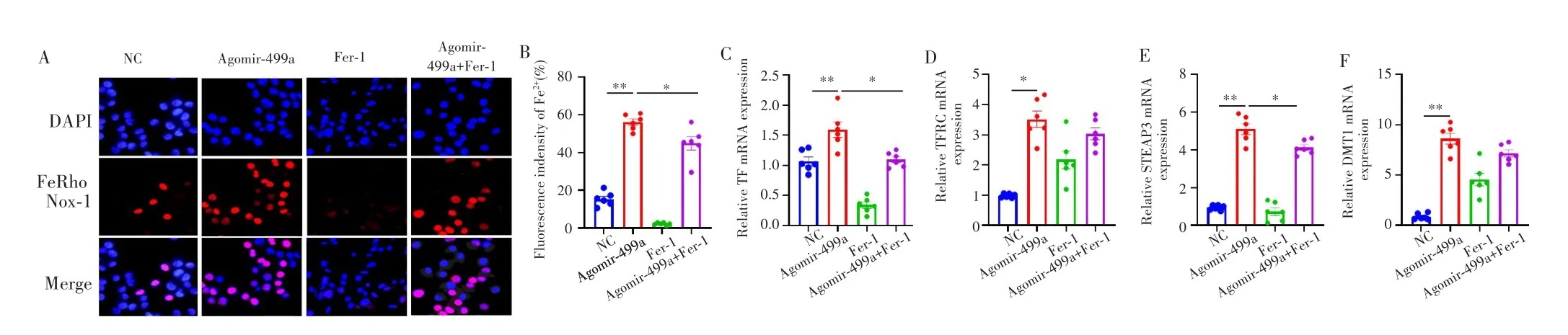
图3 miR-449a破坏NCI-H1975细胞中的铁稳态Fig.3 miR-449a disrupted iron homeostasis in NCI-H1975 cells
2.4 miR-449a对NCI-H1975细胞GSH的影响
光学比色法检测结果显示,相比于NC组,Agomir-449a组NCI-H1975细胞的GSH含量明显降低(P=0.004),见图4A;Western blot检测结果显示,铁死亡相关蛋白SLC7A11、COX2和ACSL4的表达均明显增加(P=0.002、0.006、0.004),见图4B~G。进一步采用铁死亡抑制剂Fer-1处理后,相比于Agomir-449a组,Agomir-449a+Fer-1组的GSH含量明显增加(P=0.042),SLC7A11蛋白表达明显降低(P=0.004),见图4A~C;而用GSH处理后,Agomir-449a+GSH组的SLC7A11、COX2和ACSL4蛋白表达较Agomir-449a组明显降低(P=0.026、0.014、0.020),见图4D~G。
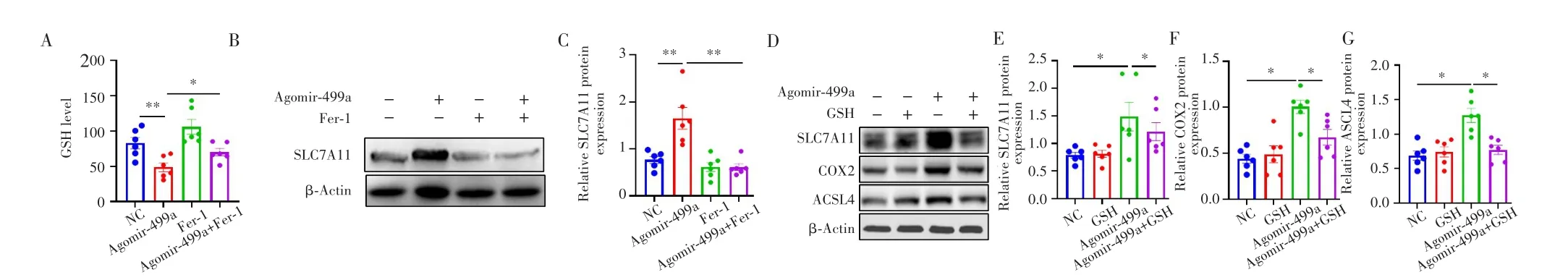
图4 GSH逆转NCI-H1975细胞中miR-449a诱导的铁死亡Fig.4 GSH reversed miR-449a-induced ferroptosis in NCI-H1975 cells
2.5 miR-449a对NCI-H1975细胞NOTCH1信号通路的影响
Western blot法检测结果显示,与NC组比较,Agomir-449a组NCI-H1975细胞中 NOTCH1、NICD、JAG1、JAG2、DLL1和HES1蛋白表达均明显降低(P=0.004、0.002、0.004、0.003、0.004、0.035);与 Agomir-449a组比较,Agomir-449a+Fer-1组NCI-H1975细胞的NICD、JAG1和DLL1蛋白表达明显增加(P=0.049、0.002、0.034),但NOTCH1、JAG2和HES1蛋白表达无明显变化(P=0.612、0.195、0.445)。见图5。

图5 miR-449a抑制NCI-H1975细胞中NOTCH1信号通路Fig.5 miR-449a inhibited NOTCH1 signaling pathway in NCI-H1975 cells
3 讨论
NSCLC的发生是一个复杂的多阶段过程,涉及广泛的致癌基因和肿瘤抑制基因的调节[1,14]。在这些肿瘤致癌和抑制基因中,miRNA已被认为在表观遗传变化中发挥调节作用[4,7],失调的miRNA可参与多种人类癌症的发生、进展和转移[4]。miR-499a作为细胞生长调控的重要分子,已有研究显示其可通过诱导细胞周期抑制和MAPK信号介导细胞增殖抑制[8,15]。本研究探讨了miR-499a过表达对NSCLC细胞增殖及凋亡的作用,结果发现miR-499a过表达可明显抑制NCI-H1975细胞的增殖能力,并促进细胞凋亡。铁死亡是一种受到铁依赖性形式的程序性细胞死亡方式,可通过胱氨酸/谷氨酸逆向转运蛋白SLC7A11影响细胞内胱氨酸转运和GSH合成,继而诱导PTGS2、ACSL4和COX2等铁死亡相关因子的表达[12,16]。本研究发现过表达miR-499a后,NCI-H1975细胞中铁死亡相关因子PTGS2、ACSL4和COX2明显高表达,提示miR-499a可能通过诱导铁死亡,从而抑制NSCLC细胞增殖。铁是铁死亡程序激活的重要信号[16]。本研究进一步分析NCI-H1975细胞中Fe2+水平和铁稳态相关基因TF、STEAP3、TFRC和DMT1的表达,发现miR-499a过表达可增加Fe2+细胞比例,同时促进铁离子摄取分子TF和TFRC以及铁离子代谢分子STEAP3和DMT1的表达上调,说明miR-499a具有调节NCI-H1975细胞铁离子稳态的作用。但是,在使用铁死亡抑制剂Fer-1条件下,miR-499a过表达并未影响TFRC和DMT1的表达,说明miR-499a过表达主要通过诱导铁离子与TF的结合,以及还原铁离子的方式影响细胞内铁离子稳态。SLC7A11介导的细胞内胱氨酸转运和GSH合成是铁死亡程序激活的另一重要途径[16]。而GSH消耗是铁死亡和氧化应激必不可少的标志[10,16]。在本研究中,miR-499a过表达可抑制NSCLC细胞中GSH含量并促进SLC7A11的表达,而在加入GSH后,铁死亡相关因子SLC7A11、COX2和ACSL4表达降低,进一步证实miR-499-5p诱发NSCLC细胞铁死亡与GSH消耗有关,miR-499a可通过诱导铁死亡信号而抑制NSCLC细胞增殖。
NOTCH信号传导在细胞分化、增殖和凋亡中发挥着重要作用,也是铁死亡的重要调控信号[2,8,17]。有研究发现,miR-499a可通过抑制NOTCH1信号通路降低胶质瘤细胞增殖能力,同时加速细胞凋亡[15]。在前列腺癌的研究中,下调miR-449a可导致TMPRSS2:ERG融合阳性前列腺癌细胞中的NOTCH信号增强,促进细胞迁移和侵袭[8]。本研究结果也表明miR-499a具有抑制NCI-H1975细胞NOTCH1信号通路的作用,miR-499a过表达时NOTCH1活化形态NICD、NOTCH1下游HES1转录抑制因子以及NOTCH1配体JAG1、JAG2与DLL1的蛋白表达均下调,提示miR-499a可能通过抑制NOTCH1信号通路降低NSCLC细胞增殖能力,同时加速细胞凋亡。此外,BEBBER等[18]在人小细胞肺癌的研究中发现,cMyc激活NOTCH信号通路可促使小细胞肺癌细胞对铁死亡敏感性增加,提示NOTCH信号通路是铁死亡的潜在调控分子机制。本研究在联合使用铁死亡抑制剂Fer-1的条件下,也发现miR-499a对铁死亡的调控与NOTCH1的活化和促进NOTCH1与配体JAG1和DLL1的结合有关,说明miR-449a可能通过NOTCH1介导NSCLC细胞的铁死亡。
综上所述,miR-499a具有抑制NSCLC细胞增殖和激活铁死亡信号的作用,其调控机制与抑制NSCLC细胞中的NOTCH1信号通路有关。本研究结果为探讨NSCLC发生发展机制提供了实验依据,并为NSCLC的靶向治疗提供了新思路。

