VX2和人骨肉瘤MG-63兔成瘤模型的建立和比较
贺倩倩 杨少玲 赵坤 胡静 林文华 张红珍 顾家红 赫兰
作者单位:412000 株洲 1株洲市人民医院超声科;200035 上海 2上海市第八人民医院超声医学科;201499 上海3安徽理工大学附属上海市奉贤区中心医院超声科
骨肉瘤是一种原发于骨的恶性肿瘤,最常见于股骨远端或胫骨近端。新辅助化疗加手术切除使骨肉瘤患者的长期生存率提高至60%~70%[1],但截肢、肺转移和药物毒性等仍然是面临的巨大挑战。因此,继续探索更有效的骨肉瘤治疗方案尤为必要。目前,骨肉瘤的治疗方案逐渐转变为以保肢为主要目的的综合治疗[2],其中肿瘤微创治疗因其针对性强,创伤性小而显示了具大潜力。近年来,迅速发展的肿瘤微创治疗技术有微波、射频、高强度聚焦超声(high intensity focused ultrasound,HIFU)等,但是这些方法的应用及安全性还需要合适的动物模型进行研究。将骨肉瘤细胞混悬液或者肿瘤块植入裸鼠骨髓腔内成瘤是最常用的建模方法[3-4]。但是裸鼠的体积较小,不适用于骨肉瘤治疗方法(如保肢治疗)及影像学研究。兔广泛用于生物医学研究领域,其中新西兰白兔、美国荷兰兔和加利福尼亚兔是最常见的实验兔[5]。同时,兔体积大,生存能力强,常被用于影像学、射频消融及HIFU等研究。目前应用VX2肿瘤块原位移植建立兔骨恶性肿瘤模型已是一项成熟的技术[6-7]。但是VX2为上皮类肿瘤细胞系,因此不能完全模拟人类骨肉瘤的临床特征。人骨肉瘤MG-63细胞来源于人类骨肉瘤,研究发现将人骨肉瘤MG-63细胞悬液或肿瘤块植入裸鼠胫骨内建立骨肉瘤模型,成瘤率高,且模型稳定[4]。为了进一步探讨MG-63骨肉瘤块在中等体型动物体内移植建立骨肉瘤模型的可行性,本研究以
VX2肿瘤块为对照,观察MG-63骨肉瘤块在兔体内的成瘤特性及其影像学表现,为骨肉瘤的临床治疗研究提供实验模型。
1 材料与方法
1.1 主要材料
1.1.1 实验动物 普通级新西兰白兔36只,雌雄各半,2月龄,体重为2.1~2.3 kg,购自上海奉贤辉煌养殖场[许可证号:SCXK(沪)2019-0003;动物质量合格证号:20190003000364]。所有新西兰白兔均饲养于上海奉贤辉煌实验动物养殖场[许可证号:SYXK(沪)2018-0020],普通饲料喂养,自由进食、进水。饲养环境:昼夜各半循环,湿度恒定,温度控制在22~26℃之间。2只VX2荷瘤兔(VX2肿瘤块移植后2周,背部可见大小为1~2 cm的肿块)购自济源市博越生物工程有限公司,雄性,3月龄,体重为2.0~2.5 kg,动物质量合格证号:202105425。本研究所有操作均符合安徽理工大学附属上海市奉贤区中心医院的联合培养单位——华东师范大学实验动物伦理学要求(伦理审批号:Rb20200401)。
1.1.2 细胞系及主要试剂 人骨肉瘤MG-63细胞购自中国科学院细胞库;DMEM培养基、胰蛋白酶、青霉素-链霉素购自美国Gibco公司;胎牛血清、磷酸盐缓冲液(PBS)购自新西兰Hyclone公司;碱性磷酸酶(AKP)检测试剂盒(微板法)购自南京建成生物工程研究所;地西泮注射液购自天津金耀氨基酸有限公司(规格:10 mg/2 mL,批号:20190930)。戊巴比妥钠购自美国Sigma公司。
1.2 人骨肉瘤MG-63荷瘤兔的建立和传代
随机选取12只新西兰白兔用于建立MG-63荷瘤兔及传代。人骨肉瘤MG-63细胞复苏后培养于含10%胎牛血清和1%双抗的DMEM高糖培养基中,隔日换液、传代,在对数生长期收集细胞并计数,用PBS稀释为5×108/mL的细胞混悬液,置冰上备用。随机选取6只新西兰白兔经肌肉注射地西泮(1 mg/kg)镇静麻醉后,将其仰卧固定于兔台上,右后肢近腹股沟处脱毛,皮下注射0.1 mL MG-63细胞混悬液。3~4周后,有3只兔的右后肢近腹股沟处皮下可见肿块形成,待肿瘤长至1~2 cm3时,按上述方法麻醉荷瘤兔后以空气栓塞法处死,在无菌条件下取无坏死的肿瘤组织,剪成约1 mm3大小的瘤块,植入麻醉后的新西兰白兔右后肢腹股沟处皮下。如此连续传代3次,每次2只。
1.3 动物分组及模型的建立
24只新西兰白兔随机分为VX2组和MG-63组,每组12只。VX2组:2只VX2荷瘤兔在肌肉注射地西泮(1 mg/kg)镇静麻醉状态下,以空气栓塞法处死,于无菌条件下迅速取出无坏死的肿瘤组织,剪成约1 mm3的瘤块,放入生理盐水中备用。12只新西兰白兔经肌肉注射地西泮(1 mg/kg)镇静麻醉后,再以1.5%的戊巴比妥钠(2 mL/kg)静脉注射追加麻醉,将其仰卧固定于兔台上,右侧胫骨平台处脱毛,常规消毒,切开皮肤约1 cm长,用18 G骨穿针在胫骨平台处钻孔,有落空感后停止进针,拔出针头,每只兔均置入2块VX2瘤块,骨蜡封闭钻孔,缝合皮肤后再次用75%的酒精消毒以预防伤口感染。MG-63组:按照VX2组的处理步骤,处死第三代MG-63荷瘤兔后,剪取约1 mm3的瘤块并置入12只新西兰白兔的右侧胫骨上段骨髓腔内,每只兔均置入2块MG-63瘤块,骨蜡封闭钻孔,缝合皮肤后再次用75%的酒精消毒预防伤口感染。每天观察两组实验兔移植处切口愈合情况及有无肿块形成。
1.4 超声检查
分别于建模后3周、4周、5周,经耳缘静脉注射1.5%戊巴比妥钠(2 mL/kg)麻醉两组实验兔。将实验兔后肢毛发剃除后,仰卧固定于兔台上,对其移植侧胫骨行彩色多普勒超声检查。超声检查采用GE Vivid E9彩色多普勒超声诊断仪,配备9 L线阵探头,频率10 MHz;使用肌骨预置模式、涂抹耦合剂、调整图像深度、获取二维及彩色多普勒(color Doppler flow imaging,CDFI)图像。以未移植侧胫骨作为对照。
1.5 X线及CT检查
于建模后4周,超声检查结束后对两组实验兔进行X线及CT检查。X线检查采用西门子DR机(Axiom Aristos VX Plus,德国),电压50 kv,电流3.0 mA,曝光时间10.8 ms;X线包括右侧胫骨的正侧位投照。CT采用联影公司16排CT机(uCT510,中国),进行常规的轴位平扫,电压100 kV,电流100 mA,层厚3 mm,螺距0.9375∶1;采集图像后对移植侧进行轴位三维重建。由2名有10年以上工作经验的放射科医师阅片,观察骨质破坏、骨膜反应、肿瘤骨形成及周围软组织浸润情况等。以未移植侧胫骨作为对照。
1.6 AKP检测
在建模前及建模后4周成瘤明显时抽取两组实验兔的耳缘静脉血,室温下放置2 h,置于4℃离心机内,10 000 rpm离心20 min,抽取上清液保存于-80℃冰箱内。样本收齐后,将待测样本在室温下放置1 h,取出96孔板,设置空白孔(加入5 μL双蒸水)和标准孔(加入5 μL 0.1 mg/mL的酚标准应用液),样本孔分别加入5 μL待测样本,然后分别在空白孔、标准孔及样本孔内依次加入缓冲液和基质液,充分混匀后在37℃水浴锅内水浴15 min,加入显色剂后应用酶标仪检测520 nm处光密度(OD)值,再根据OD值计算血清中AKP浓度。
1.7 病理学检查
两组均于建模后3周、4周影像学检查结束后用空气栓塞法处死3只已成瘤的实验兔,于建模后5周影像学检查结束后处死剩余实验兔进行病理检查。操作方法:在肌肉注射地西泮(1 mg/kg)镇静麻醉状态下,应用空气栓塞法处死实验兔后迅速解剖,重点观察移植瘤大小、胫骨破坏程度及肿瘤浸润情况,游标卡尺测量移植瘤大小,观察有无腹腔及胸腔内脏器转移。胫骨用4%多聚甲醛液固定1周后,放入稀盐酸溶液中脱钙1周,在病理科进行石蜡包埋、切片及HE染色;肺部转移灶经4%多聚甲醛固定24 h,石蜡包埋,连续切片后进行HE染色;于显微镜下观察并拍照。
1.8 统计学方法
采用SPSS 24.0对数据进行统计分析,计量资料呈正态分布且方差齐用均数±标准差(x±s)表示,两组实验兔的血AKP浓度比较采用独立样本t检验,每组实验兔建模前及建模后4周血AKP浓度比较采用配对样本t检验,两组实验兔骨质破坏、骨膜反应、肿瘤骨形成、软组织浸润的发生率应用Fisher检验比较。以双侧P<0.05表示差异有统计学意义。
2 结果
2.1 两组实验兔成瘤及转移情况
建模时VX2组和MG-63组各有1只实验兔死于麻醉意外,建模后2周VX2组有1只实验兔因肠梗阻死亡,最终VX2组有10只实验兔、MG-63组有11只实验兔纳入分析。建模后,两组实验兔移植处切口愈合良好。
两组实验兔建模后1周、2周、3周、4周、5周的成瘤及转移情况如表1所示。建模后1周、2周、3周,VX2组成瘤率分别为60.0%(6/10)、90.0%(9/10)、100.0%(10/10),MG-63组成瘤率分别为 0、45.5%(5/11)、63.6%(7/11),至实验结束MG-63组仍有2只实验兔未见肿块形成。

表1 两组实验兔的成瘤及肺部转移情况Tab.1 The of tumor formation and lung metastasis of rabbits in two groups
建模后3周和4周两组各处死3只已成瘤实验兔,其中VX2组肺部转移率均为66.7%(2/3);MG-63组建模后3周未见肺部转移,建模后4周见肺部转移1只,肺部转移率为33.3%(1/3)。建模后5周处死全部实验兔,VX2组肺部转移率为100.0%(4/4),MG-63组肺部转移率为40.0%(2/5)。所有实验兔均未见腹腔脏器转移。
2.2 两组实验兔的血AKP浓度
建模后4周,VX2组血AKP浓度较建模前明显升高(t=-6.952,P=0.002),且显著高于MG-63组(t=6.953,P<0.001);MG-63组AKP浓度较建模前升高,但差异无统计学意义(t=2.161,P=0.097)。见图1。

**P<0.01,vs baseline in VX2 group;###P<0.001,vs VX2 group
2.3 两组实验兔的彩色多普勒超声表现
建模后3周、4周、5周,两组实验兔未移植侧胫骨二维超声均表现为骨皮质连续、平滑、光整,CDFI未见明显血流信号(图2A、2D)。
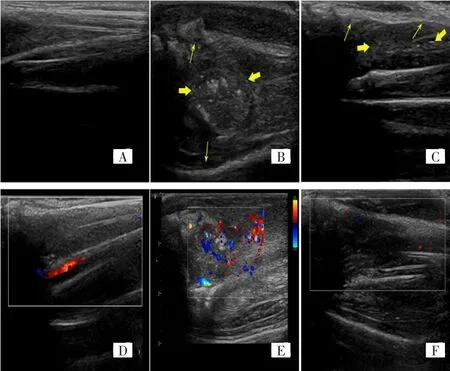
图2 两组实验兔建模后4周的胫骨超声图像Fig.2 Ultrasonic images of tibia of rabbits at 4 weeks after modeling in two groups
建模后3周,VX2组所有实验兔移植处骨髓腔内可见类似圆形或椭圆形的低或等回声肿块,边界不清,内回声不均匀;骨连续性中断,被低回声取代;肿瘤侵犯周边软组织形成边界不清的低回声区,CDFI示肿块内短线状血流信号。建模后4周,VX2组所有实验兔骨髓腔内肿块均较前增大,且出现点状或片状强回声团,胫骨骨质破坏明显,部分呈“齿梳状”改变,肿瘤穿破骨组织,浸润周围软组织形成混合回声肿块;肿块无包膜,边界不清,CDFI示肿块内丰富的条状血流信号(图2B、2E)。建模后5周,超声显示肿块较前增大,且骨质破坏更明显。
建模后3周,MG-63组成瘤兔移植处骨髓腔内肿块呈不规则低回声区,边界尚清,内回声不均匀,可见点状高回声;骨连续性尚好,骨皮质毛糙,周边软组织未见肿块影,CDFI示肿块内少许点状血流信号。建模后4周,MG-63组成瘤兔超声表现为骨髓腔内低回声包块较前增大,可见点状强回声,骨皮质毛糙,破坏轻微,局部向外膨出;周边软组织内可见边界清晰的低回声包块,有包膜,CDFI可见肿块内点线状血流信号(图2C、2F)。建模后5周,MG-63组成瘤兔超声显示肿块较前稍大,可见点状强回声及无回声区,骨质轻微破坏。MG-63组未成瘤兔的右侧胫骨超声表现与未移植侧胫骨相同。
2.4 两组实验兔的放射影像学表现
建模后4周,两组实验兔未移植侧胫骨影像学均表现为骨皮质连续、平滑、光整(图3A、3E)。移植侧胫骨影像学表现:VX2组X线平片示移植侧胫骨上段肿胀膨大,骨皮质破环明显,可见骨膜反应(图3B),部分可见病理性骨折现象;CT横断面扫查可见胫骨上端肿胀,骨皮质破坏明显,可见低密度肿瘤组织,肿瘤内可见新生肿瘤骨形成(图3C);CT三维重建可见明显的骨质破坏及肿瘤骨形成(图3D)。MG-63组成瘤兔X线平片示骨质未见明显破坏征象,周围可见高密度的软组织肿胀影(图3F);CT横断面扫查可见部分胫骨上段骨皮质破坏轻微,周围软组织肿胀(图3G),有1只实验兔可见肿瘤骨形成;CT三维重建可见胫骨上段骨表面不光滑(图3H)。两组实验兔骨质破坏、骨膜反应、肿瘤骨形成及软组织浸润情况见表2。

图3 两组实验兔建模后4周的胫骨放射影像学图像Fig.3 Radiographic images of tibia of rabbits at 4 weeks after modeling in two groups

表2 两组实验兔建模后4周的相关影像学征象[n(%)]Tab.2 The osteosarcoma related image signs in two groups of rabbits 4 weeks after modeling[n(%)]
2.5 两组实验兔的病理学表现
肉眼观察VX2组见移植侧胫骨明显肿大,纵向切开胫骨,可见骨质破坏显著,骨髓腔内可见新鲜鱼肉样肿瘤组织,中央可见点灶状豆渣样坏死;肿瘤浸润至周围软组织,使其呈鱼肉样改变,且与周围正常组织边界不清,无包膜,肿块内可见较多粗大血管走行。右侧胫骨骨髓腔内肿块及肺部转移灶HE染色见大小不等、形状各异、排列紧密的肿瘤细胞;细胞体积增大,核质比增高,可见病理性核分裂,肺部转移灶坏死明显(图4A~C)。

图4 两组实验兔移植瘤和肺部转移灶HE染色及胫骨大体标本Fig.4 HE staining of tumor and lung metastases and gross specimens of tibia in two groups
肉眼观察MG-63组见移植侧胫骨稍肿大,纵向切开胫骨,骨质破坏较轻微,骨髓腔内可见少许鱼肉样肿瘤组织,中央可见少许点状豆渣样坏死物质。周围软组织肿块有包膜,包膜上可见粗大迂曲的血管,肿块内可见点灶状坏死。成瘤兔胫骨骨髓腔内肿瘤及肺部转移灶HE染色可见肿瘤细胞颜色深染,排列紧密,可呈圆形、短梭形、多角形,核质比例增高,周边的软组织内亦可见肿瘤细胞浸润(图4D~F)。
3 讨论
目前用于制作骨肉瘤模型的实验动物主要有鼠、兔、犬等。研究表明,采用免疫缺陷裸鼠构建的骨肉瘤移植模型成瘤率高且稳定[8-9]。但是,裸鼠体积较小,不适用于骨肉瘤新治疗方法的研究;犬大多用于构建自发骨肉瘤模型,此类模型成瘤时间长且不稳定。1950年BARNES等[10]通过静脉注射铍成功诱导了兔骨肉瘤的发生,但该法因成瘤时间长且肿瘤发生部位不明确而较少采用。既往研究显示,将VX2肿瘤块植入兔胫骨骨髓腔内建立的VX2骨肉瘤模型成瘤率高且模型稳定,同时具有骨质破坏、骨膜反应、软组织肿块和远处转移等特征,其生物学行为与恶性骨肿瘤相似[11],可作为骨肉瘤研究的实验动物模型。然而,VX2肿瘤为兔源性肿瘤细胞,用其制作的骨肉瘤模型在生物学特征上能多大程度模拟人类骨肉瘤目前尚未明确。相对而言,人骨肉瘤细胞系不仅可以更好地反映骨肉瘤患者的临床特征,还更利于研究结果的临床转化应用[12]。目前常用的人骨肉瘤细胞系包括MG-63、U2-OS、SOSP-M等[13]。其中MG-63细胞在裸鼠模型中已表现出较高的成瘤率和肺转移率[14]。本研究利用MG-63细胞建立与人类骨肉瘤更为接近的原位兔移植瘤动物模型,首先用人骨肉瘤MG-63细胞进行皮下成瘤传代,再植入兔胫骨骨髓腔内,结果显示,MG-63组实验兔建模后3周的成瘤率(63.6%)明显低于VX2组(100.0%),且至实验结束时MG-63组仍有2只实验兔未见肿块形成。影像学及病理检查发现,VX2组所有实验兔均可见骨质破坏,骨膜反应和肿瘤骨形成率也较MG-63组高,说明VX2组模型的稳定性高于MG-63组。考虑这可能是由于人骨肉瘤MG-63兔成瘤模型为异种移植而受到免疫排斥的影响[15]。
骨肉瘤是一种由不同分化程度的成骨细胞组成,以不断产生肿瘤样类骨质及持续高水平成骨活性为特征的恶性肿瘤。研究表明,AKP能准确反应成骨活动,骨肉瘤患者的AKP通常升高,但在接受过新辅助化疗及手术后患者血浆中AKP水平明显下降,提示肿瘤细胞被杀死,病理性成骨活动减少[16]。本研究发现,MG-63组实验兔建模后4周的AKP水平较建模前略有升高,但明显低于VX2组,这可能是由于MG-63组实验兔胫骨骨质破坏较轻微,成骨活动不明显造成。
CT和X线平片是骨肉瘤患者最常用的影像学检查方法,主要表现为骨质破坏、肿瘤骨、软组织肿块、骨膜反应和Codman三角等改变。本研究发现MG-63组在建模后4周的影像学检查中,所有实验兔均可见软组织肿块,仅有3只出现骨质破坏且较轻微,仅1只出现骨膜反应;总体上,MG-63组的骨质破坏率、骨膜反应率、肿瘤骨形成率均略低于VX2组,考虑可能是由于人骨肉瘤MG-63瘤块在兔自身的免疫排斥作用下对骨的破坏作用显著减低。相对于CT和X线平片,超声没有放射性,且可实时观察肿瘤的大小、周边组织的浸润情况,以及评估肿瘤的血供情况,在恶性肿瘤诊断、治疗及效果监测中发挥着重要作用。在正常情况下,超声束难以透过骨组织,通常在骨骼表面完全反射回去,因此无法观察骨皮质后方图像;但当骨皮质遭到破坏变薄、溶解时,超声束可能会部分穿透从而观察到后方声像[17]。本研究亦发现超声束可透过骨皮质而显示其后方的肿块声像及其血供情况。其中,VX2组实验兔的超声显示骨质破坏显著、骨髓腔内肿块、周边软组织浸润及肿瘤内丰富的血供;MG-63组实验兔的超声显示骨皮质破坏较轻,CDFI显示胫骨内肿块的血流不丰富,进一步说明MG-63组骨质破坏、肿瘤生长速度及肿瘤的供血情况均低于VX2组。
综上所述,与VX2组相比,MG-63骨肉瘤移植模型成瘤时间晚,成瘤率及肺转移率较低,稳定性较差,未来需要探索更适合于兔等中等体型动物的骨肉瘤模型。

