铁死亡调控通路及其在肿瘤放化疗和免疫治疗抵抗中的研究进展
王婷安 吴留成 韦尉元 凌通 黄名威 覃宇周
作者单位:530021 南宁 广西医科大学附属肿瘤医院胃肠外科
2012年,DIXON等[1]发现Erastin可诱导肿瘤细胞发生一种铁依赖的脂质过氧化损伤致细胞死亡,即铁死亡(ferroptosis)。这种新型细胞死亡方式在细胞形态改变及调控通路等方面均与坏死、凋亡、自噬等其他程序性细胞死亡方式显著不同[2]。电镜下主要表现为线粒体萎缩、膜密度增高、脊减少或消失等一些铁死亡的特征性微观形态学改变。研究表明,铁死亡在缺血再灌注损伤以及神经系统、血液系统、免疫系统、恶性肿瘤等多种疾病中均有重要作用[3]。本文将从铁死亡调控的分子机制及其在肿瘤放化疗、免疫治疗中的作用等前沿研究进行综述,并对铁死亡在肿瘤治疗领域的应用前景进行分析和展望。
1 铁死亡的调控机制
铁死亡主要由细胞内大量蓄积的Fe2+触发,引起Fe2+依赖的脂质过氧化物过度升高,导致氧化还原平衡破坏而最终导致细胞死亡[4]。铁死亡受多基因多通路调控,目前主要包括铁稳态调节通路、脂质代谢调节通路及胱氨酸/谷氨酸转运受体通路等(图1),但具体机制尚不清楚。
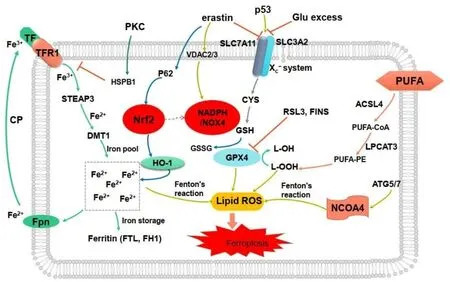
图1 铁死亡调控通路示意图Fig.1 The regulatory pathway of ferroptosis
1.1 铁稳态调节
机体细胞内铁可通过铁稳态调节通路保持平衡,参与诸如氧运输、DNA合成和三羧酸循环(tricarboxylic acid,TCA)等多种生理过程[5],通过对铁摄取、存储与外排的调控是影响细胞铁死亡的关键因素。铁在食物中多为Fe3+,经消化吸收后与转铁蛋白受体(transferrin receptor,TFR)结合转运至核内体,随后经铁氧还原酶STEAP3还原为Fe2+,而Fe2+再由二价金属转运蛋白1(divalent metal transporter 1,DMT1)释放至氧化还原活性铁池中,余下的铁则以铁蛋白轻链(ferritin light chain,FTL)以及铁蛋白重链 1(ferritin heavy chain 1,FTH1)的形式储存[6]。细胞内 Fe2+过量蓄积可经Fenton反应产生羟基自由基,如机体抗氧化能力不足以清除过量羟基自由基,则可导致细胞内过氧化物集聚而诱发铁死亡发生。
铁稳态由铁代谢相关基因调节,主要包括转铁蛋白(transferrin,TF)、TFR、铁调节蛋白2(iron-regulatory protein 2,IRP2)及核受体共激活因子4(nuclear receptor coactivator 4,NCOA4)等。研究显示,TFR在多种肿瘤中高表达,且与肿瘤异常增殖相关[7]。TFR1高表达与早期胃癌的分化程度显著相关[8],TFR2在结肠癌组织较正常肠黏膜高表达,且黏液腺癌患者的阳性表达率较非黏液腺癌患者明显增高[9]。NCOA4是一种铁蛋白特异性受体,铁蛋白中存储的铁可通过NCOA4介导的铁自噬释放至细胞质[10]。研究发现,敲除NCOA4可导致纤维肉瘤细胞和胰腺癌细胞对铁死亡的敏感性下调[11]。铁反应元件结合蛋白2(iron-responsive element-binding protein 2,IREB2)是铁代谢的主要调控因子之一,通过沉默IREB2可上调FTH1和FTL,从而显著抑制Erastin诱导的铁死亡[12]。此外,Ras-RAF-MEK信号通路在铁死亡调控中也具有重要作用,Ras基因可通过上调TFR,并下调膜铁转运蛋白(ferroportin,FPN)的表达,导致细胞内铁蓄积,从而增强铁死亡诱导剂的敏感性[13-14]。
1.2 脂质代谢调节
脂质代谢调控通路在铁死亡中发挥着重要作用[15]。多不饱和脂肪酸(polyunsaturated fatty acids,PUFAs)是细胞膜磷脂的重要构成成分,脂氧合酶(lipoxygenases,LOXs)可催化PUFAs出现特异性双氧化反应[16],生成脂肪酸氢过氧化物。累积的脂肪酸氢过氧化物经Fe2+介导的Fenton反应,进而催化为羟基自由基,从而直接诱导细胞发生铁死亡[17]。此外,长链脂酰辅酶A合成酶4(acyl-CoA synthetase long chain family member 4,ACSL4)可将花生四烯酸乙酰化成花生四烯酰,再通过溶血磷脂酰胆碱酰基转移酶3(lysophosphatidylcholine acyltransferase 3,LPCAT3)参与膜磷脂的合成,而膜磷脂上的PUFAs可脂质过氧诱发铁死亡[18]。总之,机体细胞内脂质过氧化物代谢失调是铁死亡发生的前提条件。
1.3 胱氨酸/谷氨酸转运受体通路及其他调控机制
研究表明,胱氨酸/谷氨酸反向转运体(System Xc-)、谷胱甘肽过氧化物酶 4(glutathione peroxidase 4,GPX4)、NADPH 氧化酶(NADPH oxidase,NOX)及线粒体外膜的电压依赖性阴离子通道(voltage-dependentanion channels,VDACs)等均可通过影响脂质过氧化物代谢调控铁死亡。
1.3.1 System Xc-System Xc-是由轻链亚基SLC7A11和重链亚基SLC3A2通过二硫键连接形成的异二聚体,可通过将谷氨酸转出细胞外,同时将胱氨酸摄入细胞内,随后转化成半胱氨酸,从而参与谷胱甘肽(glutathione,GSH)的合成[18-19]。GSH具有巯基结构,是机体内重要的自由基清除剂,可保护细胞免受氧化损伤,其在肿瘤细胞增殖及耐药治疗中具有重要作用。研究发现,Erastin可通过抑制SLC7A11阻滞胞外胱氨酸摄取,从而减少GSH的合成,从而增加细胞内脂质过氧化物蓄积而导致铁死亡[19]。p53可通过抑制SLC7A11蛋白表达,降低System Xc-的活性,在细胞铁死亡脂质过氧化物代谢中亦有重要调节作用[20]。
1.3.2 GPX4 GPX4可将机体内脂质过氧化物还原成H2O及对应的脂质醇,如GSH在GPX4的作用下可转化为GSSG,从而保护细胞膜免受氧化应激损伤[21]。研究发现[22-23],GPX4在肿瘤组织中高表达,与患者预后相关,而RSL3可直接共价键结合GPX4,导致细胞脂质过氧化ROS堆积,从而诱发铁死亡。FIN56也可通过抑制GPX4表达,并促进GPX4降解致使铁死亡的发生[24]。总之,GPX4是细胞铁死亡的一个关键调控因子,抑制GPX4可导致脂质ROS蓄积,最终诱导细胞铁死亡的发生。
1.3.3 NOX NADPH是机体细胞内清除脂质过氧化物的关键还原酶,可为GSSG转化成GSH的反应提供氢离子,而NOX的激活则可导致GSH含量下降、氧化应激产物蓄积,从而致使细胞死亡[25-26]。有研究发现,血管生成素样4(angiopoietin like 4,ANGPTL4)可激活NOX2而诱导卵巢癌细胞出现铁死亡[27]。GKT137831作为NOX1/4酶的特异性抑制剂,可通过降低肺癌细胞Calu-1对Erastin的敏感性,从而抑制细胞铁死亡的发生[1]。
1.3.4 VDACs VDACs是在线粒体外膜上广泛分布的膜蛋白,具有维持线粒体外膜通透性的重要作用。研究表明[28],Erastin可引起VDAC2/3通道失活,抑制NADPH的合成,降低细胞内GSH的含量。GSH作为体内重要自由基清除剂,可在谷胱甘肽过氧化物酶(GSH-Px)的催化下被氧化为GSSG,同时使H2O2还原为H2O。而GSSG在NADPH及GPX作用下重新被还原成GSH[29]。
1.3.5 其他调控通路p53是重要的抑癌基因,可调节肿瘤细胞增殖、分化及死亡等。近期有研究发现,p53在铁死亡过程中也具有重要的调节作用。Erastin可上调肺癌细胞中p53的表达,而p53可结合SLC7A11启动子,降低SLC7A11的表达,进而抑制System Xc-,减少胱氨酸摄取,GSH合成受阻,并最终诱导细胞铁死亡[30]。此外,p53还可激活亚精胺/精胺N1-乙酰基转移酶1(spermidine/spermine N1-acetyltransferase 1,SAT1),调控花生四烯酸-15脂氧合酶(arachidonate 15-lipoxygenase,ALOX-15),致使细胞内脂质ROS蓄积,从而诱导铁死亡[31]。
研究发现,转录激活因子4(activating transcription factor 4,ATF4)可上调System Xc-表达,沉默ATF4可导致SLC7A11表达下调,增加Erastin及索拉非尼诱导细胞发生铁死亡的敏感性[32]。此外,ATF4还可调控热休克蛋白 5(heat shock protein family A member 5,HSPA5)的表达,而HSPA5可与GPX4结合,从而维持GPX4稳定防止GPX4蛋白降解,进而抑制细胞脂质过氧化及铁死亡,同时诱导胰腺癌细胞出现吉西他滨耐药[33]。研究发现,沉默铁死亡抑制蛋白1(ferroptosis suppressor protein 1,FSP1)可增加细胞对铁死亡诱导剂的敏感性[34]。FSP1还可借助NADPH催化CoQ10(coenzyme Q10)的重复利用,清除脂质过氧化物ROS,抑制细胞铁死亡。
核因子E2相关因子2(nuclear factor erythroid 2-related factor 2,Nrf2)是机体调控氧化应激反应的重要转录因子之一。正常机体内,Kelch样ECH关联蛋白 1(Kelch-like ECH-associated protein 1,Keap1)与Nrf2相互作用,可促进Nrf2泛素化降解,将Nrf2保持在较低水平。但是在出现氧化应激时,Keap1中的半胱氨酸残基Cys273和288可形成二硫键,将Nrf2从Keap1解离释放,随后移位至细胞核与抗氧化反应元件(antioxidant response element,ARE)结合,Nrf2随之激活并将SLC7A11转运至细胞膜,与SLC3A2偶联共同构成System Xc-,从而调控细胞铁死亡过程[35]。
2 铁死亡与肿瘤放化疗抵抗
目前,放化疗仍是治疗恶性肿瘤的主要方法,然而化疗耐药性及放疗抵抗的形成往往导致肿瘤治疗失败,而该过程受多基因、多信号通路调控。肿瘤细胞往往通过阻滞药物摄取、促使药物泵出、抑制细胞凋亡发生并提高DNA修复机能等多条途径形成耐药性[36]。研究显示,肿瘤细胞氧化还原内环境的破坏是形成耐药性的关键。多数化疗药物是通过诱导肿瘤细胞出现凋亡而发挥抗肿瘤作用,例如导致细胞内ROS大量产生并在细胞内蓄积,导致氧化还原失衡,从而杀伤肿瘤细胞。但是,一旦肿瘤细胞通过激活代谢微环境重塑的调控机制,细胞内抗氧化系统与ROS水平达到平衡状态,则可增强肿瘤细胞防御氧化应激的能力,从而诱导耐药性的形成[16]。
近期研究显示,诱导肿瘤细胞铁死亡可增强化疗药物,如顺铂、阿糖胞苷及多柔比星等药物的化疗疗效,甚至可逆转肿瘤细胞耐药性,协助杀伤肿瘤细胞。比如,FAN等[37]研究发现,Erastin和磺胺嘧啶可通过抑制System Xc-活性,下调GPX4表达和减少GSH产生,使细胞内脂质ROS蓄积,并最终导致铁死亡,从而逆转头颈部肿瘤细胞对顺铂的耐药性。青蒿琥酯可通过增加卵巢癌耐药细胞中的过氧化物水平,抑制肿瘤迁移能力,并导致细胞发生铁死亡[38]。金属硫蛋白1G(metallothionein 1G,MT-1G)、核因子红细胞2相关因子2(nuclear factor,erythroid derived 2 like protein 2,NFE2L2)及p53作为铁死亡负调控因子,下调其表达可导致肝癌细胞内GSH消耗及脂质ROS堆积,诱发铁死亡产生,从而降低肝癌细胞耐药性并增强其对索拉非尼的敏感性[39]。
放射治疗是指通过高能电离辐射使肿瘤细胞DNA双链断裂,从而诱导细胞周期阻滞及凋亡而达到杀伤肿瘤目的,但部分恶性肿瘤患者发生放疗抵抗。研究发现,通过放疗可导致肿瘤细胞内大量脂质ROS产生,引起脂质过氧化物过度蓄积,从而诱导细胞出现铁死亡[40]。有研究报道,通过抑制System Xc-的轻链亚基(SLC7A11/xCT)活性,下调GPX4表达可能逆转部分肿瘤的放疗抵抗,增强放疗治疗敏感性[41]。
3 铁死亡与肿瘤免疫治疗
免疫治疗是近年新兴的肿瘤治疗模式,免疫逃逸则是导致肿瘤治疗失败的主要因素之一。因此,如何恢复免疫细胞识别进而杀伤肿瘤细胞功能也是当前的研究热点之一。目前,程序性细胞死亡蛋白-1(programmed death protein 1,PD-1)及程序性细胞死亡蛋白配体-1(programmed death ligand protein 1,PD-L1)抑制剂是临床上常用的免疫治疗药物,其作用机制是通过阻止机体内杀伤性T细胞表面的PD-1与肿瘤细胞表面的PD-L1结合,从而恢复T细胞对肿瘤细胞的识别及杀伤。研究发现,细胞脂质代谢及铁死亡在肿瘤免疫治疗调控中发挥着重要作用,机体内免疫细胞识别肿瘤细胞受多种细胞趋化因子及可溶性代谢物(如脂类)等调节,发生铁死亡的肿瘤细胞可通过释放脂质代谢产物,吸引免疫细胞以寻找肿瘤细胞信号[42-43]。
高迁移率族蛋白B1(high mobility group box 1 protein,HMGB1)是损伤相关分子蛋白家族(damage associated molecular patterns,DAMPs)的一员,同时也是影响肿瘤细胞免疫的关键因子,还是铁死亡进程的重要调控蛋白之一。铁死亡的肿瘤细胞可通过HMGB1-RAGE途径促进巨噬细胞极化并释放肿瘤坏死因子TNF,当HMGB1沉默后可阻断Erastin诱导的铁死亡发生[44]。GPX4缺陷的T细胞因脂质过氧化物蓄积,可诱发铁死亡而无法增殖[45]。但是在B细胞及弥漫性大B细胞淋巴瘤中,GPX4高表达可抑制细胞脂质过氧化及铁死亡的发生[46]。免疫细胞同样可调控肿瘤细胞铁死亡的发生。如在小鼠肿瘤模型中使用PD-L1抑制剂后可激活CD8+T细胞,释放的IFN-γ可经JAK1-STAT1通路抑制System Xc-活性,从而增加肿瘤细胞脂质过氧化物水平而诱导铁死亡发生,但一旦阻断铁死亡通路,PD-L1抑制剂对肿瘤细胞的杀伤能力则受到抑制[47]。
4 小结
铁死亡主要是由细胞内Fe2+及脂质过氧化物蓄积诱导的死亡方式。虽然目前研究证据表明,铁死亡调控通路主要涉及铁代谢、脂质代谢及System Xc-等,但触发脂质过氧化物蓄积具体的信号通路和关键的转录调控因子尚未完全阐明。尽管如此,铁死亡在肿瘤发生发展中的重要作用仍不容忽视,近年来越来越多的研究也已证实,铁死亡在肿瘤领域中具有巨大的潜力,有可能成为肿瘤治疗尤其是逆转治疗抵抗的一个新思路。因此,未来值得在基础研究领域中进一步解析铁死亡的调控机制,在临床治疗中继续深入探索铁死亡诱导剂的应用以及治疗癌种的选择等,从而为肿瘤患者治疗带来新的曙光。

