乙型肝炎病毒与线粒体的相互作用及其对肝细胞癌进化的影响
朱小琼 刘文斌 赵沛 林剑生 王瑞华 余红平 赵存喜 曹广文
作者单位:230032 合肥 1安徽医科大学公共卫生学院营养与食品卫生学系;200433 上海 2海军军医大学海医系流行病学教研室;530021 南宁 3广西医科大学附属肿瘤医院;510632 广州 4暨南大学流行病学教研室
原发性肝癌是全球第六大新发恶性肿瘤,也是癌症死亡的第三大原因[1]。原发性肝癌包括肝细胞癌(hepatocellular carcinoma,HCC)和肝内胆管癌以及其他少见类型[1]。在我国87.5%的HCC患者可能是由乙型肝炎病毒(hepatitis B virus,HBV)慢性感染导致[2]。HBV主要通过诱导宿主基因突变、改变信号通路和病毒蛋白与宿主蛋白相互作用等途径引发HCC[3-6]。能量代谢模式的重塑是癌变的重要环节,而线粒体是有氧氧化呼吸的核心细胞器,在代谢模式由有氧氧化呼吸为主转化为有氧糖酵解为主的过程中,线粒体功能如何重塑尚未知。目前大量研究提示,HBV与线粒体的相互作用及HBV引发的能量代谢改变对HCC发生发展的影响不容忽视[7-8]。本文就HBV与线粒体的相互作用及其对HCC进化影响的研究进展作一综述。
1 HBV和线粒体的基本结构
HBV是一种部分双链DNA反转录病毒,包含1个3.2 kb的基因组,被二十面体核衣壳和包膜包裹。进入宿主细胞后,HBV通过pgRNA(pre-genomic RNA)反转录出病毒基因组DNA。HBV基因组编码4个重叠的开放阅读框,分别为preS-S、preC-C、P和X,这4个基因组编码7种不同的蛋白质,这些蛋白包括HBsAg(分为大、中、小3种形式)、HBcAg、HBeAg、HBV聚合酶和HBV X蛋白(HBV X protein,HBx)[9]。
线粒体由外膜、膜间隙、内膜和基质等4个部分组成。线粒体外膜上的电压依赖性阴离子通道(voltagedependent anion channel,VDAC)控制外 膜 的渗透性[10]。线粒体抗病毒信号蛋白(mitochondrial antiviral signaling protein,MAVS)定位在线粒体外膜上,在先天免疫信号调控中发挥重要作用[11]。线粒体内膜折叠成嵴以增大内膜表面积,内附细胞色素氧化酶参与氧化磷酸化反应并控制线粒体的分裂和融合。线粒体基质含有参与三羧酸循环、脂肪酸氧化等生化反应的酶、线粒体 DNA(mitochondrial DNA,mtDNA)、RNA、核糖体等。mtDNA是16.6 kb的双链圆形DNA,编码22个转移RNA、2个核糖体RNA和13个组成呼吸酶复合物的基因[12]。mtDNA还包含1个非编码区域称为D-loop区,可控制mtDNA的复制和转录[13]。线粒体相关蛋白主要由核DNA编码并从细胞质转移到线粒体中发挥功能。
2 HBV引起的能量代谢改变为HCC生长提供适宜的能量环境
肿瘤细胞的能量供应遵循Warburg效应,即在氧含量正常的情况下,肿瘤细胞仍主要通过糖酵解供能[14]。线粒体是能量代谢的主要场所,关键代谢酶的表达调控可决定代谢反应的速度和方向。现有证据显示,HBV可上调己糖激酶(hexokinase,HK)、葡萄糖-6-磷酸脱氢酶(glucose-6-phosphate dehydrogenase,G6PD)和烟酰胺磷酸核糖基转移酶(nicotinamide phosphoribosyl transferase,NAMPT)的表达,还可下调丙酮酸激酶(pyruvate kinase isoform,PK)M2亚型活性,从而影响代谢模式,使细胞的能量供应逐渐向Warburg效应方向转变,为HCC的生长提供适宜的能量环境[15-19]。HK负责将进入细胞的葡萄糖不可逆地转化为葡萄糖-6-磷酸,这也是葡萄糖进入糖酵解途径的第一步。HK有HK1、HK2、HK3、HK4四种亚型。HK4在正常肝脏中高表达,而HK2在HCC中高表达[20]。感染HBV的细胞,HK2表达上调,其葡萄糖摄取能力增强[15]。糖酵解的最后一步由PK介导,而PK有PKL、PKR、PKM1和PKM2四种亚型。PK催化一个磷酸基从磷酸烯醇式丙酮酸转移到腺嘌呤核苷二磷酸,并产生丙酮酸和腺嘌呤核苷三磷酸(adenosine triphosphate,ATP)。亲和纯化实验发现,HBsAg可与PKM2结合从而降低其活性[18]。但HBsAg能否在生理条件下通过与PKM2结合从而改变代谢途径仍未知。PKM2在HCC代谢改变和肿瘤发生中的作用也尚存争议。多项研究显示,HCC和肝硬化患者中PKM2的表达水平上调,PKM2激酶活性也增强,且与不良预后相关[21-22]。但是,动物实验表明,PKM2敲除小鼠存在代谢失衡,包括高血糖、高胰岛素血症和肝脂肪变性,且最终会导致HCC的发生[23]。G6PD是磷酸戊糖途径中的第一个限速酶,可将葡萄糖-6-磷酸转化为6-磷酸葡萄糖内酯。有研究报道,G6PD在HCC组织中表达升高且与总生存率降低有关[24]。YIN等[25]研究显示,G6PD表达升高增强了HCC细胞对奥沙利铂的耐药性,这与分化抑制蛋白1(inhibitor of differentiation 1,Id1)激活磷酸戊糖途径有关。此外,缺氧条件下,G6PD的翻译后修饰(糖基化作用)可诱导G6PD表达,促进肿瘤生长,并将磷酸戊糖途径与己糖胺生物合成途径连接起来[26]。HBx通过与转录因子NF-E2相关因子2(Nf-E2 related factor-2,Nrf2)的抑制剂Keap1结合,导致Nrf2活化,从而增强G6PD的转录,上调G6PD表达[16]。NAMPT是一种参与烟酰胺腺嘌呤二核苷酸(nicotinamide adenine dinucleotide+,NAD+)生物合成的关键限速酶。NAMPT在乳腺癌、肺癌和前列腺癌中表达上调[27-28]。由于肿瘤细胞对NAD+的高需求,抑制NAMPT表达可以显著抑制肿瘤细胞增殖。目前研究显示,特异性NAMPT抑制剂FK866、STF-118804分别在胃癌、HCC以及胰腺癌中表现出抗癌活性[29-31]。在HCC细胞中,FK866通过抑制NAMPT表达显著降低细胞中NAD+和ATP含量,从而抑制HCC细胞侵袭与转移[31]。HBV也可增强NAMPT的表达,而NAMPT的激活又反向促进HBV复制[17]。因此,HBV可能通过增强NAMPT的表达从而促进HCC细胞的侵袭与转移。
转录组学和代谢组学研究显示,HBV感染会引起广泛的代谢图谱改变,显著促进糖酵解、磷酸戊糖和核苷酸生物合成等代谢途径中代谢物的合成[32]。HCC中下调的代谢基因主要为参与脂肪酸和氨基酸代谢的相关基因,上调的代谢基因包括参与糖酵解、磷酸戊糖和核苷酸生物合成等代谢途径相关基因[33]。此外,不同的代谢亚型还与HCC患者的预后有关,其中参与碳水化合物和核苷酸代谢基因表达上调以及参与脂质代谢基因表达下调与HCC患者的预后不良有关[34]。单细胞转录组测序分析显示,HCC组织样本中恶性细胞群显示出线粒体功能障碍,且这些缺陷可导致线粒体应激,乳酸过度产生和较差的生存结局[35]。综上,结合HBV调控的关键代谢酶所在的代谢途径中的转变,可以发现HBV诱导的代谢转变与HCC的优势代谢方式高度一致。肿瘤细胞和病毒生长及复制过程中需要大量的ATP和核苷酸,HBV通过上调糖酵解、磷酸戊糖和核苷酸等代谢途径满足肿瘤快速增殖所需的能量微环境,为HCC的生长提供适宜环境,且会增加HCC恶性增殖和不良预后风险。
3 HBV通过调控线粒体自噬减少HCC细胞凋亡
线粒体自噬是一种选择性降解过程,能清除受损线粒体以维持其稳态。线粒体动力学是线粒体通过不断的分裂和融合,维持线粒体形态、分布和数量的一种动态变化。线粒体自噬与线粒体动力学相互调控,共同维持线粒体质量平衡[36]。介导线粒体自噬的经典信号通路主要有两条,分别为PINK1/Parkin信号通路和线粒体受体依赖信号通路,其中BNIP3、BNIP3L以及FUNDC1作为定位于线粒体外膜上的受体信号,通过与LC3结合启动线粒体自噬[37]。HBx在这两条线粒体自噬信号通路中均发挥重要作用。有研究显示,HBx通过上调动力相关蛋白1(dynaminrelated protein 1,Drp1)诱导线粒体动力学的融合-分裂平衡倾向于分裂转变,促进PINK1/Parkin信号介导的线粒体自噬过程,选择性清除受损线粒体,以维持HBV感染细胞中的线粒体稳态[38]。CHI等[39]报道,甲状腺激素保护肝细胞免受HBx的癌变诱导也是通过激活PINK1/Parkin信号通路实现,但是与上述文献不同的是,甲状腺激素是靶向清除肝细胞中存在HBx蛋白的线粒体,从而保护肝细胞免受HBx在癌变诱导中的关键作用。细胞实验发现,在剥夺了葡萄糖、丙酮酸、氨基酸和谷氨酰胺等营养物质的培养环境中,HBx通过下调LONP1提高PINK1/Parkin信号通路介导的线粒体自噬而减弱HCC细胞凋亡[40]。此外,HBx还可通过缺氧诱导因子-1α诱导BNIP3L介导的线粒体自噬[41]。
总之,以上研究表明,两条介导线粒体自噬的经典通路均受HBx调节,在病毒入侵、营养缺乏、缺氧等危害环境中,机体通过诱导线粒体自噬维持线粒体质量平衡。HBV通过调控线粒体自噬,保持细胞稳态,减少HBV感染细胞和HCC细胞凋亡。HBV对线粒体自噬的调控路径见图1。
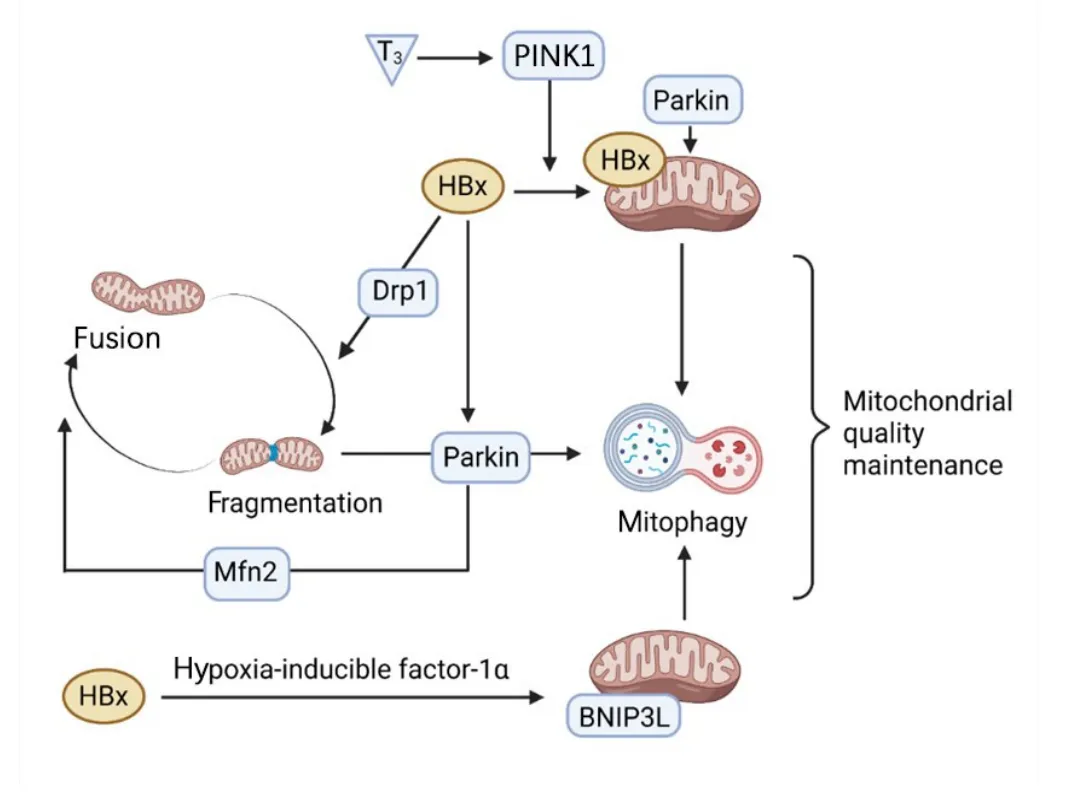
图1 HBx对线粒体自噬的调节途径Fig.1 The regulatory pathway of HBx on mitophagy
4 HBV通过调控线粒体膜电位反向激活HBV DNA复制
线粒体呼吸链位于线粒体内膜上,由5个复合物组成,电子通过这些呼吸酶传递[42]。电子转移释放的能量被用来泵送质子穿过线粒体内膜,从而建立一个电化学梯度并产生ATP,即线粒体膜电位。目前线粒体膜电位的降低已被证明对多种病理生理条件有影响,特别是细胞凋亡[43]。机体应对外来病原微生物和自身损伤时会引发炎症反应,这些炎症相关因子也会对线粒体膜电位产生影响。研究显示,炎症因子在HBV诱导的线粒体膜电位改变中发挥双重作用,一方面,HBx与VDAC结合共定位于线粒体中,破坏氧化磷酸化进程,抑制ATP的产生从而使活性氧簇水平升高,进而激活STAT-3而造成线粒体跨膜电位降低[44-46];另一方面,HBx通过激活NF-κB抑制HBx诱导的线粒体膜电位降低[47]。但是,目前有关HBV对线粒体膜电位影响的机制研究仍有限,炎症因子在此过程中发挥的最终作用或不同情形下的调控机制仍需深入研究。
HBx还可以通过增强Bax蛋白向线粒体的易位,进而诱导线粒体膜电位的丧失而诱导细胞凋亡[48]。但是,HBx定位于细胞色素C氧化酶Ⅲ时不会造成线粒体膜电位的改变[49]。此外,HBx还会通过诱导线粒体膜通透性的转变,使钙离子从线粒体释放到细胞质,激活细胞质钙依赖的酪氨酸激酶,并最终激活HBV DNA的复制[50]。以上研究表明,HBx不仅可以通过线粒体相关蛋白诱导线粒体膜电位的转变,还可以反向激活HBV自身复制(HBx对线粒体膜电位的调节途径见图2)。既往研究已证实,HBV慢性感染是HCC发生的重要危险因素,而抑制线粒体膜上的钙信号传导可阻断HBV DNA复制[50]。因此,线粒体膜或可成为HBV治疗的靶点,这为预防HCC的发生提供了新的方向。

图2 HBx对线粒体膜电位的调节途径Fig.2 The regulatory pathway of HBx on mitochondrial membrane potential
5 HBV抑制线粒体天然免疫为HCC发生发展提供适宜的免疫微环境
MAVS在天然免疫中的调节机制取决于其细胞内的不同定位。MAVS定位于线粒体外膜时,可以诱导干扰素(interferon,IFN)刺激基因稳定表达[51-52]。有研究报道,天然免疫系统模式识别受体中Toll样受体和RIG-I样受体可识别入侵的病原体并将信号传递给MAVS,MAVS通过NF-κB和IRF3等信号传递分子,激活Ⅰ型和Ⅲ型IFN的表达,诱发细胞内抗感染天然免疫反应[53]。HBV也可以调节MAVS的表达而抑制抗病毒免疫反应。WEI等[54]报道,HBx通过泛素化降解MAVS,使HBV-HCC组织中的MAVS蛋白表达下调。HBV的pgRNA可被RIG-I感知并激活MAVS介导的多种IFN合成,但未显著诱导IFN-β[55]。pgRNA激活线粒体天然免疫的路径见图3。深入研究发现,HBV诱导的Parkin能招募线性泛素组装复合体(linear ubiquitin assembly complex,LUBAC)进入线粒体,通过LUBAC在MAVS上聚集无锚定的线性多泛素链,破坏MAVS信号体,减弱IRF3激活,从而阻断IFN-β的合成[56]。WANG 等[57]报道,HBV聚合酶通过抑制TBK1和DDX3之间的相互作用来抑制RIG-I信号传导并抑制IFN-β合成。值得注意的是,在以上研究中,Ⅰ型IFN的合成被显著抑制,但Ⅲ型IFN表达是否受抑制仍未知。综上可知,HBx不仅可以降低MAVS蛋白的表达,还能进一步抑制天然免疫信号通路传导。人体天然免疫在病原体和异常癌细胞识别和清除中发挥着重要作用,抑制免疫作用也是HCC发生中不可或缺的一环,因此HBV通过抑制线粒体天然免疫能为HCC的发生发展提供适宜的免疫微环境。
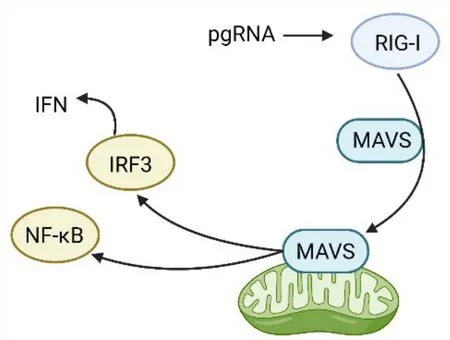
图3 pgRNA在线粒体天然免疫中的激活路径Fig.3 Activation pathway of pgRNA in mitochondrial innate immunity
6 线粒体基因组损伤对HCC进化的影响
HCC及其配对正常组织的差异表达基因功能富集分析显示,线粒体功能障碍与HCC发育显著相关[58]。采用线粒体相关基因建立的预后预测模型不仅表现出良好的预后预测能力,而且还可用于预测HCC患者是否出现血管侵袭[59]。mtDNA突变在炎症组织和癌症组织中普遍存在,且主要集中在D-loop区。HBV-HCC组织中D-loop区突变的异质性水平相比配对癌旁组织显著升高,且D-loop区突变多的患者mtDNA拷贝数显著降低,同时复发风险增加[60]。多项研究也显示,慢性HBV感染者中外周血白细胞和血清mtDNA拷贝数低者罹患HCC的风险显著增加[61-63]。这些研究显示,HBV促进D-loop区突变可能会减少mtDNA的复制并损害线粒体的正常功能,从而诱导HCC的发生,且增加HCC复发风险。此外,HBV诱导的线粒体自噬还会使大量mtDNA从线粒体基质释放到细胞质中,刺激巨噬细胞诱导肿瘤坏死因子和白介素6等细胞因子,激活下游信号通路如JAK/STAT和NF-κB等,从而促进肝细胞过度增殖,最终导致HCC发生[64]。线粒体功能障碍还能通过诱导细胞核骨架聚集促进肝癌转移[65]。此外,线粒体代谢功能障碍可能还与HCC患者耐药有关,由代谢引起的抗肿瘤药物耐药性通常由几个糖酵解通路的关键蛋白介导,如HK2、葡萄糖转运蛋白1和PKM2[66]。同时还有研究指出,线粒体氧化还原代谢可重塑HCC对索拉非尼的药物反应,线粒体生物发生减少是耐药形成的重要环节之一[67]。因此认为,线粒体功能障碍可能在HCC的发生、复发、转移和耐药等方面均发挥重要的调控作用。
7 小结
目前研究显示,HBV与线粒体相互作用并影响HCC进化,其中HBV可能通过对关键代谢酶和代谢基因的表达调控,使细胞的能量代谢向Warburg效应模式转变;为了减少细胞凋亡,HBV通过调节线粒体动力学和线粒体自噬,维持线粒体质量平衡;HBV还能通过降低线粒体抗病毒信号蛋白的表达从而抑制天然免疫,为HCC发生发展提供适宜的免疫微环境;HBV还会诱导广泛的线粒体基因组损伤从而促进HCC发展。然而关于HBV与线粒体相互作用及其对HCC进化的影响,目前的研究结果也尚存在矛盾之处,未来值得进一步深入研究阐明三者的关系。此外,鉴于代谢组学也广泛应用于抗肿瘤研究中,未来通过分析不同HCC进展阶段的差异代谢物,有望开发HCC精确分型的代谢标志物,同时由于HCC细胞中线粒体和代谢情况与正常细胞存在更显著差异,因此靶向线粒体和代谢的药物可能具有更好的特异性,未来可能成为HCC治疗的新方向。

