晚期NSCLC患者外周血炎性标记物与EGFR-TKIs靶向治疗相关预后的关联及研究进展*
陈娟,梁龙,姚文秀
610500 成都,成都医学院 临床医学院( 陈娟);610041 成都,四川省肿瘤医院·研究所,四川省癌症防治中心,电子科技大学 放疗中心(梁龙),肿瘤内科(姚文秀)
WHO最新公布的数据显示,肺癌的发病率位于全球第二,仅次于乳腺癌,而我国肺癌的发病率为59.89/10万,死亡率为47.51/10万,是发病率和死亡率最高的恶性肿瘤[1-2]。非小细胞肺癌(non-small cell lung cancer,NSCLC)是肺癌最常见的病理类型,占比约为85%[3]。表皮生长因子受体(epidermal growth factor receptor,EGFR)突 变 是NSCLC最 常见的药物治疗靶点(约占1/3)[4]。与传统的化疗相比,EGFR酪氨酸激酶抑制剂(epidermal growth factor receptor-tyrosine kinase inhibitors,EGFR-TKIs)靶向治疗已经显著延长了NSCLC患者的无进展生存期(progression free survival,PFS)和总生存期(overall survival,OS),目前已成为EGFR突变晚期NSCLC患者的标准一线治疗。已有研究证明,炎症反应在肿瘤的发生、发展、转移等阶段有重要作用[5]。其中外周血检测的一些炎症相关指标,包括外周血中性粒细胞/淋巴细胞比值(neutrophil-to-lymphocyte ratio,NLR) 、血小板/淋巴细胞比值(platelet-to-lymphocyte ratio,PLR) 、淋巴细胞/单核细胞比率(lymphocyte-to-monocyte ratio,LMR)、系统免疫炎症指数 (systemic immune-inflammation index,SII)等,与多种恶性肿瘤的预后相关[6-9]。针对肺癌患者接受化疗、放疗和免疫治疗后外周血炎症指标与预后的相关性已有报道,但关于EGFR-TKIs靶向治疗的相关研究少,且结论存在差异。本文将分别阐述外周血炎症指标与EGFR-TKIs靶向治疗晚期NSCLC患者预后的关系。
1 NLR与 晚 期NSCLC EGFR-TKIs靶 向治疗预后的关系
NLR是外周血中性粒细胞与淋巴细胞数的比值,为反应机体免疫状态的指标之一。循环血液中的中性粒细胞可被趋化因子诱导进入肿瘤组织内,而那些浸润在肿瘤中的中性粒细胞被称为肿瘤相关中性粒细胞(tumor-associated neutrophil,TAN)[10]。在肿瘤微环境(tumor microenvironment,TME)的调控下,TANs可被诱导分化为N1(抗肿瘤型)和N2(促肿瘤型)两种亚型。N1型能促进抗肿瘤细胞因子分泌,并通过趋化作用诱导CD8+T淋巴细胞到达肿瘤病灶,增强细胞毒性,从而对肿瘤的生长起到一定的抑制作用[11]。N2型TAN可通过释放一些信号分子,如弹性蛋白酶、趋化因子、成纤维细胞生长因子-2和血管内皮生长因子(vascular endothelial growth factor,VEGF)等,促进肿瘤的增殖、浸润和血管生成[12]。淋巴细胞是参与人体免疫反应的细胞之一,主要参与细胞免疫,可通过诱导细胞凋亡和抑制肿瘤细胞的增殖和迁移,在抗肿瘤免疫中起重要作用。NLR升高可能是由机体的中性粒细胞增加或淋巴结细胞减少导致,提示机体可能存在明显的炎症反应或免疫功能被抑制。
目前关于NLR在肺癌靶向治疗预后作用的研究多以一代EGFR-TKIs为主。一些研究分析了NLR与EGFR-TKIs一线治疗的晚期NSCLC患者预后作用的相关性,结果显示,基线NLR较高的患者往往PFS或OS更短。Ono等[13]回顾性分析了205例使用一代EGFR-TKIs (吉非替尼157例、厄洛替尼48例)治疗的晚期或术后复发的NSCLC患者,采用ROC曲线确定的3.55,作为NLR高、低两组的截值。结果显示,基线低NLR组中位PFS(15.7个月,95%CI:12.7个 月~18.7个 月)长于 高NLR组(6.7个 月,95%CI: 4.6个月~8.8个月),差异有统计学意义(P<0.001);低NLR组中位OS(37.6个月,95%CI:30.3个月~44.9个月)也明显地优于高NLR组(19.2个月,95%CI:10.6~27.8月),差异有统计学意义(P<0.001)。多因素Cox分析发现,NLR是NSCLC患者EGFR-TKIs靶向治疗中PFS和OS预后的独立 危险 因素(PFS:HR=1.78,95%CI: 1.29~2.47,P=0.01;OS:HR=1.59,95%CI: 1.09~2.34,P=0.017)。Chang等[14]分析了259例使用一、二代EGFR-TKIs一线治疗(吉非替尼115例、厄洛替尼65例、阿法替尼79例)的晚期NSCLC患者,发现基线NLR≥3组患者的PFS较NLR<3组更短,多因素分析显示高NLR是PFS的独立危险因素(HR=1.74,95%CI:1.19~2.55,P=0.004)。而Deng等[15]的研究纳入了203例使用一代EGFR-TKIs(吉非替尼、厄洛替尼、埃克替尼)的晚期肺腺癌患者,同时分析了基线NLR、PLR、SII与预后的相关性。选取4.4作为NLR的截断值。临床资料分析发现,高NLR组患者可能具有更差的ECOG 评分(P=0 .002)。多变量分析发现,基线较高的NLR组患者的PFS较差,且NLR为PFS的独立预后因素(HR=1.736,95%CI: 1.02~2.95,P=0.01),未 发 现NLR与OS(HR=1.698,95%CI: 0.695~3.851,P=0.215)独 立 相关,而SII与OS(HR=2.802,95%CI: 1.659~4.733,P<0.001)独立相关。SII较强的预测作用可能影响了NLR、PLR对OS的预测作用。目前仅纳入二代或三代EGFR-TKIs的研究尚少,Ishihara等[16]报道了100例EGFR-TKIs(吉非替尼63例、厄洛替尼13例、阿法替尼11例、奥希替尼13例)一线靶向治疗的晚期NSCLC患者,发现基线低NLR组(NLR<5)较基线高NLR组(NLR≥5)有更长的治疗失败时间(time to treatment failure,TTF)和OS,多因素分析发现NLR为TTF(HR=1.89,95%CI: 1.15~3.09,P=0.01) 及OS(HR=3.81,95%CI: 2.06~7.05,P<0.01)的独立预后因素。使用一、二代TKIs靶向治疗的NSCLC患者耐药后,最常见的耐药突变是EGFR T790M突变。一项奥希替尼后线治疗61例获得性T790M阳性的肺腺癌患者的研究显示,基线NLR ≤3.5的 患 者PFS更 长(HR=0.23,95%CI: 0.12~0.45,P<0.001)[17]。Tang等[18]的荟萃分析了NLR与EGFR-TKIs靶向治疗预后相关性,NLR截断值范围在2.11到5.2,低NLR组患者PFS和OS均优于高NLR组,且有统计学意义。综合上述研究,虽然各研究的随访时间及选取的NLR截断值存在差异,但基线高NLR多提示EGFR-TKIs靶向治疗NSCLC患者不良预后。
2 LMR与 晚 期NSCLC EGFR-TKIs靶 向治疗预后的关系
LMR是指外周血淋巴细胞数与单核细胞数的比值,能够反映机体的炎症状态。TME中的巨噬细胞(tumor-associated macrophage,TAM)分为M1、M2两个亚型,M1型巨噬细胞具有抗肿瘤活性,M2型巨噬细胞能促进肿瘤的形成和进展[19]。M2型巨噬细胞在EGFR-TKI耐药性肺癌中的比例高于EGFR-TKI敏感肺癌[20]。淋巴细胞是机体介导肿瘤免疫应答的主要细胞,具有较强的抗肿瘤活性[21]。TME中的淋巴细胞之间的相互作用能促进肿瘤细胞的凋亡。
既往荟萃分析显示,在NSCLC患者中低LMR预示较差的PFS和OS[22]。但是LMR能否作为EGFR-TKIs靶向治疗预后的独立危险因素仍存在争议。Zhang等[23]对127名EGFR-TKIs治 疗 的IIIB~IV期NSCLC患者进行分析,发现单因素分析中基线高LMR(>3.37)与 更 长 的PFS(P=0.07)和OS(P=0.034)相关,但多因素分析却未能证明LMR是PFS和OS独立预后因素。侯鑫等[24]的研究也未能证明LMR作为PFS、OS的独立预后因素,这一结论可能的原因是在多变量分析中,NLR的预测能力较强影响了LMR的预测能力。Minami等[25]报道了高LMR组的客观缓解率(objective response rate,ORR)显 著 高 于 低LMR组(76.6%vs54.3%,P=0.01),且PFS、OS、疾 病 控 制 率(disease control rate,DCR)也均优于低LMR组,然而多变量分析未发现LMR是PFS、OS的独立预后因素。以上的研究未能证明LMR是预测EGFR-TKIs治疗预后的有效指标。
但也有研究的结果存在差异。日本的一项研究[26]显示,基线低LMR是晚期EGFR突变型肺腺癌TKIs治疗PFS不良的独立预测因子,同时低水平LMR与淋巴结和骨转移、低蛋白血症以及C反应蛋白(C-reaction protein,CRP)增加有关。Chen等[27]回顾性分析了253例EGFR-TKIs一线治疗的肺癌患者,研究了基线LMR、MBR(治疗1月后的LMR值与基线值之比)及二者的组合对EGFR-TKIs的预测作用。根据ROC曲线确定基线LMR的截断值为3.29,约登指数确定MBR的截断值为0.63,各分为高低两组。高LMR和高MBR组,高LMR或高MBR,以及低LMR和低MBR三组的PFS分别为 15.4个月、7.1个月和2.0个月(P<0.001),OS分别为32.6个月、13.7个月和5.1个月(P<0.001)。多因素分析显示:高LMR、高MBR、EGFR-TKIs靶向治疗和远处转移的器官数少是较长PFS的独立预后因素;高LMR、距离较近的器官转移和良好的ECOG 评分是较长OS的独立预测因素。而LMR和MBR的组合可能更有助于预后的预测。Chan等[28]对268例EGFR突变的晚期肺癌患者治疗前(221例接受EGFR-TKIs治疗)的多个炎症指标进行分析,多因素 Cox 分析显示,基线较高LMR 与较长的OS(HR=0.62,P=0.0046)独立相关,并未发现与较长的PFS(HR=0.81,P=0.14)独立相关。而此研究在纳入了5项研究进行荟萃分析却发现,基线高LMR与较长的PFS显著相关(HR=0.64,n=795,P<0.001)。目前LMR在EGFR-TKIs靶向治疗NSCLC患者中的研究较少,多数是联合其他炎症指标分析,LMR对预后的预测有一定争议,还需进一步的研究验证。
3 PLR与 晚 期NSCLC EGFR-TKIs靶 向治疗预后的关系
PLR是血小板计数与淋巴细胞计数之比。恶性肿瘤常常伴随血小板升高,血小板可以释放一些细胞因子,如血小板衍生生长因子VEGF、凝血酶敏感蛋白-1等,加快肿瘤细胞黏附增长,在促进肿瘤的血行播散,刺激肿瘤细胞浸润及增强肿瘤血管新生能力过程中发挥重要的作用[29]。
Liu等[30]回顾性分析了96例EGFR-TKIs(吉非替尼46例、埃克替尼36例、厄洛替尼12例、阿法替尼2例)靶向治疗晚期NSCLC患者的临床资料,发现基线PLR 高组(PLR≥190)与PLR低组相比,虽 然ORR(62.2%vs52.9%,P=0.36)和DCR(91.1%vs80.4%,P=0.14)的差异无统计学意义,但PLR高组患者的中位PFS明显短于PLR低组(6.6个月vs12.4个月,P=0.009)。多因素分析显示,PLR是影响EGFR-TKIs靶向治疗NSCLC患者的独立危险因素(HR=1.781,95%CI:1.123~2.825,P=0.014)。江冠铭等[31]的研究纳入90例使用一代EGFR-TKIs(吉非替尼、厄洛替尼、埃克替尼)一线治疗的晚期 NSCLC患者,以PLR中位数作为截断值分组,发现低PLR组(PLR ≤ 139)的中位OS及PFS均长于高PLR组(PLR>139),差异有统计学意义 (P=0.001)。虽然PLR在EGFR-TKIs靶向治疗NSCLC患者研究纳入排除标准的差异,且研究的样本的样本量不同,获取截断值的方法也不完全相同,但已有的研究显示PLR对预后有指导意义,但有待进一步的研究证实及获取更为精确的PLR截断值,以便更好地指导临床。
4 SII与 晚 期NSCLC EGFR-TKIs靶 向 治疗预后的关系
SII是结合了3种类型外周血细胞计数的指标,其计算为血小板计数×中性粒细胞计数/淋巴细胞计数。相较于NLR或PLR,SII可能更好地反映机体的免疫和炎症状态。既往的研究表明,SII在胰腺癌、肝癌、食管癌、膀胱癌等的预后方面具有重要作用[32-35]。SII用于晚期NSCLC患者EGFR-TKIs靶向治疗的预后预测也有少数报道。
Deng等[15]同时研究了NLR、PLR和SII在一代 TKI一线治疗EGFR突变患者预测预后的作用,多 变 量 分析 显 示,NLR(HR=1.736,95%CI: 1.020~2.954,P=0.03)和PLR(HR=1.823,95%CI: 1.059~3.137,P=0 .04)及SII(HR=2.577,95%CI: 1.677~3.958,P<0.001)均与PFS独立相关,但 只 有SII(HR=2.802,95%CI: 1.659~4.733,P<0.001)与OS独立相关,该研究显示SII在EGFR-TKIs治疗的NSCLC患者中预测预后的作用优于NLR及PLR。Ju等[36]分析了102名 一 代EGFR-TKIs一线治疗EGFR突变的患者,通过计算得到SII的截断值843.03,多因素分析发现SII与PFS(HR=1.55,95%CI: 1.014~2.385,P=0.043)和OS(HR=1.644,95%CI: 1.002~2.696,P=0.049)均独立相关。Yucle等[37]的研究回顾性分析了136例接受厄洛替尼治疗的ⅢC ~Ⅳ期的NSCLC患者基线SII和dNLR在预后中的作用。根据既往的荟萃分析结果SII的截断值取640,与SII高组相比,SII低组患者的PFS和OS显著延长,其中SII低组和dNLR低组有更长的中位PFS,SII与dNLR联合使用可能更好地预测预后。许静等[38]的研究以687作为SII的截断值,低SII组中位PFS及中位OS均较高SII 组延长。通过已有的研究显示基线较高的SII与EGFR-TKIs靶向治疗的不良预后相关,但仍需进一步前瞻性研究证实。
5 CRP、IL-6与晚期NSCLC EGFR-TKIs靶向治疗预后的关系
CRP是一种急性期反应蛋白,为临床常用的炎症指标,具有高度敏感和低度特异性的特点。IL-6是感染、癌症、炎症中的关键细胞因子,可由TME中的多种类型细胞产生,导致肿瘤细胞和肿瘤浸润免疫细胞中的JAK/STAT3信号激活,促进肿瘤细胞的增殖、侵袭和转移,同时抑制抗肿瘤的免疫反应[39-40]。肝脏中的IL-6可以诱导CRP的合成,相较于CRP而言,IL-6的预测作用可能会更好。
Koyama等[41]分析了81例EGFR-TKIs(吉非替尼、厄洛替尼、阿法替尼)治疗的晚期或复发的NSCLC患者,发现与较低血清CRP组(<10 mg/L)的患者相比,高CRP水平组(≥10 mg/L)患者的TTF (中位5.8个月vs20.7个月;P<0.001)和OS (中位14.2个月vs47.3个月;P<0.001)更短。在多变量分析中,CRP水平与TTF呈负相关,基线血清CRP水平高预示患者的预后不良。Hotta等[42]研究了89例EGFR-TKIs(吉非替尼44例,厄洛替尼22例,阿法替尼15例,奥希替尼8例)一线靶向治疗的NSCLC患者发现,治疗前CPR较高(≥8.1 mg/L)比CRP较低(<8.1 mg/L) 的患者有更短的PFS(中位7.3个月vs12.6个月,P=0.011)和OS(中 位10.1个 月vs37.4个 月,P<0.0001)。多变量分析,高CRP 水平与更短的OS相关,且为EGFR 突变患者OS(HR=2.479,95%CI: 1.331~4.619,P=0.004)的独立预后因素。Jia等[43]的研究回顾性分析了59例EGFR-TKIs治疗的晚期患者的临床资料,结果显示:以IL-6中位值分为高低两组,血清 IL-6 低组较高组患者有更好的ORR(74.2%vs42.9%,P=0.014)和PFS(19.57个 月vs13.73个月,P=0.003)。Li等[44]的研究显示,在接受吉非替尼和奥希替尼治疗的患者中,基线IL-6高水平组(≥7 mg/L)有较短的PFS。在获得性耐药后检测IL-6水平,与吉非替尼组患者相比,奥希替尼组IL-6升高的更多(82.1%vs62.7%,P=0.024)。高水平的CRP、IL-6均预示着EGFR-TKIs治疗的患者预后不良,但研究尚少,纳入的样本量小,相关机制及临床研究有待进一步探索。
6 其他相关指标与非晚期 NSCLC EGFR- TKIs靶向治疗预后的关系
在外周血中还有一些指标如纤维蛋白原-白蛋白 比 值(fibrinogen-albumin ratio index,FARI)、全 身炎症反应指数(systemic inflammation response index,SIRI)等也可能作为EGFR-TKIs靶向治疗NSCLC患者的预后的标志物,但研究尚少。晚期恶性肿瘤患者常常发生凝血及纤维蛋白溶解,纤维蛋白原异常升高。Zhao等[45]研究了FARI的预后作用,在多变量Cox分析中显示FARI是PFS的独立预后因素(HR=1.496,95%CI:1.031~2.172,P=0.034),高FARI与较差的PFS相关。SIRI定义为中性粒细胞计数×单核细胞计数/淋巴细胞计数的综合指标,可以更好地反映宿主免疫和炎症平衡。Jiang等[46]人对245例靶向治疗的患者进行回顾性分析,结果显示:SIRI是PFS(HR=2.384,95%CI: 1.275~4.459,P<0.007)和OS(HR=1.721,95%CI: 1.024~3.898,P=0.042)的独立预后因素,高SIRI预示着不良的PFS及OS。除上述指标外,有研究显示一些复合指标在EGFR-TKIs靶向治疗的预后评估中也有一定预测作用,如肺免疫预后指数[47]、格拉斯哥预后评分[48]、预后营养指数[49]等,但是研究尚少,有待进一步研究验证。
外周血中的中性粒细胞、淋巴细胞、单核细胞等是TME的组成部分,在肿瘤发生、发展和转移过程中起着重要的作用。EGFR信号激活可介导肿瘤细胞招募肿瘤相关巨噬细胞和调节性T细胞(regulatory T cells,Tregs)以及产生抑制性细胞因子和代谢物而形成免疫抑制性TME。现有的临床结果提示外周血炎性指标能够预测EGFR-TKIs靶向治疗的预后,其作用的机制可能有以下情况:(1)EGFR突变的TME中的肿瘤浸润淋巴细胞、Tregs、MDSC、TAM能抑制免疫功能,促进免疫逃逸[50]。有研究显示EGFR突变型患者的肿瘤浸润性CD8+T淋巴细胞比例显著低于野生型,同时CD8+T淋巴细胞凋亡的比例更高[51]。EGFR通路激活可诱导CCL2、VEGF、基质金属蛋白酶-9和TGF-β等细胞因子的表达,促进Tregs细胞在TME中的浸润及MDSC的激 活[52-53];(2)EGFR突变的肿瘤细胞分泌抑制性细胞因子增加:IL-6、TGF-β、IL-10、VEGF、ARG1和腺苷等,可直接抑制NK细胞杀伤、DCs成熟和细胞毒性T淋巴细胞功能和增殖。其中IL-6可以通过STAT-3细胞内途径,促进肿瘤生长及EGFR-TKIs耐药[54];(3)EGFR的突变通过P13K-AKT、RAS-RAF、JAK-STAT3途径上调PD-L1,诱导T细胞凋亡,参与免疫逃逸[54]。EGFR-TKI 在体外和体内均可抑制EGFR 突变 NSCLC 中的 PD-L1 表达[55]。
7 总结和展望
目前外周血常见指标能反映机体的炎症状态,评价EGFR-TKIs靶向治疗预后方面的研究取得了一些进展,仍存在一定的局限性(表1)。其中NLR、SII在靶向治疗中的应用价值较为肯定,其基线时的高水平往往与靶向治疗的预后呈负相关。而PLR、LMR、CRP、IL-6等指标在靶向治疗的研究因研究尚少、样本量小,结果尚存在一定的差异。外周血液学检测是NSCLC患者靶向治疗期间的常规检查之一,具有可靠的检测方法、经济、重复性好等特点,将它们与其他指标联合应用可为靶向治疗提供更多的参考价值。然而多数研究是回顾性分析基线时的炎症指标,少有研究探索治疗期间及耐药前后的炎症指标对EGFR-TKIs靶向治疗预后的预测作用。已有的报道主要以一代、二代EGFR-TKIs为主,而与三代酪氨酸激酶抑制剂的相关性尚不清楚,值得开展进一步研究。另外各研究所选取截断值方法不统一,临床选择存在困难。综上关于外周血炎性指标预测EGFR-TKIs靶向治疗晚期肺癌的预后还需要大规模的临床研究及机制探索进行验证。
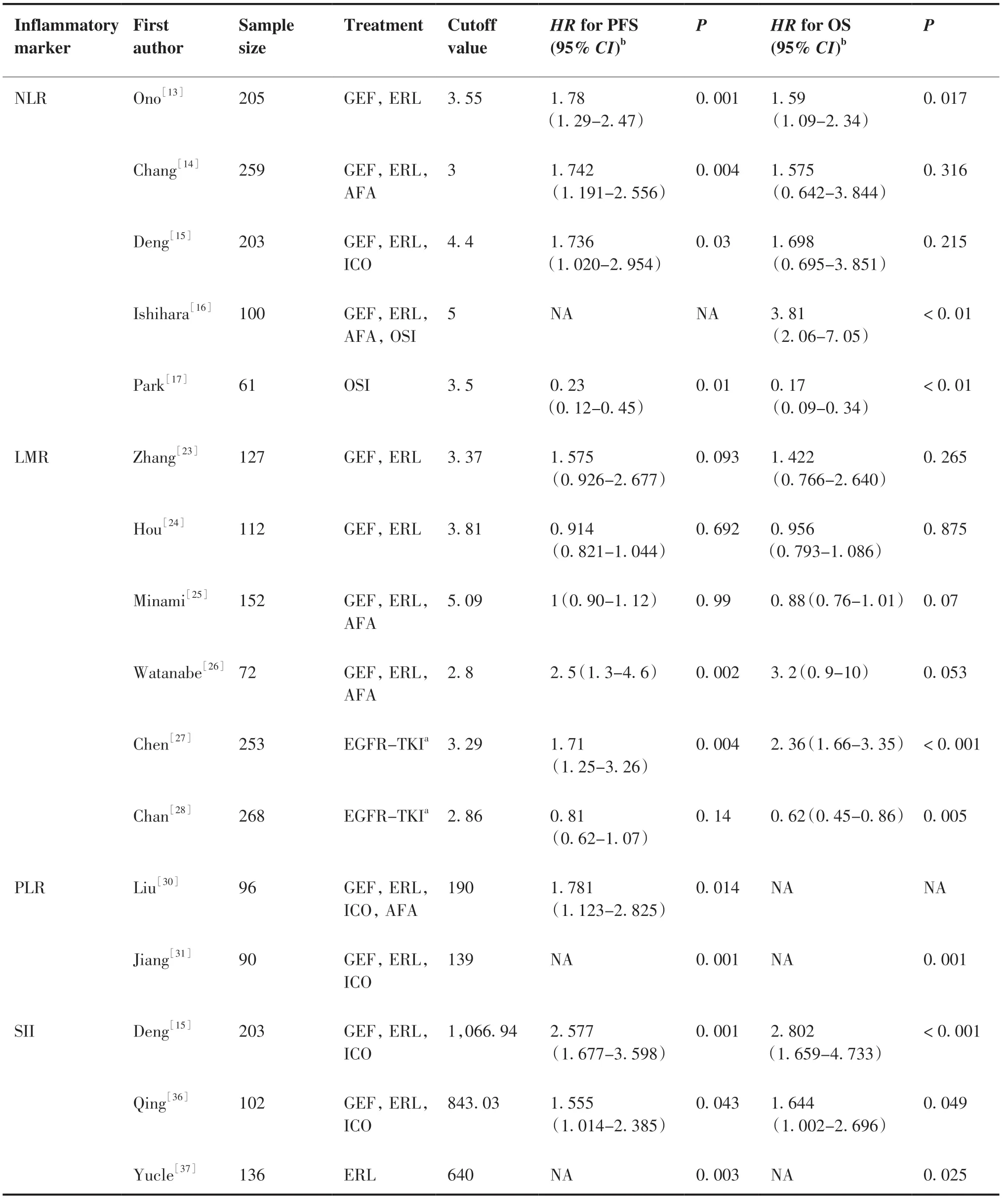
表1 既往炎症指标与EGFR突变的NSCLC预后的相关性研究Table1.Previous Reports Investigating the Correlation between Inflammatory Markers and Prognosis of NSCLC Patients with EGFR Mutation Treated by EGFR-TKIs
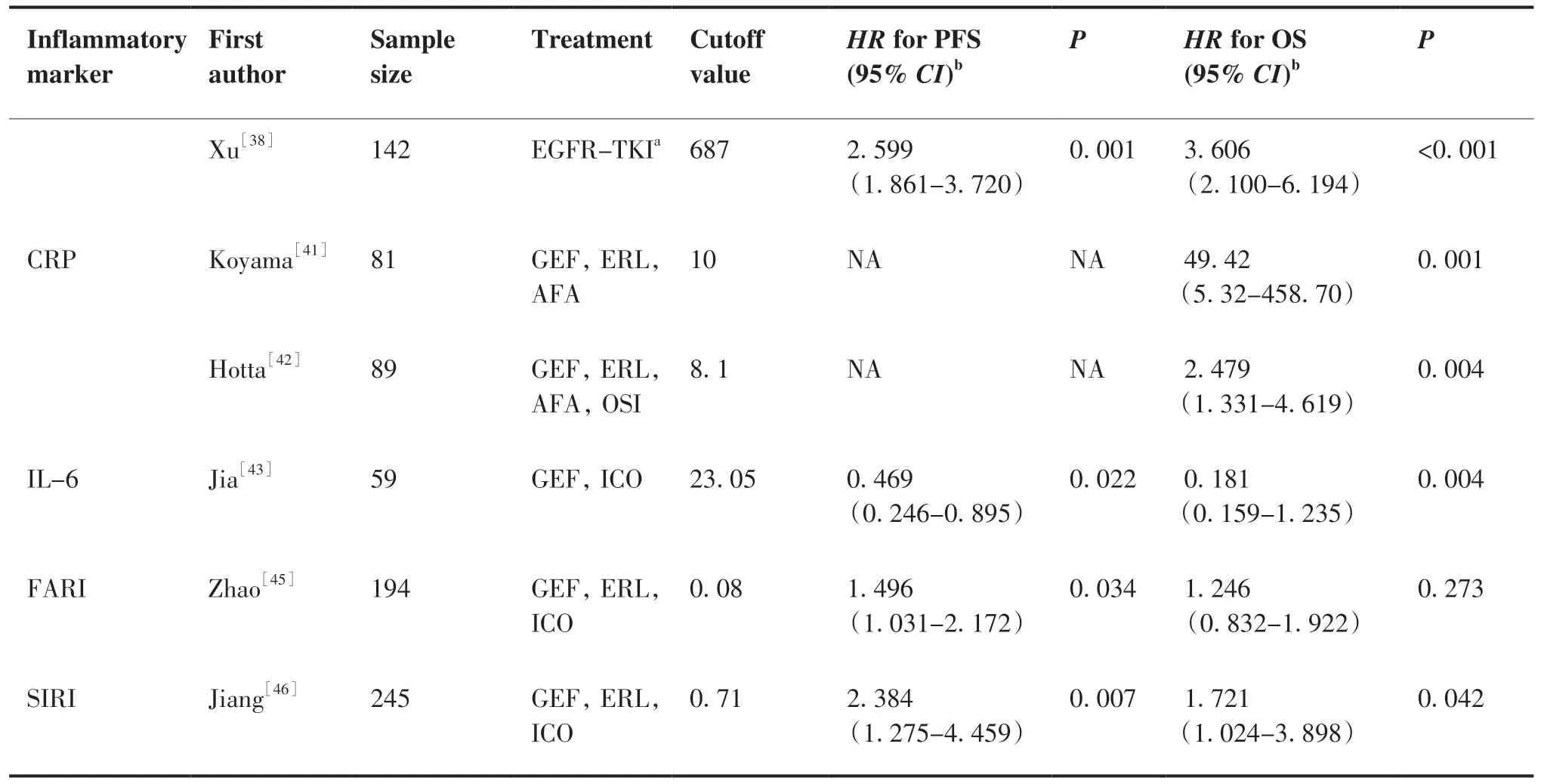
(Continued from previous page)
作者声明:本文全部作者对于研究和撰写的论文出现的不端行为承担相应责任;并承诺论文中涉及的原始图片、数据资料等已按照有关规定保存,可接受核查。
学术不端:本文在初审、返修及出版前均通过中国知网(CNKI)科技期刊学术不端文献检测系统的学术不端检测。
同行评议:经同行专家双盲外审,达到刊发要求。
利益冲突:所有作者均声明不存在利益冲突。
文章版权:本文出版前已与全体作者签署了论文授权书等协议。

