多普勒超声腔内心电一体化引导肿瘤患者床旁中心静脉置管的安全性与准确性的随机对照研究*
高丽,易勇,邓艳梅,郭玲,罗蕾
610500 成都,成都医学院 护理学院(高丽);610041 成都,四川省肿瘤医院·研究所,四川省癌症防治中心,电子科技大学 导管室(高丽、邓艳梅),护理部(易勇、郭玲、罗蕾)
中心静脉导管(central venous catheter,CVC)在肿瘤患者的化学治疗与抢救中应用广泛,若能在床边完成置管操作并及时精准定位导管尖端位置,将为此类患者的救治赢来宝贵的时间[1]。CVC尖端定位传统方法为胸部X线(chest X-ray,CXR),置管后需等待拍片并读取X片,确认导管尖端位置正常后方可使用导管进行输液治疗[2]。近年来,超声引导穿刺置管与心腔内电图(intracavitary electrocardiography,IC-ECG)导管尖端定位技术能够提高穿刺成功率和导管尖端到位率,已广泛应用于临床[3-4],使用这两类技术需要超声仪器与心电监护仪器。多普勒超声腔内心电一体化引导 (electrocardiography and Doppler ultrasound guidance,EDUG) 是将多普勒超声和IC-ECG定位技术有机结合为一体的专用数字诊疗设备[5],通过多普勒超声评估筛选最佳穿刺血管,应用IC-ECG技术与多普勒超声联合精准判断导管尖端位置,穿刺后即可通过导管进行输液,从理论层面考虑应是肿瘤患者床旁CVC置管的最佳选择。但目前大部分研究集中IC-ECG在经外周穿刺中心静脉置管(peripherally inserted central venous catheter,PICC)中的应用,床旁CVC置管应用ICECG技术的报道较少[6-9],而使用EDUG床旁CVC置管更是鲜有报道[10-12]。本研究主要探讨EDUG肿瘤患者床旁CVC置管的安全性与准确性,现报道如下。
1 对象与方法
1.1 样本量估算
根据江群等[13]研究,血管超声仪结合心腔内心电图技术引导中心静脉置管导管尖端到位率为99%,为患者到中心静脉置管室接受穿刺置管;本研究预计由术者到患者床旁穿刺置管,其导管尖端到位率为92%,设α=0.05(双侧),β=0.02。使用Power and Sample Size在线计算器,估算单组样本量为134例,考虑失访,提高20%样本量,最终样本量总数为320例。
1.2 研究对象
选取 2021年3月至12月在我院接受床旁CVC置管的肿瘤患者为研究对象。纳入标准:①年龄≥18岁;②行颈内静脉CVC置管的患者(颈内静脉为CVC置管常选静脉,置管成功率相对高[14]);③患者为正常窦性心率,心电图上可获得清晰的 P 波图形。排除标准:①患者携带心脏起搏器;②患者行动态心电图检查;③房颤患者。该研究已获得医院医学伦理委员会批准(编号:SCCHEC-02-2021-065),患者或家属均签署知情同意书。
1.3 分组方法
采用随机数字生成器生成随机数,将写有随机数字的纸条用不透光的信封保存,纳入研究对象时,抽取信封开启数字,若为奇数,则进入对照组(血管超声仪引导置管法),若为偶数则进入试验组(EDUG置管法)。两组患者置管固定后均用CXR确定导管尖端位置。
1.4 研究方法
根据患者病情及治疗需要,医生开具CVC床旁置管医嘱,患者及家属签署知情同意书,置管人员接到置管申请后即刻前往床旁置管。两组置管患者随访自置管后至治疗结束,观察CVC导管相关并发症发生情况直至患者治疗结束拔管截止。
1.4.1 对照组 ①物品准备B.Braun V320单腔16 G CVC、置管手术包、2%利多卡因、生理盐水100 mL、1 mL与10 mL注射器各一支、7 cm×9 cm无菌透明敷贴、超声探头无菌套、CHISON全数字超声诊断系统(L25线阵超声探头);②置管方法:患者平卧,使用超声探头评估并选择穿刺血管;穿刺处摩擦消毒面积大于20 cm×20 cm;打开CVC穿刺包、戴无菌手套、穿无菌手术衣、铺无菌洞巾;使用生理盐水预充导管,无菌套包裹超声探头,抽吸2%利多卡因1 mL;预穿刺处进行局部麻醉,待麻药起效后,针尖与颈部成30°~45°角缓慢进针,通过超声可视化观察针尖进入靶静脉,回抽暗红色血液后送入导丝,退出穿刺针保留导丝,通过导丝送入导管,采用改良的Peres’定位法预先估计送管长度,即经右侧颈内静脉置管时导管置入的长度为患者身高(cm)的1/10减去1 cm[15];送管结束后使用超声探头查看同侧及对侧胸壁段腋静脉以及时发现导管有无异位,并及时纠正,若发现导管进入锁骨下静脉或腋静脉,退出导管至导管长度体内剩余5 cm时,再次送管后使用超声探头查看,若同侧及对侧胸壁段腋静脉无导管影,则置管结束,使用透明敷贴固定;床旁CXR定位导管尖端位置确认准确在预测量位置后行输液治疗。
1.4.2 试验组 ①物品准备除超声设备更换为COMEN U8B心电多普勒超声监测仪(L25线阵超声探头,4导心电导联线),其余物品均同对照组;②置管方法:患者平卧,连接心电图电极片,使用EDUG超声模块评估并选择穿刺血管,使用EDUG心电模块评估并存储患者体表心电图波形;消毒、铺洞巾、穿刺血管、送入导管等步骤同对照组;送入导管接近预估长度时,将EDUG的导联线鳄鱼夹一端夹于导丝,另一端与H导联连接;将EDUG超声模块切换为心电模块,屏幕上同时显示体表心电图与腔内心电图,缓慢匀速送入导管,观察记录心电图P波波形,若P波出现特征性改变时,提示导管尖端到达标准位置[16];若P波无变化,使用超声线阵探头查看同侧及对侧胸壁段锁骨下静脉及腋静脉以及时发现导管有无异位。若发现导管进入锁骨下静脉或腋静脉,退出导管至导管长度体内剩余5 cm时,再次送管并应用IC-ECG定位,若P波无变化,探头查看锁骨下或腋静脉无导管影则置管结束,使用透明敷贴固定;试验组置管完成后即可行静脉输液治疗[16],待床旁CXR再次确认导管尖端位置。
1.5 评价指标
1.5.1 EDUG中心静脉置管安全性 ①一次性穿刺成功率:超声引导穿刺血管时一针穿刺成功的比例;②一次性送管成功率:送入导管时一次性送到准确位置的比例;③导管尖端标准到位:导管尖端位于标准预测量位置,即上腔静脉下三分之一段至上腔静脉与右心房交界处水平(cavoatrial junction,CAJ)[16];④导管尖端精准到位:指CXR示导管尖端位于CAJ处[16](CAJ为CVC最佳位置[2])。对照组由CXR判断导管尖端位置;试验组由EDUG观察到特征性P波初步判断导管尖端是否到位,后期行床旁CXR再次确认导管尖端位置;⑤结合Hanauer作者团队及张莹作者团队的报道[17-18],将患者出现的与CVC相关的并发症,包括血气胸、穿刺失败、导管堵塞、导管相关性血流感染、导管相关静脉血栓、医用黏胶相关皮肤损伤等并发症纳入统计,计算各组并发症发生率。
1.5.2 EDUG中心静脉置管时间优势 ①置管耗时:指穿刺前评估血管开始到送管结束的时间;②输液等待时间:指从置管结束到可以使用CVC进行输液治疗的时间。
1.5.3 IC-ECG与CXR诊断CVC导管尖端精准到位的一致性与准确性 采用McNemar检验与Kappa一致性检验结果评价一致性,同时通过IC-ECG诊断CVC导管精准到位的灵敏度、特异度、约登指数、准确度、假阳性率、假阴性率、阳性预测值和阴性预测值来评价其准确性。
1.6 质量控制
1.6.1 分配方案隐藏 随机分组情况由专人负责和实施,随机分组人员不参与试验其他环节 。
1.6.2 置管人员 所有患者由我院中心静脉床旁置管小组完成,该小组共4名成员,均有5年以上穿刺工作经验,人均完成中心静脉置管总例数大于2 000例,均按照规范采取相同的置管操作流程。
1.6.3 导管尖端判断人员 试验组与对照组均在置管完成后行床旁胸部X线摄片,由影像科同一医生进行导管尖端定位诊断,同一护士再次观察和记录导管走行和尖端位置,对两位诊断者均实施盲法。
1.6.4 数据收集人员 为经过统一培训的4名置管小组成员。
1.7 统计学方法
采用SPSS 26.0统计学软件对数据进行处理,服从正态分布的定量资料采用均数±标准差描述,两组间比较采用t检验。定性资料采用例数[n(%)]描述,组间比较采用χ2检验或Fisher确切概率法。采用McNemar检验与Kappa一致性检验分析床旁IC-ECG和床旁X线诊断导管尖端精准到位的准确性与一致性,Kappa≥0.75为一致性良好。检验水准α除特别说明外均设定为0.05。
2 结 果
2.1 两组一般资料比较
根据研究入组条件,共选取320例颈内静脉CVC置管患者,其中35例失访。试验组151例,其中肺癌31例,淋巴瘤27例,卵巢癌15例,结肠癌13例,直肠癌10例,胃癌9例,脑瘤9例,骨肉瘤9例,食管癌7例,宫颈癌7例,肝癌6例,肾癌3例,子宫内膜癌3例,胰腺癌1例,黑色素瘤1例。对照组134例,其中肺癌28例,淋巴瘤24例,结肠癌15例,卵巢癌11例,胃癌11例,直肠癌8例,脑瘤7例,肝癌7例,宫颈癌6例,骨肉瘤5例,食管癌5例,肾癌3例,子宫内膜癌2例,黑色素瘤2例。两组患者年龄、身高、性别、置管部位、导管腔数的差异无统计学意义(P>0.05),两组具有可比性(表1)。

表1 两组一般资料比较(n = 285)Table 1.General Data in Two Groups (N = 285)
2.2 两组置管安全性比较
对照组置管134例次,置管后CXR诊断导管尖端异位7例次(图1、2),带管期间并发症发生8例次,分别是导管医用黏胶相关皮肤损伤5例,导管堵塞3例;试验组置管151例次,置管后CXR诊断导管尖端异位0例次,带管期间并发症发生7例次,分别是导管医用黏胶相关皮肤损伤3例,导管堵塞4例。两组均未发生血气胸、穿刺失败、感染等严重并发症。导管尖端标准到位率与导管尖端精准到位率两项指标,对照组与试验组比较差异具有统计学意义(94.8%vs100.0%,P<0.05;86.6%vs98.7%,P<0.05)。一次性穿刺成功率、一次性送管成功率、并发症发生率等3项指标,两组比较差异无统计学差异(P>0.05;表2)。

图1 对照组CVC置管后导管尖端异位于腋静脉(箭头指示处) Figure 1.Catheter Tip Misplaced in the Axillary Vein (as Indicated by the Arrow) after Central Venous Catheterization in the Control Group
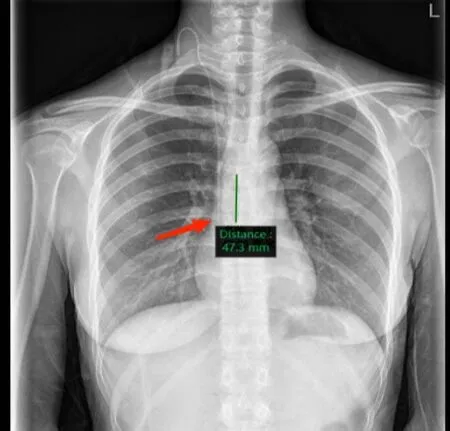
图2 经调整后导管尖端位于标准位置(箭头指示处)Figure 2.Catheter Tip Standard Placement (as Indicated by the Arrow) after Adjustment

表2 两组置管安全性比较Table 2.Safety of Catheterization in Two Groups
2.3 两组时间效率比较
经t检验,两组置管耗时差异无统计学意义(P> 0.05),但两组输液等待时间差异具有统计学意义[(45.63±10.56)minvs(5.62±1.54)min,P<0.05;表3]。
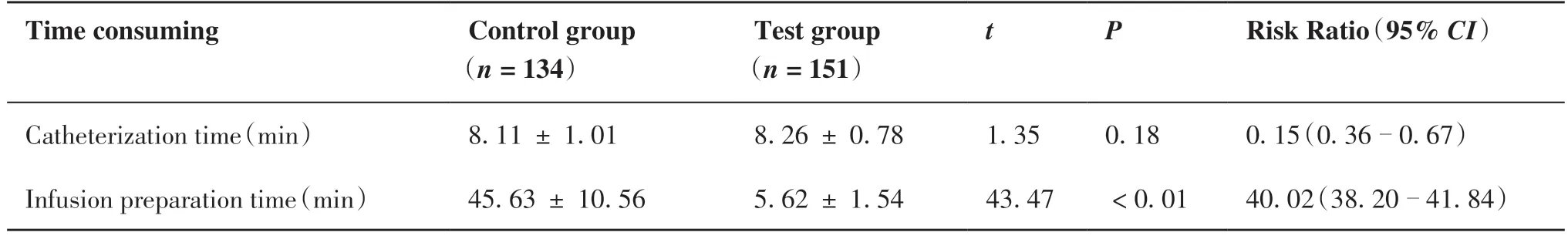
表3 两组时间比较Table 3.Time Consuming in Two Groups
2.4 两种导管尖端定位方法一致性与准确性比较
试验组151例次置管采用两种定位方法诊断CVC导管尖端是否到达精准位置,其中IC-ECG第一次诊断CVC导管未精准到位8例,使用超声探头检查同侧及对侧锁骨下静脉及腋静脉,有4例导管异位于同侧锁骨下静脉及腋静脉,4例未检查出异位。8例均回撤导管重新送管,再次使用IC-ECG技术,4例诊断非精准到位,再次使用超声检查同侧及对侧腋静脉,未发现导管尖端异位,经X线诊断8例均到达标准位置,其中2例为非精准到位。
IC-ECG诊断导管精准到位147例次,CXR诊断导管精准到位149例次,IC-ECG诊断未精准到位但CXR诊断导管精准到位2例。McNemar检验结果P为0.500,Kappa一致性检验Kappa值为0.661(P<0.001,表4)。本研究根据公式并参考表4 数据计算床旁IC-ECG诊断CVC导管精准到位的灵敏度为98.66%(a/R1×100%)、特异度为100%(d/R2×100%)、约登指数为0.99[(灵敏度 + 特异度)-1]、准确度为98.68%[(a+d)/n×100%]、假阳性率为0(b/R2×100%)、假阴性率为1.34%(c/R1 ×100%)、阳性预测值为100%(a/L1×100%)和阴性预测值为50%(d/L2×100%)。

表4 两种诊断导管精准到位方法比较Table 4.Two Methods in the Diagnosis of Catheter Optimal Placement
3 讨 论
3.1 EDUG提高肿瘤患者床旁CVC置管导管尖端精准到位率,促进用管安全
IC-ECG可作为导管尖端到位的判断标准,但目前较多研究集中于IC-ECG在PICC中的应用,关于IC-ECG在床旁肿瘤患者CVC置管中的研究报道较少[19]。申请床旁置管的肿瘤患者大多数病情危重,体位摆放有所限制,导致穿刺及送管难度增加。本研究中,试验组使用EDUG一体机后,一次性穿刺成功率与一次性送管成功率均较高,并且与普通超声比较差异无统计学意义(P<0.05),说明EDUG穿刺具有较好的安全性。
本研究试验组导管尖端标准到位率达100%,精准到位率达98.7%,接近江群等[13]报道的普通患者CVC集中置管使用IC-ECG后导管到位率99%,说明IC-ECG技术可应用于床旁CVC置管中导管尖端的判断。对照组未使用腔内心电图定位,有7例导管尖端异位于胸壁段腋静脉,导管尖端标准到位率为94.8%,精准到位率达86.6%,与试验组数据比较差异有统计学意义(P<0.05),提示使用 IC-ECG能提升CVC置管导管尖端精准到位率。若尖端不到位,置管人员需要重新调整,反复送管,增加置管感染风险[20-21]。同时,若导管尖端不到位的情况下使用导管,容易有药物外渗风险,而肿瘤患者用药常具有较强刺激性,易引起患者的不良反应[22]。因此,使用EDUG一体机能够明显提升CVC尖端精准到位率,促进导管使用安全。
3.2 EDUG减少床旁CVC输液等待时间,提高危重肿瘤患者的救治效率
2021版INS指南中提出,在急诊科或抢救医治情景中,导管尖端的位置得到快速确认尤为重要[16]。使用IC-ECG技术需要有心电监护功能,若无EDUG仪器时,需要单独连接心电监护仪或心电图机,而心电监护仪并非随取随用[23];同时,使用普通心电监护仪,需搭配使用心电转换器,但并非所有医疗机构都备有该转换器。另外,使用普通心电监护开展腔内心电技术,需要先引出体表基础心电图,再使用转换器引出腔内心电图,操作程序复杂,耗时较长[6]。而使用EDUG开展IC-ECG技术则无需使用转换器,体表基础心电图与腔内心电图可同时显示在屏幕上,并能够智能分析导管尖端进入上腔静脉的位置,该设备操作程序简单,能够快速判断导管尖端是否到位,同时EDUG体积小巧,方便在病房狭小空间移动使用,更加节约时间。若采用传统CXR定位方法,则需要等待影像科工作人员推拍片设备来到床旁,同时,CXR检查存在一定的主观因素,由于胸片的清晰程度不同,有时需要花费时间读片辨别导管尖端,同时由于胸片的滞后性以及无菌原则的限制,若导管异位则无法及时调整[4]。因此,采取传统的CXR定位方法不能做到置管后即刻输液治疗。本次调查两组输液等待时间差异接近40分钟,提示使用EDUG能大幅度降低患者输液前等待时间,提高危重肿瘤患者的救治效率。
3.3 EDUG定位床旁CVC导管尖端具有较好的准确性,与CXR诊断方法相比具有一致性
床旁IC-ECG诊断CVC导管尖端精准到位具有较高的灵敏度(98.66%)、特异度(100%)、准确度(98.68%),约登指数(0.99)接近1,假阳性率为0,假阴性率为1.34%、阳性预测值为100%,阴性预测值为50%,说明利用IC-ECG定位技术能准确判断CVC导管尖端位置是否到达CAJ处。同时,McNemar检验 值P为0.500,说明IC-ECG与CXR诊断导管精准到位方法结果差异不具有统计学意义。但床旁IC-ECG与床旁CXR诊断CVC导管尖端精准到位的Kappa一致性检验Kappa值为0.661,P<0.001,一致性结果成立,但一致性情况属于中等程度。分析原因可能为,导管尖端位于CAJ处为精准到位,CAJ是指上腔静脉与右心房交界处,若导管尖端在CAJ处,P波显示为最大振幅,而使用P波振幅变化引导送管时,通常情况下是在最大振幅后回撤0.5 cm~1 cm,由于不同患者的身高身形差异、自身疾病及强迫体位等因素,0.5 cm~1 cm的距离有可能导管尖端已退至上腔静脉而非CAJ处,因此提示临床若要判断肿瘤患者的床旁CVC置管尖端是否精准到位仍要以CXR作为金标准[15]。
综上所述,本研究发现EDUG在不增加置管时间和相关并发症发生率的情况下,既可以利用超声功能行血管评估定位、送管中导管异位检测,提高穿刺成功率,又可以利用IC-ECG提高导管尖端到位率,保证置管安全与用管安全,且降低患者输液等待时间。EDUG CVC置管具有较好的安全性与准确性,高效便捷,非常适合临床危重患者的床旁穿刺置管与紧急救治工作。但本研究具有样本量少、均为肿瘤患者、穿刺血管均为颈内静脉等局限性,未来可开展EDUG在多中心大样本的急危重患者不同穿刺静脉与不同导管类型的探究,为临床床旁穿刺置管救治工作的开展提供参考。
作者声明:本文全部作者对于研究和撰写的论文出现的不端行为承担相应责任;并承诺论文中涉及的原始图片、数据资料等已按照有关规定保存,可接受核查。
学术不端:本文在初审、返修及出版前均通过中国知网(CNKI)科技期刊学术不端文献检测系统的学术不端检测。
同行评议:经同行专家双盲外审,达到刊发要求。
利益冲突:所有作者均声明不存在利益冲突。
文章版权:本文出版前已与全体作者签署了论文授权书等协议。

