局部晚期食管癌新辅助放化疗疗效评估
张欢,王毅,吴磊,王奇峰,刘丽
610054 成都,电子科技大学 医学院(张欢);610041 成都,四川省肿瘤医院·研究所,四川省癌症防治中心,电子科技大学 胸部放疗科(王毅、吴磊、王奇峰、刘丽)
据世界卫生组织国际癌症机构发布的2020年全球最新癌症负担数据统计,食管癌是世界第8大常见恶性肿瘤,是导致癌症死亡的第6大原因。食管癌预后差,全世界范围内5年生存率仅为15%~25%[1-2]。局部晚期食管鳞癌(esophageal squamous cell carcinoma,ESCC)患 者 目 前 临床的标准治疗方案为新辅助放化疗(neoadjuvant chemoradiotherapy,nCRT)后行食管癌根治术治疗,但术后切口感染、吻合口瘘、吞咽困难、乳糜胸等并发症发生风险较高,严重影响患者短期及长期的生活质量,根据荷兰CROSS研究[3]和中山大学NEOCRTEC5010研究[4],ESCC患者nCRT后大约有40%的患者达到病理完全缓解(pathological complete response,pCR)。对nCRT后获得pCR的患者采取主动监测与nCRT后手术切除的患者进行无进展生存时间和总体生存率(overall survival,OS)的比较,两者没有显著差异,获得pCR的患者仅在监测到肿瘤复发时再手术并不会导致患者OS降 低[5-7]。对nCRT后pCR患者能否采取主动监测以提高生活质量是一个有待探索的问题[8-9]。pCR的判断依赖手术治疗,这将可能导致nCRT后获得pCR的患者面临术后并发症风险及较低的生活质量,有学者提出在不影响患者OS及无病生存率(disease free survival,DFS)的情况下,对nCRT后达到临床完全缓解(clinical complete response,cCR)的患者行非手术治疗模式(密切监测或行根治性放疗),但目前这一观点尚无定论。也有相关研究报道nCRT后手术治疗与根治性放化疗患者预后的比较,如在Castoro等[10]的研究中将nCRT后达到cCR的ESCC患者分为手术组和根治性放化疗组,发现两组间5年OS和DFS并无差异。荷兰开展的SANO前瞻性研究[11],将nCRT后达到cCR的食管癌患者分为两组,分别行手术治疗和主动监测,如发现肿瘤进展则立即手术,目前该研究已完成患者入组,非常期待SANO研究的结果。
现有研究认为cCR提示患者可能达到pCR,但二者并不完全相关[12],有研究发现非cCR患者仍有28.9%可达pCR,而cCR术后有相当比例患者未达pCR,造成这一现象的原因是目前临床常用再分期方式判断nCRT后是否有病灶的残留,其准确性仍有待提高[13]。笔者拟就食管癌nCRT后疗效评估和预后的研究展开综述。
1 影像学评估方法
1.1 食管内镜及食管腔内超声(esophageal endoscopy and intraesophageal ultrasound, EUS)
EUS在食管癌的诊断及分期中具有重要作用。有学者尝试利用EUS预测局部晚期食管癌患者nCRT后残留病灶以评估疗效。PreSANO多中心研究发现,内镜显示的残留病灶与术后病理证实的残留病灶存在显著相关性,内镜怀疑肿瘤残留病灶的阳性预测值在nCRT后第6周为91%,而在第12周为100%,证实内镜检查在食管癌nCRT后主动监测中发现残留病灶具有潜在价值[14]。Cosgrove等[15]中的一项分析中发现EUS作为nCRT前的分期至关重要,但作为nCRT后再分期的方法存在争议,两者均不能很好地预测pCR的患者,而这部分患者正是需要采取主动监测以避免手术的人群。因此EUS是否能作为nCRT后预测pCR及疗效评估的方法存在争议。 van der Wilk等[16]尝试利用内镜活检作为食管癌nCRT后疗效评估的方式,但内镜活检仅能检测至黏膜层,而大约有1/3的患者残留病灶位于黏膜下层。虽然深度咬检被证实相比于传统的活检术能提高敏感性,但患者面临更高风险的出血、穿孔可能。在Qian等[17]的一项针对东亚地区ESCC患者的研究中,在放疗剂量至40 Gy及4个化疗周期后进行EUS,评估nCRT后咬检样本中肿瘤缓解和肿瘤间质淋巴细胞浸润是否可以作为病理反应的预测因子,结果证实二者结合预测pCR的敏感性和特异性分别为86.7%、90.9%,提示该预测模式有很大可能能够准确预测pCR,但这一结论需要在多中心、前瞻性研究中进一步验证。内镜下活检和EUS对预测nCRT反应的临床价值和准确性存在争议,内镜活检的主要问题是特异性差,而EUS主要问题是敏感性不足以预测nCRT的反应[17]。结合内镜活检及EUS能弥补单一模式下的缺陷。目前研究发现食管内镜下活检和EUS在nCRT后预测pCR的阳性预测值有待提高,但对于有病理完全反应的患者其检出准确性仍有待提高。
1.2 CT
CT因具有经济且容易操作的优点,被认为是食管癌诊断、分期及预测nCRT疗效必不可少的手段[18]。然而,CT对食管癌分期及淋巴结转移判断的准确性尚不令人满意,但CT对转移灶的诊断及评估准确性较高。有学者通过nCRT前后ESCC原发肿瘤最大厚度下降百分比预测治疗反应,发现原发肿瘤最大厚度下降百分比>40%的pCR率明显高于最大厚度下降百分比≤40%的pCR率。通过CT测定的肿瘤厚度变化可能是pCR的一个潜在预测因子,且后续可用于制定个体化治疗策略[18]。利用CT的深度学习模式预测ESCC患者nCRT治疗反应,AUC和准确率分别为0.805和77.1%,提示这种新型的深度学习方法可以有效、准确地预测ESCC患者的nCRT治疗反应[19]。另一项研究[20]分析了肿瘤内和肿瘤周围放射组学特征预测ESCC患者nCRT后pCR的可能性,结果也显示出CT具有良好的预测价值,且发现瘤内和瘤周特征的结合提高了放射组学模型对患者pCR的预测能力。
在临床工作中,CT的运用非常普遍,对于局部晚期ESCC更是如此。ESCC患者在nCRT前后都需依靠CT评估原发肿瘤大小、与周围组织关系、淋巴结转移、远处转移情况及治疗效果等。怎样运用CT这一临床常见检查项目评估食管癌nCRT后的病理反应的准确性有待进一步研究,以达到术前筛选出可采取主动监测的患者的目的。
1.3 18F-FDG PET/CT
PET/CT广泛用于肿瘤分期及判断有无远处转移、评估治疗反应及监测肿瘤复发。Murakami等[21]的研究纳入98例局部晚期ESCC患者,均在nCRT后接受手术治疗,根据术后病理诊断将患者分为完全缓解组和不完全缓解组,构建机器学习预测模型预测pCR,结果提示预测模型的准确率为89.6%,灵敏度为92.7%,特异度为89.5%,证实基于18F- FDG PET/CT放射组学的机器学习模型对ESCC患者接受nCRT治疗的局部反应有良好的预测准确性。对于选择主动监测的患者准确判断肿瘤复发是非常关键的,大多数肿瘤复发患者的最大标准摄取值(maximum standardized uptake value,SUVmax)呈隐匿性升高;而cCR患者的SUVmax表现为稳定或下降[22]。研究者对ESCC患者nCRT前和nCRT完成后4~6周分别进行PET/CT检查[23],对 nCRT后行再分期,无进展者接受手术治疗,进展者行二线全身化疗,根据术后病理将患者分为pCR组和非pCR组并比较组间参数差异,结果显示两组间肿瘤代谢体积(metabolic tumor volume,MTV)、糖酵解总量(total lesion glycolysis,TLG)变化百分比(∆MTV、∆TLG)具有显著差异,而nCRT前后的SUVmax及变化百分比差异无统计学意义。说明MTV、TLG能更好地反映pCR的情况[24]。在Borggreve等[25]类似的研究中,nCRT前MTV和TLG预测pCR的AUC高于SUVmax,但这些参数不足以检测原发病灶内的微小残留肿瘤。
PET/CT作为食管癌nCRT疗效评估的一种重要影像检查方式,在早期发现食管癌、判断有无局部侵犯及远处转移等方面具有重要作用,已被证实可通过代谢变化评估肿瘤细胞活性程度及范围从而进行肿瘤疗效评估。但因其价格昂贵、临床使用率不及CT等其他影像学检查方式,导致利用PET/CT评估食管癌nCRT后病理反应研究的样本量小,目前需要更多大样本的研究进一步证实其预测 价值。
1.4 MRI
MRI在食管癌的分期及诊断中的运用并不广泛,但目前也有相关研究分别从图像、影像组学等方面预测食管癌的放化疗反应。有学者[26-27]研究动态对 比 增 强MRI(dynamic contrast enhanced MRI,DCEMRI)预测和评估ESCC的nCRT疗效,在研究中,局部晚期ESCC患者 nCRT前及结束后均行DCE-MRI检查,所有患者在nCRT后均接受手术治疗,通过比较术后病理完全缓解组与非完全缓解组nCRT治疗前后的体积转移常数(Ktrans)的变化,不同的是Sun等[27]认为nCRT治疗前第10百分位的Ktrans值在预测治疗反应方面具有最好的价值(AUC=0.824);而Ji等[26]认为nCRT后的Ktrans能更好地预测nCRT治疗反应(AUC=0.813)。有研究利用磁共振弥散加权(diffusion-weighted MRI,DW-MRI)预测ESCC患者nCRT后的病理反应[25,28]。患者在nCRT前后各行1次DW-MRI检查,入选者根据术后肿瘤退缩分级分为pCR组和非pCR组,使用表观扩散系数(apparent diffusion coefficient,ADC)预测nCRT后的病理反应,研究认为nCRT前及治疗2周后ADC变化百分比与pCR显 著 相 关(c-index为0.87)。Heethuis等[29]在ESCC患者nCRT前、nCRT期间及nCRT后进行DWMRI与DCE-MRI检查后行手术治疗,根据术后病理将患者分为pCR组及非pCR组,发现治疗前后第75百分位的ADC改变及第90百分位AUC改变最能预测pCR(c-index分别为0.75、0.79),结果显示两种方式在预测食管癌nCRT后病理反应方面具有互补价值。
MRI因具有多种扫描序列,能较好地区分食管壁结构及肿瘤侵犯深度从而能较准确地判断nCRT前后T分期,但存在运动伪影、T1及T2分辨率欠佳等缺陷;MRI诊断淋巴结转移因造影剂的不同而具有不同的敏感性和特异性,临床缺少标准化扫描方案导致可重复性差、诊断标准不一等情况。关于MRI用于评估ESCC患者nCRT后病理反应的准确性尚有待更多的研究。
1.5 多种影像联合评估方式
PET/CT联合内镜咬检及超声内镜检查评估ESCC患者nCRT后cCR与pCR的准确性尚无统一定论,有学者尝试使用其他的组合方式来准确预测pCR。在一项结合PET/CT与MRI的研究中,对ESCC患者nCRT治疗前、治疗期间及治疗后均进行PET/CT和DW-MRI检查后行手术治疗,根据术后病理将患者分为pCR组与非pCR组,分析nCRT治疗前、治疗期间及治疗后的参数变化评估病理反应。结果显示nCRT前后PET/CT的平均标准摄取值(mean standardized uptake value,SUVmean)、TLG变化在pCR组与非pCR组间有显著差异(P值分别为0.016、0.024);而nCRT治疗前及治疗期间获得的DW-MRI的ADC的变化更能预测pCR,当结合PET/CT与DW-MRI分析预测pCR准确性时,发现二者具有互补价值[25],这一研究在Xu等[23]的研究中得到证实。
虽然ESCC患者nCRT前、期间及nCRT后的MRI以及PET-CT可以作为预测pCR的方式,如果选择nCRT后的评估方式来预测pCR,则检查时间应该尽可能地接近手术治疗时间,可减少因放射性食管炎引起的假阳性结果,而这种假阳性结果的可能性随着nCRT后的间隔时间延长逐渐减小下降。
2 nCRT联合免疫治疗疗效评估的研究
近年来,针对程序性细胞死亡1(programmed cell death 1,PD-1)及其配体PD-L1治疗恶性肿瘤的潜力已经被众多学者证实,恶性肿瘤的治疗进入免疫时代[30]。PD-1及其配体用于乳腺癌、肺癌、直肠癌[31-33]等实体肿瘤的研究取得了令人鼓舞的结果。局部晚期食管癌免疫检查点抑制剂联合nCRT后手术切除已成为局部晚期食管癌研究的热点区域。2022年美国临床肿瘤学会年会上报道了国内一项单中心、单臂探索性IB期关于nCRT联合免疫治疗的研究,该研究共纳入 20例新辅助治疗后可进行手术治疗的食管癌患者,其中11例获得pCR,证实nCRT联合免疫治疗是一种安全、有效的治疗方式。这一研究结果也在PALAC-1研究中得到证实[34]。在Feng等[35]的研究中,对285例局部晚期食管癌患者在新辅助化疗联合免疫治疗后行手术治疗,其中有84例达到pCR,该研究综合了术前炎症指标及营养评分(integrative inflammatory and nutritional score,IINS)来预测pCR,于新辅助治疗前采集血液学指标(包括中性粒细胞计数、血小板计数、淋巴细胞计数、血红蛋白、白蛋白、前白蛋白、超敏反应蛋白、乳酸脱氢酶等),构建预测局部晚期ESCC患者新辅助化疗联合免疫治疗pCR的模型,结果为IINS对pCR的评估具有很好的准确性(<0.001)[35]。目前发现nCRT联合免疫治疗对局部晚期食管癌临床效果显著,但这类研究开展较少,且都属于小样本探索阶段,预测评估nCRT联合免疫治疗的疗效的研究相对更少,希望未来有更多的临床研究开展,为局部晚期食管癌患者开辟更多安全有效的治疗策略。
3 总结与展望
综上,局部晚期食管癌目前标准治疗模式为新辅助治疗联合手术,但食管癌根治性切除手术范围较大,给患者带来了较大的术后并发症风险及降低了患者生活质量,因此能够在nCRT后手术前准确筛选出pCR的患者是必要的。伴随着免疫治疗在恶性肿瘤治疗中的快速发展,我国研究者在nCRT联合免疫治疗的研究中走在前列,如上海市胸科医院李志刚教授牵头的一项前瞻性、单臂、多中心、开放标签的II期临床研宄,旨在评估新辅助化疗联合卡瑞利珠单抗治疗局部晚期ESCC的疔效和安全性,同时还有医科院肿瘤医院李印教授等国内学者牵头的新辅助治疗联合免疫治疗的研究正在开展,期待研究结果能为局部晚期食管癌患者提供更多新的治疗方案。
局部晚期食管癌nCRT后疗效评价及预后分析的方式众多,影像评估方式包括内镜及活检、超声内镜、CT、MRI、PET/CT及多种不同方式的组合等。众多学者尝试从不同角度研究各种方式的可行性及准确性,从而对nCRT后患者进行风险分层并选择最有利于患者预后的治疗策略。
影像方法从最初单一的残留病灶活检、肿瘤体积信号改变和密度的差异到深层次的影像组学及预测模型建立,迈出了快速的步伐。但同时我们清醒地认识到各种评估方法都有其短板:EUS在nCRT后对获得pCR的患者阳性预测值高,但对于获得pCR的患者其阴性预测值不够准确;CT对微小残余病灶检测能力不足;PET/CT评估pCR异质性较大、感兴趣区域勾画不统一;MRI在食管癌的运用较少,所得结果偏倚较大。也有研究将不同影像评估方式进行组合以提高判断pCR的准确性,目前运用最多的是PET/CT与内镜活检及EUS相结合以提高预测pCR的准确性。但目前临床对于各种评估手段判断cCR并无统一标准,表1中笔者将各种评估方式的优缺点及常用的判断cCR的标准及预测pCR的准确性加以整理归纳(表1)。如何做到博取众家之所长,找到适宜的方法或指标最终实现准确预测局部晚期食管癌患者治疗反应的终极目标,还需要研究人员不断的努力。
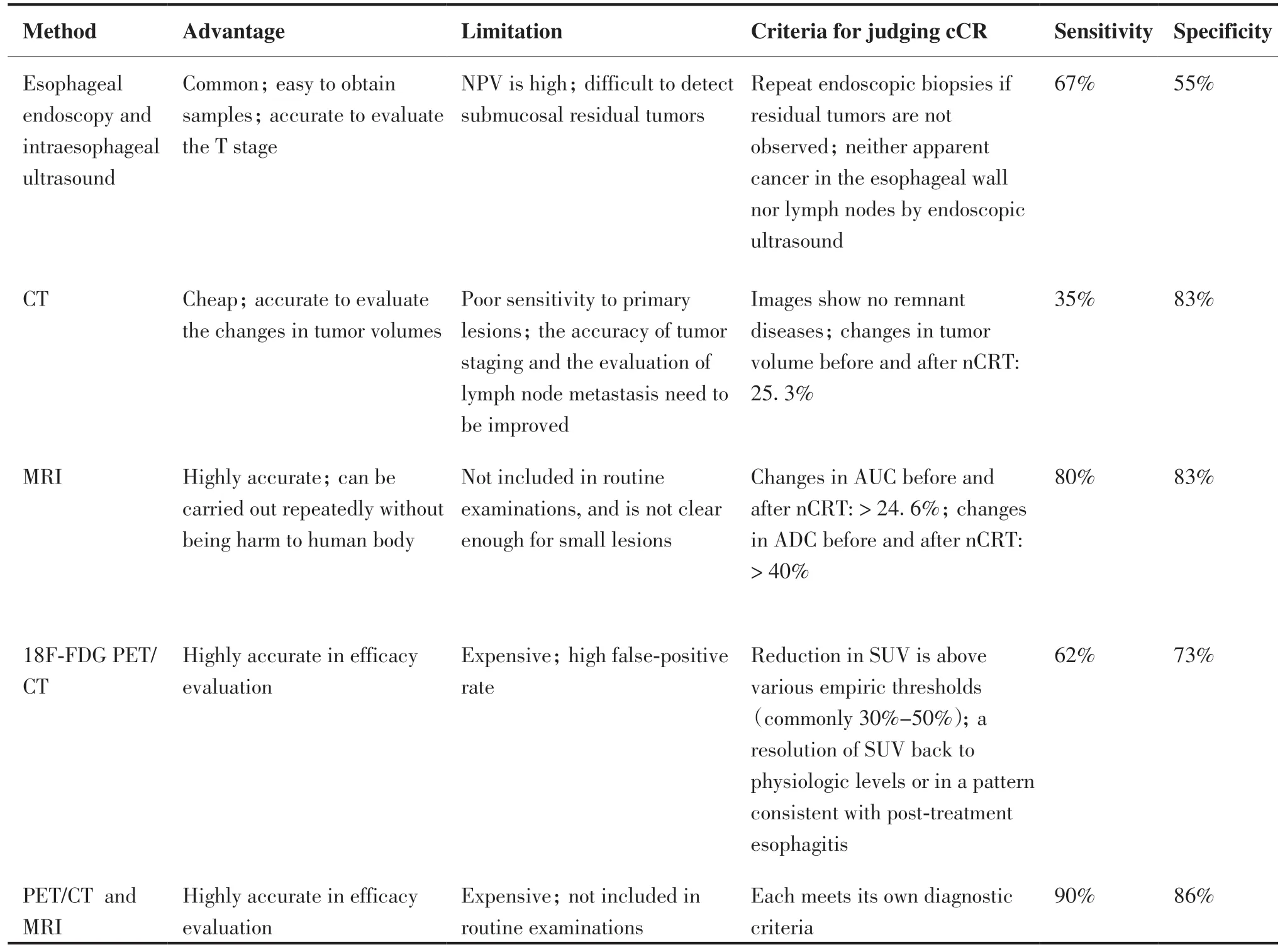
表1 局部晚期食管癌nCRT疗效预测及评估方法Table 1.Prediction and Evaluation of nCRT Efficacy in Locally Advanced Esophageal cancer
虽然目前还没有评估局部晚期食管癌新辅助治疗疗效及预后的统一标准,但我们相信,随着科技的不断发展,各项研究的不断深入,更多有价值的前瞻性临床试验的完成,最终能够将nCRT后肿瘤降期与不同的影像学检查方式结合起来,准确预测患者新辅助治疗后的疗效,对达到cCR的患者实行器官保留的策略,待到复发时再行挽救性手术。这将大大提高这部分患者的生活质量,从而实现患者利益最大化。
作者声明:本文全部作者对于研究和撰写的论文出现的不端行为承担相应责任;并承诺论文中涉及的原始图片、数据资料等已按照有关规定保存,可接受核查。
学术不端:本文在初审、返修及出版前均通过中国知网(CNKI)科技期刊学术不端文献检测系统的学术不端检测。
同行评议:经同行专家双盲外审,达到刊发要求。
利益冲突:所有作者均声明不存在利益冲突。
文章版权:本文出版前已与全体作者签署了论文授权书等协议。

