胸腔镜下非小细胞肺癌肺叶切除术中转开胸的预测模型构建与验证*
刘菁,周怡睿,刘鋆,陈虹,于冬梅
200433 上海,同济大学附属上海市肺科医院 日间病房(刘菁、刘鋆、陈虹),综合科(周怡睿),内镜 中心(于冬梅)
手术切除是早期非小细胞肺癌(non-small cell lung cancer,NSCLC)主要治疗方式[1],电视胸腔镜下肺叶切除术创伤低,术后疼痛减轻,可更好地保护肺功能,减少术后并发症,被认为是大多数接受肺叶切除术患者的初始方法[2]。但胸腔镜下肺叶切除也有一定劣势,其显示的影像呈二维性,导致胸腔镜下胸内组间缺少距离感,因此对胸外科医生操作水平要求较高。近年来调查显示[3-5],胸腔镜下肺叶切除术的肺癌患者非计划中转开胸发生率在3.8%~11.7%之间。中转开胸意味着手术时间延长,单肺通气和手术操作增加,失血量更多,因此造成并发症增加,住院时间延长,还可导致死亡风险升高[6-7]。电视胸腔镜下肺叶切除术患者的动脉出血和损伤很难预测,但各种术前放射学表现、患者临床病史可以预测中转开胸。既往报道指出[7-9],肺门淋巴结纤维钙化、CT扫描肺门阳性、肿瘤大小、胸膜粘连的患者面临更高的中转开胸风险。因此,分析中转开胸的危险因素,并进行个体化预测,对于医护人员做好术前准备,制定针对性的方案,降低手术风险,具有重要临床意义。列线图预测模型是基于多因素筛选出的某疾病的独立危险因素绘制,可视化呈现各因素的贡献度[10],通过计算总分可获得患者出现某疾病的概率,易于操作,有助于临床医护人员尽快筛选出高危患者,提前做好应对措施。因此,本研究通过分析NSCLC患者行电视胸腔镜手术中转开胸的危险因素建立个体化的预测模型。现报道如下。
1 对象与方法
1.1 研究对象
回顾性分析2017年1月至2022年1月我院收治的463例NSCLC行胸腔镜下肺叶切除的患者为研究对象,中位年龄59(52,64)岁。按7∶3比例随机将其分为建模队列(n=324)与验证队列(n=139)。纳入标准:①术后经病理证实为NSCLC;②手术为三孔胸腔镜下根治性肺叶切除;③无远处转移;④病例资料完整。排除标准:①肿瘤存在于多个肺叶,行多个肺叶切除;②非NSCLC而行胸腔镜下肺叶切除的患者。本研究基于文献回顾,选取既往研究中6个胸腔镜下肺叶切除术中转开胸的独立影响因素,作为进入模型的假设预测变量,中转开胸的发生率为9%[7],根据样本量计算[11],发生中转开胸患者的例数是预测变量个数的5~10倍,考虑10%的丢失率,因此建模队列的样本量至少为6×5/0.09×(1+0.2)=400,本研究实际纳入463例符合纳入与排除标准的患者。其中建模队列为463×0.7=324,验证队列为463×0.3=139。本研究经我院伦理委员会批准(批准号:K21-117)。
1.2 研究方法
1.2.1 病历资料调查表 本研究基于文献学习法,经过专家小组会议讨论,确定纳入的危险因素。自行设计病历资料调查表,包括人口学资料(年龄、性别、吸烟史、体重指数)、既往病史(高血压、冠心病、肺结核、糖尿病)、术前CT指标(淋巴结钙化、胸膜粘连、肿瘤位置、肿瘤最大直径)、手术方式,共计13个变量。
1.2.2 资料收集方法 本研究为回顾性分析,通过计算机终端,利用医院的电子病历系统,根据自行设计的病历资料调查表收集数据。数据收集由两位研究者参与,工作年龄均>5年,具有一定的科研能力,能够熟练使用医院电子病历系统。对于临床资料中出现的个别缺失值,采用该变量均值替换。数据录入时由双人核对,再由第三方检查数据,以确保无误。
1.3 统计学方法
采用Excel 16.0录入数据,使用SPSS 24.0统计学软件分析数据,采用R软件(rms软件包)绘制列线图预测模型。本研究中的计数资料以频数、百分率%描述,组间比较采用χ2检验。符合正态分布的计量资料以均数±标准差描述,若样本方差不齐或呈偏态分布,以中位数(四分位数间距)描述。采用单因素分析筛选变量,采用Logistic回归构建预测模型,采用R软件绘制列线图,Bootstrap重复抽样 1 000次进行内部验证,采用校准曲线与Hosmer-Lemeshow拟合优度检验评估预测准确度,并使用受试者工作特征(receiver operating characteristic,ROC)曲线下面积评价模型区分度,决策曲线分析(decision curve analysis,DCA)评估模型的临床应用价值。以P<0.05为差异有统计学意义。
2 结 果
2.1 中转开胸率及原因分析
建模队列324例,中转开胸率为9.57%(31/324)。验证队列139例,中转开胸率为8.63%(12/139)。中转开胸的主要原因为淋巴与周围组织粘连,两个队列中转开胸原因占比差异无统计学意义(P>0.05) (表1)。
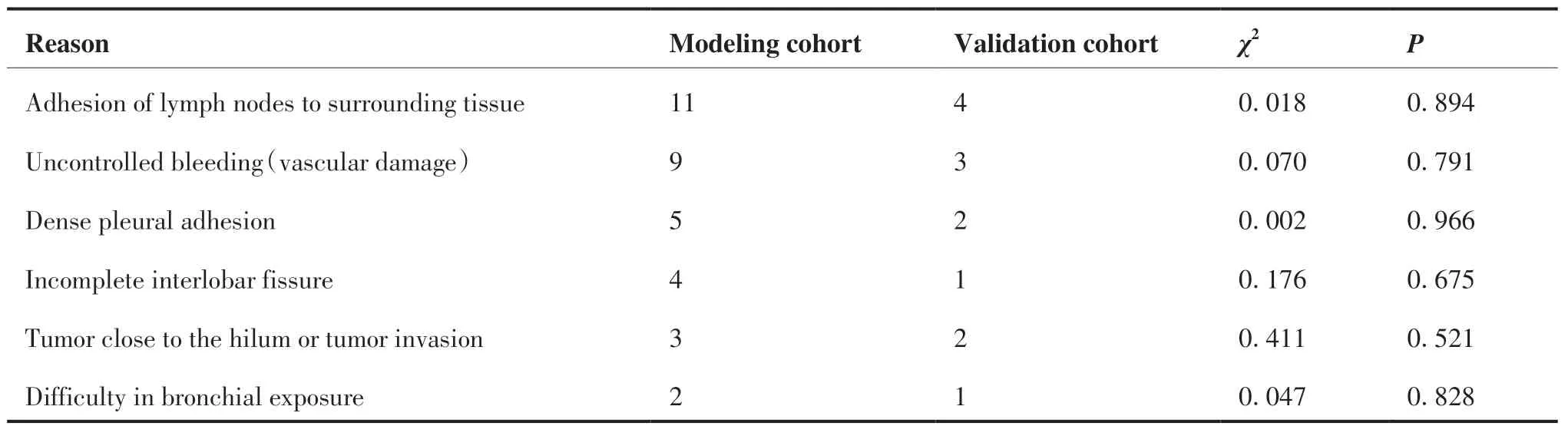
表1 中转开胸率及原因分析Table 1.Reasons for Conversion to Thoracotomy
2.2 影响胸腔镜下肺叶切除术NSCLC患者中转开胸的单因素分析
将建模队列患者按照是否发生中转开胸分为中转 开 胸 组(n=31)与 胸 腔 镜组(n=293),单 因素分析结果显示,开胸组与胸腔镜组在年龄、肺结核病史、淋巴结增大情况、胸膜是否粘连、肿瘤位置方面差异有统计学意义(χ2=6.604,P=0.010;χ2=12.543,P<0.001;χ2=8.501,P=0.014;χ2=5.652,P=0.017;χ2=10.462,P=0.001),其中年龄≥65岁、有肺结核病史、肺门淋巴结增大、胸膜粘连、肿瘤位于肺上叶倾向于开胸组(表2)。
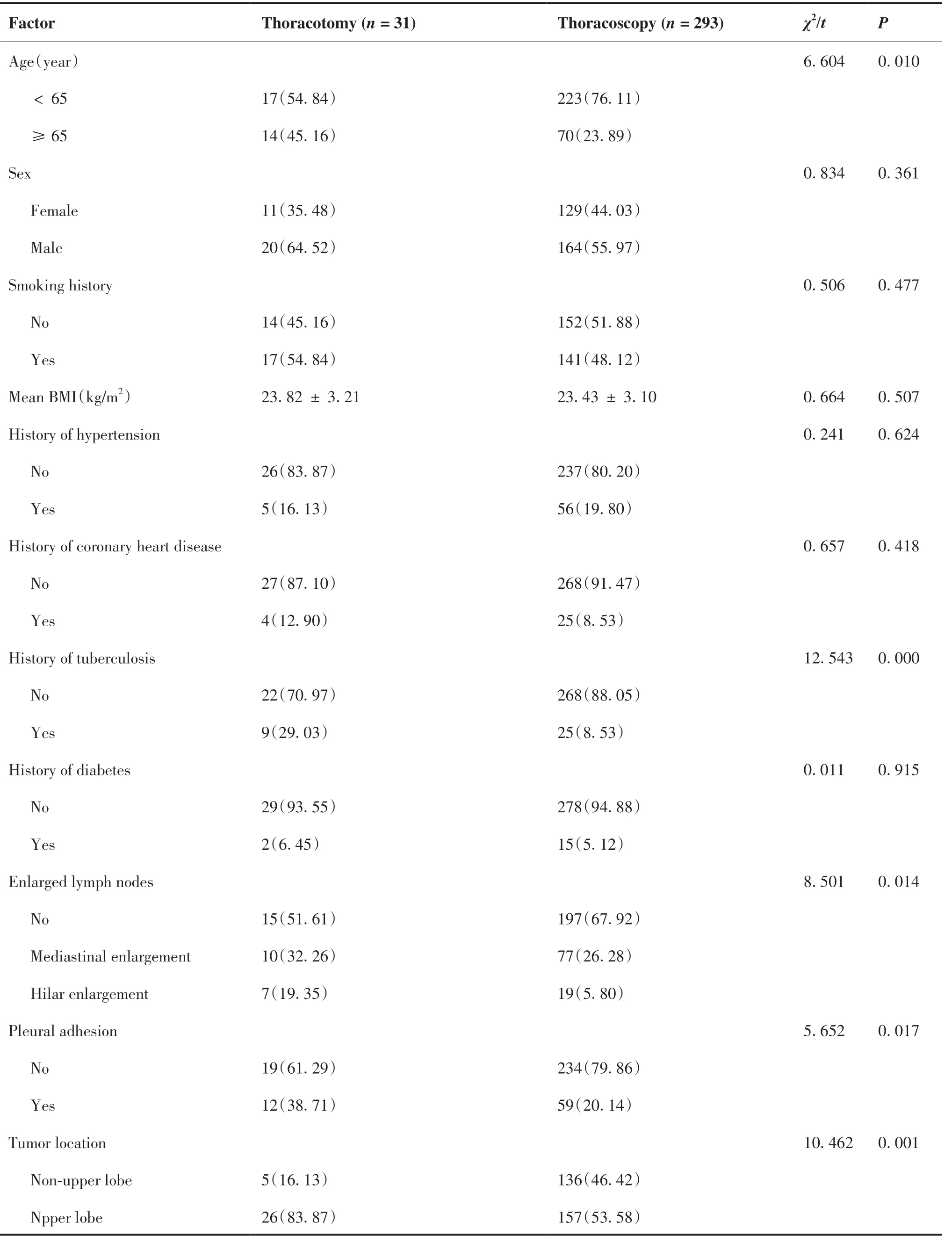
表2 影响胸腔镜下肺叶切除术NSCLC患者中转开胸的单因素分析Table 2.Univariate Analysis of Factors Affecting Conversion to Thoracotomy in NSCLC Patients Undergoing Thoracoscopic Lobectomy
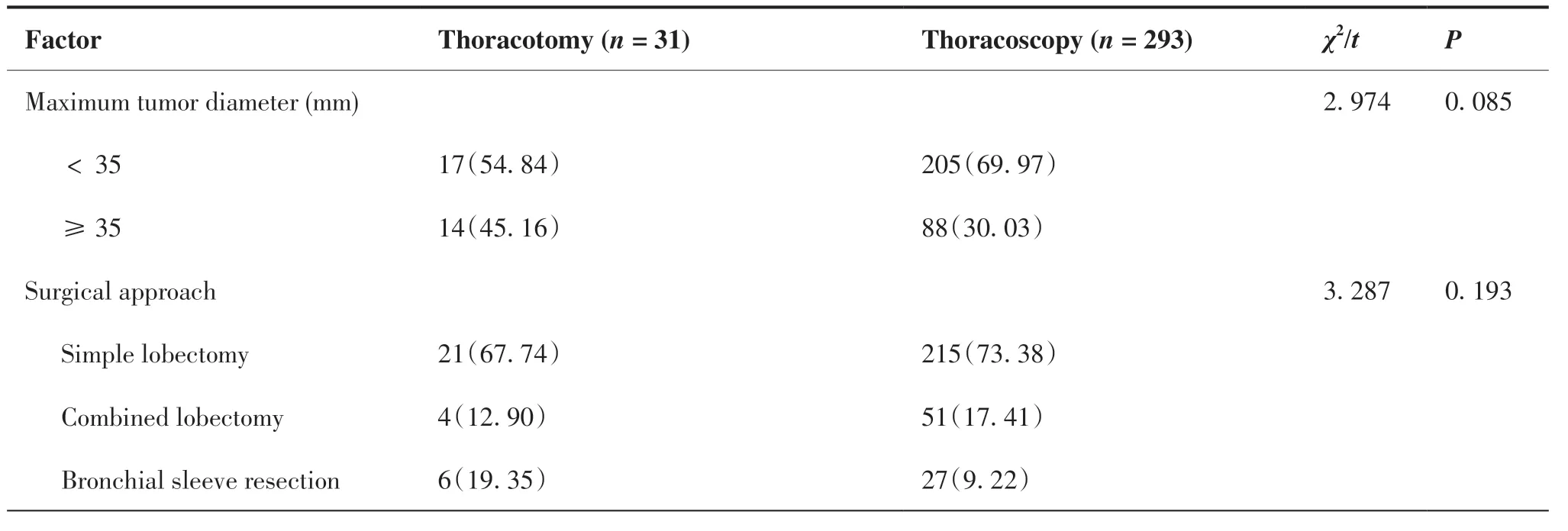
(Continued from previous page)
2.3 影响胸腔镜下肺叶切除术NSCLC患者中转开胸的多因素分析
将单因素分析有意义的影响因素纳入二分类非条件Logistic回归分析,采用向前法进一步筛选影响因素。自变量赋值:年龄:<65=0,≥65=1;肺结核病史:无=0,有=1;淋巴结:无增大=0,仅纵隔淋巴结增大=1,肺门淋巴结增大=2;胸膜粘连:否=0,是=1;肿瘤位置:非肺上叶=0,肺上叶=1。结果显示有肺结核病史、肺门淋巴结增大、胸膜粘连、肿瘤位于肺上叶是胸腔镜下肺叶切除术的NSCLC患者中转开胸的独立危险因素(P=0.003、<0.001、0.002、0.023)(表3)。将上述4个变量进行共线性诊断,方差膨胀因子均<10,因此不存在多重共线性问题。
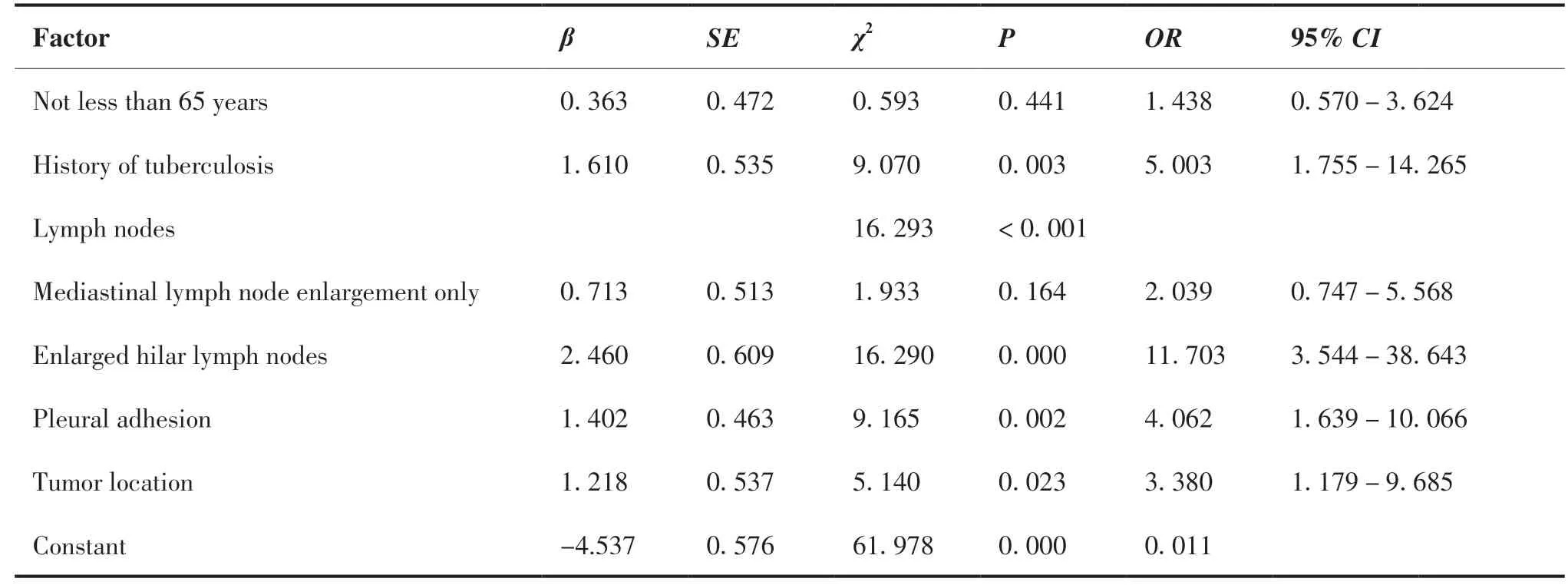
表3 影响胸腔镜下肺叶切除术NSCLC患者中转开胸的多因素分析Table 3.Multivariate Analysis of Factors Affecting Conversion to Thoracotomy in NSCLC Patients Undergoing Thoracoscopic Lobectomy
2.4 胸腔镜下肺叶切除术NSCLC患者中转开胸的风险预测模型建立
根据上述4个独立影响因素及其对应的回归系数,构建中转开胸的预测模型,Z=-4.537+1.610×肺结核病史+2.460×肺门淋巴结增大+1.402×胸膜粘连+1.218×肿瘤位于肺上叶。并使用R软件绘制胸腔镜下肺叶切除术的NSCLC患者中转开胸的列线图(图1)。
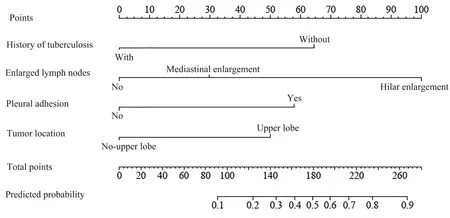
图1 胸腔镜下肺叶切除术NSCLC患者中转开胸风险预测列线图Figure 1.Nomogram for Predicting the Risk of Conversion to Thoracotomy in NSCLC Patients Undergoing Thoracoscopic Lobectomy
根据列线图中的变量分类可获得每项指标对应的分数,将各项分数相加可得总分,总分处向预测概率轴做垂线即可获得中转开胸的概率。
2.5 预测模型的验证
预测模型的ROC曲线下面积为0.838(96%CI:0.761~0.915)(图2A),灵敏度为75.00%,特异度为83.56%,最大约登指数所对应的临界值0.23,即预测概率>23%的患者为中转开胸的高危人群,对应总分为130分;建模队列通过加强Bootstrap法重复抽样1 000次进行内部验证,校准曲线图显示预测的中转开胸风险与实际发生风险高度一致(图3C),Hosmer-Lemeshow拟合优度检验χ2=3.447,P=0.841,提示风险预测模型在预测中转开胸方面具有良好的区分度与一致性。采用139例验证队列数据进行外部验证,ROC曲线下面积为0.800(96%CI:0.709~0.890),灵 敏 度 为71.43%,特 异 度 为80.84%,校准曲线图显示预测的中转开胸风险与实际发生风险一致性较好。提示中转开胸预测模型在外推过程中表现较好的预测效能。见图2B和图3D。DCA显示预测模型的阈概率为0.1~0.95(见图4),模型表现为正的净收益。图中两条曲线代表两种极端情况,标“无”的横线表示所有患者均为胸腔镜肺叶切除,且不进行干预,净收益为0,标“全部”的斜线表示所有患者均中转开胸,并实施干预所获得的净收益。红色的曲线是采用列线图预测模型将患者分为中转开胸组与胸腔镜组所获得的临床收益。
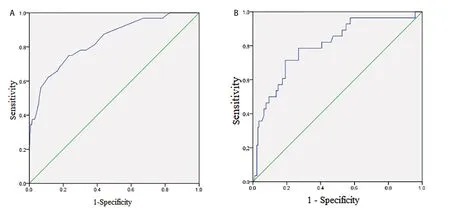
图2 列线图模型的ROC曲线Figure 2.ROC Curve of the Nomogram Model
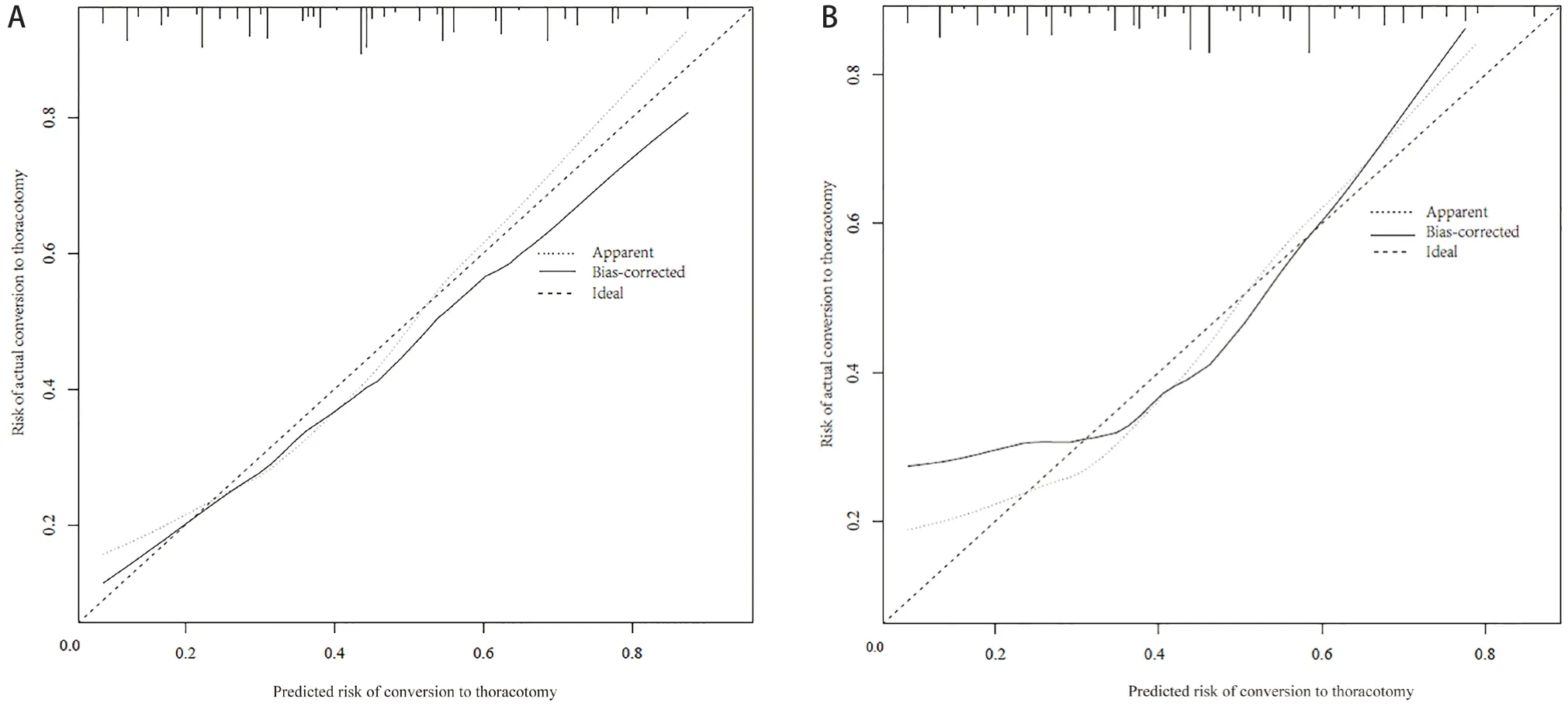
图3 列线图的Calibration校准曲线Figure 3.Calibration Curve of the Nomogram
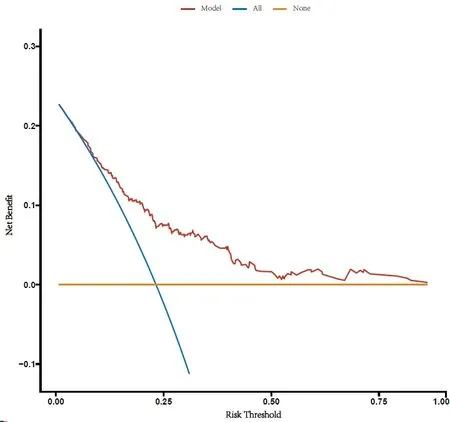
图4 中转开胸预测模型的决策分析曲线Figure 4.Decision Analysis Curve of the Prediction Model for Conversion to Thoracotomy
3 讨 论
3.1 构建的胸腔镜下肺叶切除术NSCLC患者中转开胸风险预测模型具有科学性、直观性与实用性
本研究结果显示,胸腔镜下肺叶切除术的NSCLC患者中转开胸发生率为9.57%,与Bongiolatti等[8]报道的9.3%接近,低于Chen等[12]报道的16.5%。胸腔镜下肺叶切除术中转开胸不仅增加术后并发症,还导致围术期死亡风险升高,因此构建胸腔镜下肺叶切除术中转开胸的预测模型进行早期识别并确定好应对策略,如直接转为开胸手术或者提前做好中转开胸的各项准备。本研究中转开胸的原因分析显示,淋巴结与周围组织粘连、血管损伤是中转开胸的主要原因,与Byun等[13]报道的中转开胸原因一致。本研究经Logistic回归筛选出肺结核病史、肺门淋巴结增大、胸膜粘连、肿瘤位置4个指标,建立可视化的列线图预测模型,模型在建模队列与验证队列的预测风险能力分别为0.838和0.800,校准曲线中预测风险与实际发生风险接近。表明该模型预测中转开胸具有足够的判别能力和临床效能。ROC显示最大约登指数所对应的临界值0.23,即预测概率>23%(对应总分>130分)的患者为中转开胸的高危人群。为进一步评价模型对临床实践的改进效果,因此采用DCA分析临床实用性。DCA显示预测模型的阈概率为0.1~0.95,模型表现为正的净收益。该评价方法不需要了解临床干预支出和NSCLC患者的主观意向,便能够综合比较模型筛查后对高危患者(总分>130)干预的临床效益与全部患者进行干预或不干预的临床效益。既往研究虽然通过Logistic回归分析建立了预测模型[14],但并没有使用可视化的图形呈现,临床应用时需要进行较为复杂的数学计算。本研究基于上述4个指标建立的中转开胸预测模型并以列线图的形式可视化呈现,为临床医护人员提供了术前评估NSCLC患者胸腔镜下肺叶切除术中中转开胸风险的简便实用方法,且用于建立模型的4个指标均为术前通过分析患者的人口学资料及CT检查获得,数据易于获取且不增加经济费用,患者依从性较高。
3.2 胸腔镜下肺叶切除术NSCLC患者中转开胸的危险因素分析
肺结核病史。本研究表明,肺结核病史是中转开胸的独立预测变量,列线图显示。肺结核患者由于长期炎性物质刺激,往往引发结核性胸膜炎,大量炎症细胞浸润,纤维蛋白渗出,导致脏层胸膜和壁层胸膜粘连[15]。胸腔镜操作时由于胸膜解剖结构异常,增加手术时间及出血风险。肺结核患者由于长期处于慢性炎症状态,淋巴结增大、钙化,影响术中淋巴结清扫。同时,肺结核长期的炎症刺激,可对周围血管产生侵害,导致血管增生、变形,肺叶切除术中血管分离困难,极易导致出血。此外肺结核多发于双肺上叶,切除时更易受到淋巴结钙化、胸膜粘连的影响[16]。因此肺结核病史导致NSCLC患者中转开胸风险升高。国外研究虽然报道胸膜粘连可以预测中转开胸[17],但鲜见报道肺结核病史与胸腔镜肺叶切除术中转开胸的相关性。原因可能在于我国肺结核发病率相对较高,而病程进展隐匿,且受经济水平、教育程度等的影响,患者患病未及时进行治疗[18],导致淋巴结体积增大,与周围组织粘连严重,术中操作难度增加。
肺门淋巴结增大。肺门淋巴结钙化、增大密切与胸腔镜下肺叶切除术中转开胸相关,Bongiolatti等[8]进行的大型多中心的多变量分析清楚显示了淋巴结阳性与NSCLC患者胸腔镜下肺叶切除术中转开胸强烈相关,主要是淋巴结增大累及肺门和/或纵隔淋巴结所致。Fiorelli等[19]研究指出,胸腔镜下肺叶切除术患者中转开胸患者有23%是由于淋巴结阳性钙化所致,基于钙化位置和钙化程度的评分可对胸腔镜下肺叶切术中转开胸良好预测。本研究结果也显示,肺门淋巴结增大可独立预测中转开胸,列线图显示该变量增加100分的影响权重,与上述研究具有一致性。原因可能在于淋巴结一般位于血管与支气管周围,当周围炎症、结核粘连或肿瘤转移导致淋巴结增大时会影响局部解剖结构的清晰度,使胸腔镜下处理血管和支气管难度增加,血管损伤的风险升高[20]。肺门淋巴结增大还可能与肺结核、尘肺等相关,从而导致术中肺血管损伤风险较高[21]。提示淋巴结增大引起手术操作难度增加,使中转开胸风险升高,尤其应重视肺门淋巴结增大患者。
胸膜粘连。本研究结果表明,胸膜粘连是中转开胸的独立预测因素,列线图显示该变量增加59分的影响权重。既往数据显示[22],因胸膜粘连所致的中转开胸占比在8%~20%之间。胸膜的慢性炎症反应是导致胸膜粘连的主要原因,多数由肺结核引起。当胸膜粘连致密,范围较大时,胸腔镜下操作受限,可能会因粘连分离困难或胸膜及其组织下渗血明显,为确保手术安全而转为开胸手术。但李海等[23]研究指出,胸膜粘连≥4级是镜下操作中转开腹的危险因素。因此,筛选出胸膜大范围的致密粘连患者用于中转开胸的临床预测可能更有价值。随着经验的增加,胸腔镜下可以完成肺叶切除手术的比例更高,而胸膜粘连所致的中转开胸率随之下降[24]。苏鹏等[25]报道指出,胸腔镜手术的不断成熟与经验积累,使胸膜粘连不再是胸腔镜肺叶切除术的禁忌症。提示,随着学习曲线延长,胸腔镜下肺叶切除术技能的升高,可逐步缩小禁忌症范围。
肿瘤位置。本研究表明,肿瘤位于肺上叶独立预测中转开胸,列线图显示其增加51分的影响权重。原因可能在于左肺上叶动脉分支较多,且分支动脉前方有气管遮挡,镜下操作时需要先切断气管再离断动脉,若气管后方与动脉粘连,过度提拉肺部可导致动脉大量出血。而右肺上叶肺动脉第一支在所有肺动脉分支中距肺门最近,且血管粗,暴露时间短,手术操作易对其造成损伤[26]。此外,血管壁较其他部位薄而脆,易受纵隔、肺门淋巴结增大、粘连的影响,手术中镜下游离操作易对其造成损伤[27]。为进一步降低中转开胸风险,术前仔细阅读患者的CT资料,充分了解肿瘤与周围血管的关系,有助于评估术中中转开胸风险,提高镜下操作水平。
3.3 局限性和展望
本研究属于回顾性研究,病历记录可能存在不完整、错误、缺失等,从而导致资料收集中的信息偏倚。在模型验证方面,本研究虽然将部分患者作为验证队列,但选取患者仍为同一个单位,严格说来仍属于内部验证,后期仍然需要纳入更多外院患者用来外部验证,以证明结果的可靠性及外推性。
综上,本研究基于基于肺结核病史、淋巴结增大位置、胸膜粘连、肿瘤位置等1个术前病史和3个术前CT检查指标确立的NSCLC患者胸腔镜下肺叶切除术中中转开胸的风险预测模型具有良好的预测效能与临床应用价值,通过可视化的列线图模型呈现,有助于医护人员快捷、方便地筛选出中转开胸的高危人群,从而制定针对性的应对方案。
作者声明:本文全部作者对于研究和撰写的论文出现的不端行为承担相应责任;并承诺论文中涉及的原始图片、数据资料等已按照有关规定保存,可接受核查。
学术不端:本文在初审、返修及出版前均通过中国知网(CNKI)科技期刊学术不端文献检测系统的学术不端检测。
同行评议:经同行专家双盲外审,达到刊发要求。
利益冲突:所有作者均声明不存在利益冲突。
文章版权:本文出版前已与全体作者签署了论文授权书等协议。

