夯实基础,理解核心,归纳总结,强化训练
——难溶电解质的Qc 与Ksp计算大盘点
陈斌年
(甘肃省高台县第一中学)
沉淀溶解平衡是近年高考试题中的热点、难点内容.笔者发现,有关沉淀溶解平衡的计算问题一直是学生学习的弱项,而新课标中增加了“理解溶度积(Ksp)的含义,能进行相关的计算”.增加的这部分内容在高考试题中形式多样,内容丰富.笔者结合多年的教学经验,将难溶电解质的Qc与Ksp相关计算进行归类分析,让学生更好地理解沉淀溶解平衡的相关知识,提高解题能力.
1 利用溶度积规则计算、判断溶液混合时是否产生沉淀
例1 已知Ksp(CaCO3)=2.9×10-9,试判断下列情况是否产生沉淀.
(1)4mL 浓度均为0.025 mol·L-1的CaCl2和Na2CO3溶液加入水中配成1L 的溶液,试计算有无CaCO3沉淀生成.
(2)现将浓度均为0.0002 mol·L-1的CaCl2和Na2CO3溶液等体积混合,试通过计算判断有无CaCO3沉淀生成.


变式 常温下,通过计算判断:
(1)已知Ksp(BaSO4)=2.0×10-10,在1L 含SO2-4(浓度为0.002 mol·L-1)的溶液中加入1L 0.002mol·L-1的BaCl2溶液,是否产生BaSO4沉淀?
(2)将等体积的6×10-3mol·L-1的AgNO3溶液和6×10-3mol·L-1的K2CrO4溶液混合,是否能析出Ag2CrO4沉淀? (已知Ksp(Ag2CrO4)=9.0×10-12)
答案 (1)Qc=c(Ba2+)·c(SO2-4)=0.001×0.001=1.0×10-6>Ksp,产生沉淀.
(2)Qc=c2(Ag+)·c(CrO2-4)=(3×10-3)2×3×10-3=2.7×10-8>Ksp,产生沉淀.
2 利用溶度积规则计算、判断溶液混合后某些离子是否完全沉淀
例2 在1L 含SO2-4(浓度为0.002 mol·L-1)的溶液中加入0.02 molBaCl2,能否使SO2-4沉淀完全? 此时溶液中SO2-4的浓度是多少? (已知Ksp(BaSO4)=1.8×10-10)

由此判断SO2-4沉淀完全,沉淀后SO2-4的浓度为1.0×10-8mol·L-1.

本题先利用溶度积规则判断溶液混合产生了沉淀,由于Ba2+过量,再依据2种离子反应方程式计算出剩余Ba2+浓度(0.018 mol·L-1),即沉淀溶解平衡后溶液中Ba2+浓度约为0.018mol·L-1(Ba2+浓度应该等于过量的与溶解平衡溶解出的两部分浓度之和,但由于溶解平衡受到同离子效应的抑制,溶解出的Ba2+相比过量的Ba2+可忽略不计),从而计算出沉淀后SO2-4的浓度为1.0×10-8mol·L-1,故可判断SO2-4沉淀完全.此类题目要求学生要先计算过量离子的浓度,再计算出另外一种离子的浓度,最终判断该离子是否完全沉淀.
变式 向100mL0.018mol·L-1AgNO3溶液中加入100 mL0.02 mol·L-1盐酸,生成沉淀.已知AgCl(s)的溶度积常数Ksp=c(Ag+)×c(Cl-)=1×10-10(混合后溶液的体积变化忽略不计).试计算:
(1)沉淀生成后溶液中Cl-的浓度为多少?
(2)沉淀生成后溶液的pH 为多少?
答案 (1)1×10-3mol·L-1.
(2)2.
3 利用溶度积规则计算某些金属阳离子开始沉淀和完全沉淀时的pH
例3 已知:Ksp[Al(OH)3]=1.0×10-32,Ksp[Fe(OH)3]=3.0×10-38,pH=7.1时Mn(OH)2开始沉淀.室温下,除去MnSO4溶液中的Fe3+、Al3+(使其浓度小于1×10-5mol·L-1),需调节溶液的pH范围为________.

Al3+若沉淀完全,则沉淀以后c(Al3+)≤1.0×10-5mol·L-1,因为Ksp[Al(OH)3]=c(Al3+)·c3(OH-)=1.0×10-32,可得
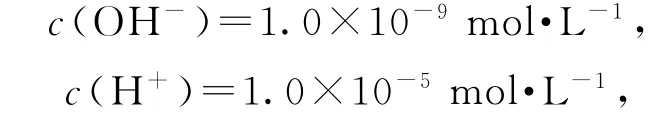
则pH=5.由于Fe(OH)3和Al(OH)3属于同类型的难溶电解质,Ksp[Fe(OH)3]<Ksp[Al(OH)3],当pH 调为5.0 时,Fe3+已先于Al3+完全沉淀,又由于pH=7.1时Mn(OH)2开始沉淀,所以为保证杂质离子(Fe3+、Al3+)完全沉淀而不影响Mn2+,故可将pH范围调为5.0≤pH<7.1.

此类题目是高考中的常见题型,难度适中但试题综合性强,主要考查学生对溶度积常数的熟悉程度,以及灵活运用溶度积常数解决实际问题的能力.明确该类试题的解题方法,有助于培养学生的逻辑推理能力,提高学生的应试能力和答题效率.
变式 在除杂实验中,甲同学不确定调整溶液pH=3.9时能否达到除去Fe3+而不损失Cu2+的目的,乙同学认为可以通过计算确定.查阅有关资料得到如下数据,常温下Ksp[Fe(OH)3]=1.25×10-39,Ksp[Cu(OH)2]=2.9×10-20,通常认为残留在溶液中的离子浓度小于1×10-5mol·L-1时沉淀完全.设溶 液 中CuSO4的 浓 度 为2.9 mol·L-1,计 算Cu(OH)2开始沉淀时溶液的pH 为________.Fe3+完全沉淀时溶液的pH 为_________.通过计算确定除杂实验________(填“可行”或“不可行”),原因 是_________.(提示:lg5=0.7)
答案 4;2.7;可行;铁离子沉淀完全时铜离子还没有开始沉淀.
4 利用溶度积规则计算离子沉淀的先后顺序


本题主要考查溶度积的计算.同类型难溶电解质的溶解度大小以及哪种粒子先产生沉淀,可以通过Ksp的大小直接比较,不同类型时必须通过计算进行比较才能得出结果.
变式 已知:Ksp(CuS)=8.8×10-35,
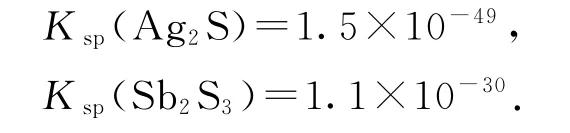
某溶 液 中 含 有Ag+、Cu2+和Sb3+,浓 度 均 为0.010mol·L-1,向该溶液中逐滴加入0.010mol·L-1的Na2S 溶液时,3 种阳离子产生沉淀的先后顺序为________.
答案 Cu2+、Ag+、Sb3+.
5 溶度积与溶解度、物质的量浓度之间的换算
例5 已知:某温度时,
Ksp(AgCl)=1.80×10-10,
Ksp(Ag2CrO4)=1.10×10-12.
试求:(1)此温度下AgCl饱和溶液和Ag2CrO4饱和溶液的物质的量浓度,并比较两者的大小.
(2)此温度下,在0.010mol·L-1的AgNO3溶液中,AgCl与Ag2CrO4分别能达到的最大物质的量浓度,并比较两者的大小.

则有Ksp(AgCl)=(0.010+x)·x=1.80×10-10,因为x很小,所以0.010+x≈0.010,解得x=1.80×10-8mol·L-1,即c(AgCl)=1.80×10-8mol·L-1.
同理可设沉淀溶解平衡时,CrO2-4的浓度为y,根据反应


本题重点理解两点:一是不能只通过Ksp来比较难溶电解质的溶解度大小,要看电解质是不是同一类型;二是同离子效应对不同类型难溶电解质的影响是不相同的.
变式 Mg(OH)2难溶于水,但它溶解的部分全部电离.室温下时,饱和Mg(OH)2溶液的pH=11,若不考虑Kw的变化,则该温度下Mg(OH)2的溶解度为________(溶液密度为1.0g·cm-3).
答案 0.0029g.
6 利用溶度积规则解决难溶电解质溶解平衡的图像问题
例6 绚丽多彩的无机颜料的应用曾创造了古代绘画和彩陶的辉煌.硫化镉(CdS)是一种难溶于水的黄色颜料,其在水中的沉淀溶解平衡曲线如图1所示.下列说法错误的是( ).
A.图中a和b分别为T1、T2温度下CdS在水中的物质的量浓度
B.图中各点对应的Ksp的关系为Ksp(m)=Ksp(n)<Ksp(p)<Ksp(q)
C.向m点的溶液中加入少量Na2S固体,溶液组成由m沿mpn线向p方向移动
D.温度降低时,q点的饱和溶液的组成由q沿qp线向p方向移动

本题意在考查考生分析图形的能力和实际运用知识解决问题的能力.CdS在水中存在沉淀溶解平衡:CdS(s)⇌Cd2+(aq)+S2-(aq),其Ksp=c(Cd2+)·c(S2-).在饱和溶液中,c(Cd2+)=c(S2-).结合图像可以看出,图中a和b分别表示T1和T2温度下CdS 的物质的量浓度,选项A 说法正确.CdS 沉淀溶解平衡中的溶度积受温度影响,m、n和p点均是在温度为T1条件下所测的对应离子浓度,其溶度积相同,选项B说法错误.m点达到沉淀溶解平衡,向其中加入Na2S 后,平衡向逆反应方向移动,c(Cd2+)减小,c(S2-)增大,溶液组成由m沿mnp向p方向移动,选项C说法正确.从图像中可以看出,随着温度的升高,离子浓度增大,说明CdS(s)⇌Cd2+(aq)+S2-(aq)为吸热反应,则温度降低时,q点对应饱和溶液的溶解度下降,溶液中的c(Cd2+)与c(S2-)同时减小,会沿qp线向p点方向移动,选项D说法正确.答案选B.

本题考查沉淀溶解平衡曲线及相关计算问题,题目难度中等.解题时要注意理解难溶电解质在水中的沉淀溶解平衡特点,正确理解和掌握溶度积Ksp的概念.
变式 已知溶解度也可用物质的量浓度表示,25 ℃时,Ag2CrO4在不同浓度CrO2-4溶液中的溶解度如图2所示.又知Ksp(AgCl)=1.80×10-10.下列说法正确的是( ).

图2
A.图中a、b两点的c(Ag+)相同
B.该温度下,Ag2CrO4溶度积常数的数量级为10-12
C.加热蒸发饱和Ag2CrO4溶液再恢复到25 ℃,可使溶液由a点变到b点
D.将0.01 mol·L-1AgNO3溶液滴入20 mL 0.01mol·L-1KCl和0.01mol·L-1K2CrO4的混合溶液中,CrO2-4先沉淀
答案 B.
与难溶电解质溶解平衡有关的计算题是化学平衡理论知识的延伸和应用,该类试题形式多样,对学生的能力要求较高,而计算题又恰恰是学生最头疼、最害怕的题型,具有耗时长、易出错、难得分的特点,因此学生一定要夯实基础,理解核心知识,注重归纳总结,强化训练,熟练掌握各种计算题型.
——饱和溶液与不饱和溶液

