钨酸钠浓度对球等鞭金藻和棕鞭藻生长、总脂含量和脂肪酸组成的影响
梁英,曹春晖,范丽敏,田传远
(1.中国海洋大学海水养殖教育部重点实验室,山东 青岛 266003;2.天津科技大学海洋资源化学与食品技术教育部重点实验室,天津 300450)
全球对清洁能源的需求不断增长,生物质能源受到越来越多的关注。球等鞭金藻(Isochrysisg albana)H24 是常见的富油微藻,富含饱和脂肪酸(SFA,Saturated Fatty Acids)和单不饱和脂肪酸(MUFA),有利于制备生物柴油[1,2]。球等鞭金藻富含的二十碳五烯酸(EPA)和二十二碳六烯酸(DHA)等n-3多不饱和脂肪酸(PUFA)成分具有诸多生理功能,被认为对心脑血管疾病和神经突触形成等起重要作用[3,4]。近年来范丽敏[5]和梁英等[6]报道了棕鞭藻(Ochrosphaero neopolitana)H32 的脂肪酸组成。
叶绿素荧光参数能准确反映植物对光能的利用和光系统II(PSII)的状况。营养盐胁迫可以提高微藻的油脂含量,氮限制是其中有效的方法。氮缺乏导致光合作用产生的代谢通量在胁迫条件下转化为脂类生物合成,脂肪酸组成发生改变是微藻应对胁迫的一种机制[7-17]。微拟球藻(Nannochloropsissp.)的脂含量在氮饥饿条件下由39.1%升至68.5%[8]。富油新绿藻(Neochloris oleoabundans)在氮限制条件下脂肪酸含量由氮充足时的53.2 mg/L 增加至91.2 mg/L,同时单不饱和脂肪酸(MUFA)的含量达到最大值[11]。然而,直接限氮会影响细胞的正常生长,生物量降低。Na2WO4毒性低,对环境和生物体没有危害,是农业上常用的硝酸还原酶抑制剂,可导致氮限制。沈雄等[18]发现,钨酸钠限氮和直接限氮对微拟球藻的脂肪酸组成的影响结果一致。本文通过研究2 株海洋金藻在不同浓度Na2WO4培养基中生物量和脂质积累的变化,探索进一步提高微藻油脂含量的方法。
1 材料与方法
1.1 材料
球等鞭金藻(Isochrysisg albana)MACC/H24 和棕鞭藻(Ochrosphaero neopolitana)MACC/H32 实验在1 000 mL 三角烧瓶中进行。
1.2 方法
将指数生长期的藻种接种到2f 培养基中,终体积为850 mL(0 mmol/L、0.5 mmol/L、1.5 mmol/L、2.5 mmol/L、5.0 mmol/L),每个处理设3 个重复,培养过程中光强为100 μmol·m-2s-1,连续光照、充气,温度25℃,盐度31,Na2WO4胁迫培养时间为5 d。
采用血球计数板法测定细胞密度,根据戴荣继等[19]方法测定叶绿素含量。用Water-PAM 叶绿素荧光仪(Walz 公司生产)测定叶绿素荧光参数[20]。Fm:最大荧光;Fv:可变荧光;Fv/Fm:PSII 最大光化学效率(量子产量);rETR:电子传递速率;qP:光化学淬灭。取指数生长末期的样品,经离心和冻干后,按改进的Bligh-Dyer 法测定总脂含量[21]。
将收获的微藻冷冻干燥后,按Lepage 和Roy[22]的方法进行甲酯化,用1 mL 正己烷萃取分层后,取最上层黄色液体即脂肪酸甲酯供脂肪酸分析。采用美国Agilent6890N 气相色谱仪、5973 型质谱仪测定脂肪酸含量,其中氢火焰离子化检测器(FID)和HP-5 弹性石英毛细管色谱柱。程序升温,进样口温度为250℃,进样1 μL,FID 检测器温度为300℃,载气为高纯氦气,流速为1.2 mL/min。质谱条件为EI 离子源,离子源温度为230℃,接口温度为280℃,质量扫描范围m/z 50~600 u,扫描周期2.69次/s,电离能量为70 eV。以面积归一划法得到各脂肪酸组分的相对百分含量。
1.3 统计分析
应用Sigmaplot12.0 软件作图,应用SPSS16.0 软件进行单因子方差分析(ANOVA)和SNK 多重比较分析,P<0.05 表示差异显著。
2 结果与分析
2.1 Na2WO4 浓度对球等鞭金藻H24 的生长、总脂含量和脂肪酸组成的影响
不同Na2WO4浓度的限氮处理显著影响球等鞭金藻的叶绿素荧光参数值(P<0.05)(图1)。在整个钨酸钠胁迫培养周期中(5 d),各浓度组的Fv/Fm 值均呈上升趋势,其中空白对照组的Fv/Fm 显著低于其他处理组(P<0.05)。培养第4 d 时2.5 mmol/L和第5 d 时5 mmol/L Na2WO4组的Fv/Fm 值最高(P<0.05)。rETR 和qP 值先上升后平稳,各组间不存在显著差异。

图1 Na2WO4 浓度对球等鞭金藻叶绿素荧光参数的影响Fig.1 Chlorophyll fluorescence parameters of Isochrysis galbana H24 exposed to different concentrations of Na2WO4
Na2WO4浓度显著影响球等鞭金藻的细胞密度、叶绿素含量和总脂含量(P<0.05),各组间差异显著(表1)。空白对照组的最终细胞密度和叶绿素含量最大,叶绿素含量随Na2WO4浓度的升高而下降。在0~5 mmol/L 之间球等鞭金藻的总脂含量随Na2WO4浓度的增加而明显增加(23.09%~31.91%)。
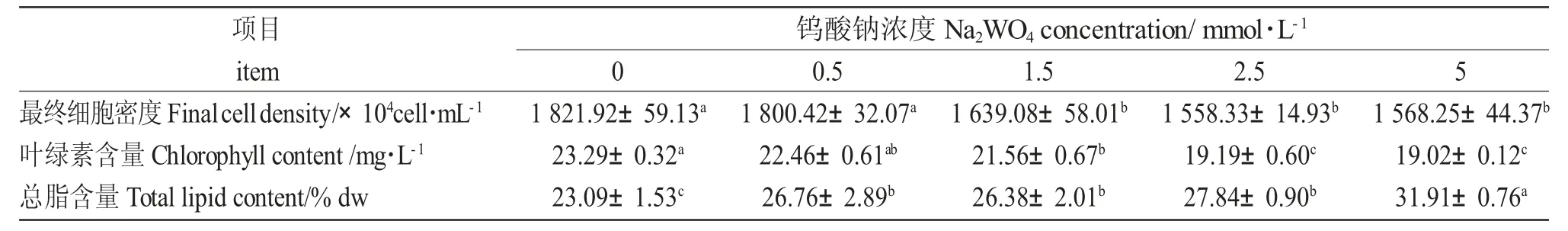
表1 不同Na2WO4 浓度下球等鞭金藻的最终细胞密度、叶绿素和总脂含量Tab.1 The final cell density,chlorophyll content,and total lipid content of Isochrysis galbana H24 exposed to different concentrations of Na2WO4
Na2WO4浓度显著影响球等鞭金藻的18∶1(n-9)、SFA、MUFA 和PUFA 含量(P<0.05)(表2)。球等鞭金藻的14∶0、16∶0、18∶1(n-9)和DHA 含量高,其中18∶1(n-9)含量随Na2WO4浓度升高呈明显的先下降后上升趋势,5.0 mmol/L 浓度组最大(34.54%);SFA 和MUFA 含量随Na2WO4浓度升高而增加,均在5.0 mmol/L 时达到最大值(分别为37.59%和42.65%)。随着Na2WO4浓度由0 mmol/L上升至5 mmol/L,PUFA 含量由19.42%增加至36.23%。添加Na2WO4对球等鞭金藻其他脂肪酸含量没有影响。
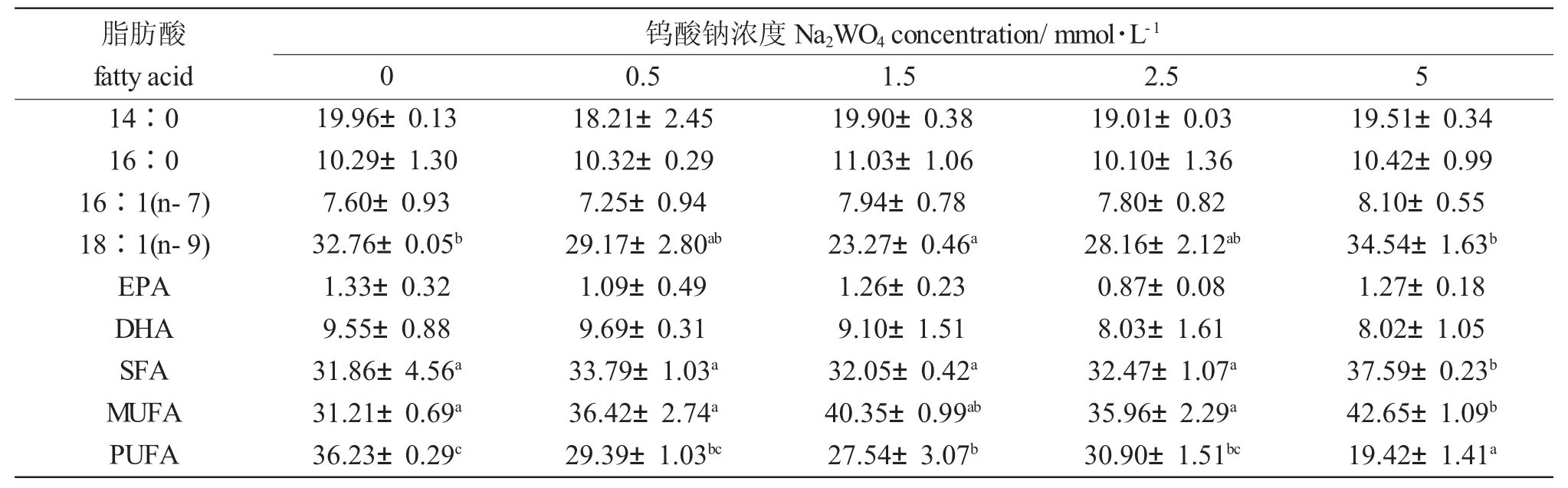
表2 不同Na2WO4 浓度下球等鞭金藻的脂肪酸组成(占总脂肪酸的百分比)Tab.2 The main fatty acid compositions(% of total fatty acids)of Isochrysis galbana H24 exposed to different concentrations of Na2WO4
2.2 Na2WO4 浓度对棕鞭藻H32 生长、总脂含量和脂肪酸组成的影响
不同Na2WO4浓度的限氮处理显著影响棕鞭藻H32 的Fv/Fm、rETR 和qP 值(P<0.05)(图2)。在整个胁迫培养周期中(5 d),各处理组的Fv/Fm、rETR和qP 均呈下降趋势,其中5.0 mmol/L Na2WO4浓度组各参数值下降幅度最大,显著低于其他处理组。第1 d,2.5 mmol/L Na2WO4处理组的Fv/Fm 值最高,第2 d,空白对照组的Fv/Fm 显著高于其他各处理组,表明胁迫初期低Na2WO4浓度下棕鞭藻Fv/Fm 值较高。胁迫后期低Na2WO4浓度组(1.5 mmol/L)的rETR 和qP 显著高于其他处理组(第4~5 d)(P<0.05)。

图2 Na2WO4 对棕鞭藻叶绿素荧光参数的影响Fig.2 Chlorophyll fluorescence parameters of Ochromonas neopolitana H32 exposed to different concentrations of Na2WO4
Na2WO4浓度显著影响棕鞭藻H32 的细胞密度、叶绿素含量和总脂含量(表3),各处理组之间差异显著(P<0.0 5)。空白对照组和低Na2WO4处理组(0.5 mmol/L)的最终细胞密度最大。5.0 mmol/L Na2WO4组的H32 叶绿素含量最高,但与0~1.5 mmol/L 钨酸钠处理组间差异不显著(P>0.05)。H32的总脂含量在0~5.0 mmol/L 间随Na2WO4浓度的增加而增加(20.40%~25.55%)。

表3 不同Na2WO4 浓度下棕鞭藻的最终细胞密度、叶绿素含量和总脂含量Tab.3 The final cell density,chlorophyll content,and total lipid content of Ochromonas neopolitana H32 exposed to different concentrations of Na2WO4
除DHA 外,Na2WO4浓度显著影响H32 的其他主要脂肪酸含量(P<0.05)(表4)。棕鞭藻H32 有着较高含量的EPA、DHA、18∶1(n-9)和SFA,其中1.5 mmol/L Na2WO4组的14:0 含量最高(17.80%),5.0 mmol/L 组的16∶0、16∶1(n-7)和SFA 含量最高(分别为14.69%、8.90%和32.15%)。18∶1(n-9)和MUFA 含量呈现先下降后上升趋势,空白对照组中为最大值(分别为37.33%和44.98%)。H32 的EPA和PUFA 含量在0~2.5 mmol/L 间随Na2WO4浓度的增加而增加,0 mmol/L 时分别为4.15%和25.15%,至2.5 mmol/L 时上升到最大值(分别为10.72%和31.96%),之后则呈下降趋势。

表4 不同Na2WO4 浓度下棕鞭藻的脂肪酸组成(占总脂肪酸的百分比)Tab.4 The main fatty acid compositions(% of total fatty acids)of Ochromonas neopolitana H32 exposed to different concentrations of Na2WO4
3 讨论
钨酸钠可以降低硝酸还原酶的活性,表现为氮限制[23]。氮限制会使光合作用机构的损伤和细胞生长滞后[24]。Song 等[25]就报道了氮缺乏的球等鞭金藻细胞数量、叶绿素含量和叶绿素荧光参数Fv/Fm、φPSII 和rETR 均显著下降。Young 和Beardall[26]也发现,盐藻(Dunaliella tertiolecta)的Fv/Fm 在缺氮介质中显著下降。在本研究中,2 株海洋的细胞密度和叶绿素含量均在Na2WO4培养基中明显下降,与以上研究结果一致。但2 株金藻的叶绿素荧光参数对Na2WO4胁迫的反应不同,其中棕鞭藻在高浓度Na2WO4中Fv/Fm 显著降低,与以上研究结果一致;球等鞭金藻则在中、高浓度Na2WO4中Fv/Fm 升高,与Song 等[25]的结果并不一致。
缺氮能促进微藻生成脂质,细胞此时代谢失衡,生长受到抑制,剩余能量以脂类形式储存[15,27],同时伴随着脂质代谢相关酶活性(如ACCase)的变化,以及大多数控制脂肪酸合成的相关基因表达的改变[28]。Lacour 等[9]报道了一株等鞭金藻(Isochrysis sp.)在氮饥饿条件下中性脂含量提高了45%。缺氮还可以显著增加线粒体交替氧化酶(AOX)途径的活性和脂肪酸的积累,使球等鞭金藻的脂肪酸生产率提高23%[16]。Livne 和Sukenik[29]也报道了球等鞭金藻在氮饥饿下的脂质积累现象。类似的结果还见于微拟球藻(Nannochloropsis sp.)[8,30]、巴夫杜氏藻(Dunaliella parva)[17]以及富油新绿藻[11]等。本试验结果与上述报道一致,球等鞭金藻和棕鞭藻的总脂含量在Na2WO4限氮胁迫条件下显著增加,5.0 mmol/L Na2WO4时总脂含量达最大值,分别比空白对照组提高了38.21%和25.24%。然而由氮饥饿产生的脂质贮存也具有很强的物种或品系特异性[31]。
氮浓度能够影响植物去饱和酶基因的表达,影响脂肪酸组成。氮饥饿对脂肪酸组成的影响甚至大于对脂肪酸含量的影响[32,33]。Huerlimann 等[33]报道,在缺氮条件下大溪地等鞭金藻I.aff.galbana 的C16∶0、C18∶1(n-9)和MUFA 含量显著提高,而PUFA 含量显著下降,DHA 含量不变。Wang 等[14]报道了湛江等鞭金藻(I.zhangjiangensis)在氮限制条件下SFA 和MUFA 含量明显增加,PUFA 含量降低。微拟球藻(Nannochloropsissp.)和扁藻(Tetraselmis suecica)的脂肪酸组成在氮充足和氮饥饿条件下也有显著差异[8]。类似的趋势还见于Benvenuti 等[30]、Griffiths 等[10]和Simionato 等[34]的报道。本实验结果与以上研究一致,2 株金藻均在中-高Na2WO4浓度下14∶0、16∶0 和18∶1(n-9)含量显著升高,SFA 和MUFA 含量增加,PUFA 含量显著下降,DHA含量没有明显变化。
本研究结果表明,在指数生长末期添加Na2WO4限氮可以兼顾生物量和总脂含量[27],并可改善脂肪酸组成。2 株海洋金藻生长和积累脂质的适宜钨酸钠浓度均为5 mmol/L,可建议应用于生产。而2 株金藻含有较高的DHA 成分,也可考虑开发定向培养技术,进一步强化DHA 的生成。

