核素门控心肌灌注显像早期预测乳腺癌化疗后心脏毒性的临床价值
鹿存芝,吴倩,王亚楠,鹿峰,李向阳
(徐州市中心医院,1.核医学科;2.放疗科,江苏 徐州 221009)
乳腺癌发病率居于女性恶性肿瘤的首位,2018年全球乳腺癌新发病例约达210万,在所有女性恶性肿瘤中占比46.3%[1]。近年来,随着综合治疗手段的改进,乳腺癌患者生存预后得到明显改善[2]。蒽环类药物作为临床常用的广谱抗肿瘤药物,不但是乳腺癌术后辅助化疗的基础,而且对乳腺癌的综合治疗至关重要[3]。然而,蒽环类药物具有心脏毒性等限制性,相比其他化疗药物,其心脏毒性风险增大5.43倍,并且心脏毒性严重程度随着化疗剂量累积而加重,心脏的不可逆性损伤和较高的心脏不良事件发生风险较高[4]。因此,对乳腺癌患者化疗期进行心功能的严密监测尤为重要,可为化疗方案的调整和及时针对性干预提供重要指导。
既往临床主要采取血清心肌标志物检测、超声心电图检查等手段来进行化疗心脏毒性的评估,但这些手段的评估效能有限,且可重复性差[5-6]。核素门控心肌灌注显像(gated myocardial perfusion imaging,GMPI)能够利用心肌有无灌注异常表现来直观呈现心肌损害程度,还能获得反映左心室收缩同步性的定量指标,且有着较好的重复性[7]。刘艳等[8]已证实GMPI对甲状腺癌患者治疗后心脏异常改变有诊断价值。但目前关于GMPI在乳腺癌化疗患者心脏毒性中的评估价值仍缺乏科学报道。为此,本研究拟探讨GMPI预测乳腺癌化疗患者心脏毒性临床价值。
1 资料与方法
1.1 一般资料
选取2018年9月至2020年2月徐州市中心医院收治的110例乳腺癌化疗患者作为研究对象,年龄(52.47±7.69)岁。纳入标准:(1)女性患者,确诊为乳腺癌;(2)采用相同化疗方案,即表柔比星+环磷酰胺,进行至少6个周期(以21 d为1个周期)化疗;(3)入组前未接受放化疗治疗;(4)化疗前超声心动图无异常。排除标准:(1)先前存在心脏病史者;(2)合并其他严重基础疾病者;(3)伴其他恶性肿瘤者;(4)无法完成化疗周期者;(5)图像质量差者。另选取同期在本院进行体检的60名女性健康体检者作为对照组,年龄(51.26±6.58)岁,超声心动图检查正常,排除心脏病史、糖尿病、高血压及心血管疾病。
1.2 仪器与方法
患者于化疗前及化疗6个周期后行常规超声心动图检查和GMPI监测。对照组于体检时完成常规超声心动图检查和GMPI监测。
1.2.1 超声心动图检查 采用GE vivid E95超声诊断仪和M5Sc探头(1.7~3.5 MHz),配有EchoPAC脱机软件。检查时,受检者均以左侧卧位进行检查,平静状态下,采用M5Sc心脏探头,得到心尖左心室两腔观切面、心尖四腔心切面等超声图像。利用Simpson双平面法进行心脏指标的测量,包括左室舒张末期容积(left ventricular end-diastolic volume,LVEDV)、收缩末期容积(left ventricular end-systolic volume,LVESV)、左室舒张末期内径(left ventricular end-diastolic diameter,LVEDd)、左室收缩末期内径(left ventricular end-systolic dimension,LVED)、短轴缩短率(fractional shortening,FS)及左心室射血分数(left ventricular ejection fractions,LVEF),均取3次测量结果的平均值。
1.2.2 GMPI检查 仪器选择双探头SPECT/CT仪(T16型,德国Siemens Symbia ),显影剂选择99Tcm-甲氧基异丁基异腈(methoxy isobutyl isonitrile,MIBI),注射剂量设定为740~925 MBq。采集条件:心脏专用准直器,矩阵设定为128×128,能峰为140 keV,窗宽为20%,两探头之间呈90 °,放大倍数为1.45,各旋转角度为90 °,6 °/帧,每帧进行35 s的采集。利用迭代法进行重建,得到心脏短轴、垂直长轴和水平长轴的图像。对静息重建后的图像,采用Gedars定量关注SPECT软件分析,获得静息灌注总积分(summed rest score,SRS);对重建后的GMPI断层图像,采用Gedars定量门控SPECT分析,获得LVEF、LVEDV、LVESV、高峰充盈率(peak filling rate,PFR)、室壁增厚异常积分(ventricular wall thickening score,STS)、室壁运动异常积分(total integral ventricular wall motion score,SMS)以及左心室收缩同步性相关参数 [相位直方图宽带(band width,BW)、相位标准差(standard deviation,SD)、熵],BW、SD、熵的数值越小,说明左心室有着越好的收缩同步性。
1.3 化疗后心脏毒性的判定
对患者进行1年的随访,随访方式为电话或门诊复查,每6个月评估1次心功能。蒽环类抗肿瘤药物导致心脏毒性诊断参照《蒽环类药物心脏毒性防治指南(2013年版)》[9]中相关标准:LVEF与基线相比下降至少5%到绝对值<55%,同时伴随有充血性心力衰竭症状;或者LVEF与基线相比下降至少10%到绝对值<55%,但无充血性心力衰竭症状。
1.4 统计学分析
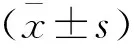
2 结果
2.1 常规超声心动图参数的比较
与对照组相比,乳腺癌组化疗前后常规超声心动图参数比较,差异无统计学意义(P>0.05)。见表1。

表1 乳腺癌组化疗前后常规超声心动图参数与对照组的比较
2.2 GMPI参数的比较
乳腺癌组化疗前GMPI参数与对照组相比,差异无统计学意义(P>0.05)。乳腺癌组化疗后BW、SD和熵高于化疗前和对照组(P<0.05),PFR、SRS、SMS、STS等参数与化疗前和对照组比较,差异无统计学意义(P>0.05)。见表2。
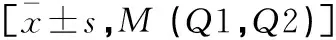
表2 乳腺癌组化疗前后GMPI参数与对照组的比较
2.3 GMPI参数的ROC曲线分析
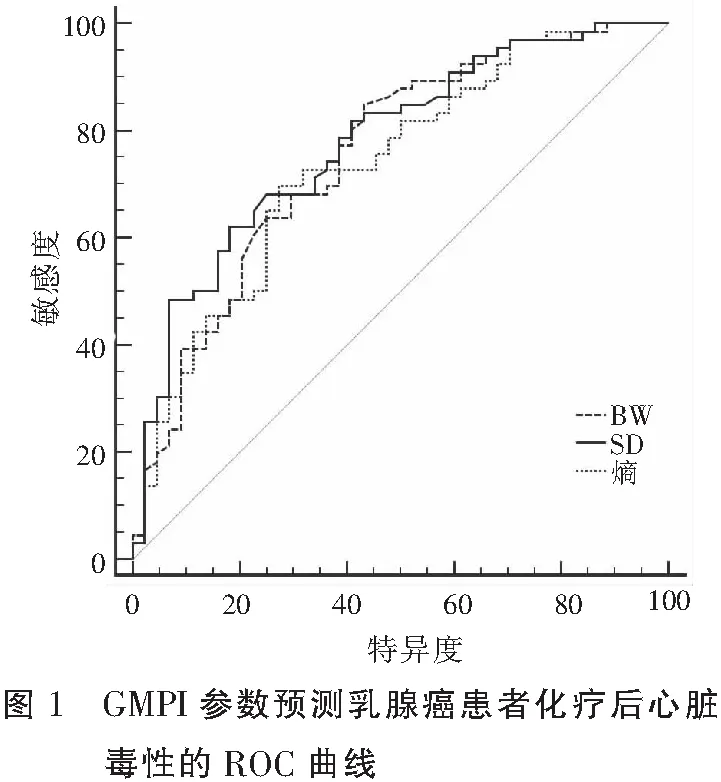
110例乳腺癌患者中,随访1年共32例患者出现心脏毒性,发生率为29.1%。以随访1年有无心脏毒性发生(0=未发生,1=发生)构建GMPI参数(化疗后3个月)预测乳腺癌患者化疗后心脏毒性的ROC曲线。结果显示,BW预测的ROC曲线下面积(aAUC)为0.755,敏感度、特异度分别为84.4%、57.7%;SD的AUC值为0.778,敏感度和特异度分别为62.5%、82.1%;熵的AUC为0.737,敏感度和特异度分别为69.8%、73.1%。见表3及图1。

表3 GMPI参数预测乳腺癌患者化疗后心脏毒性的ROC曲线分析结果
3 讨论
目前关于蒽环类化疗药物诱发心脏毒性的病理机制最为认可的是氧化应激学说,蒽环类药物在体内能够产生超氧离子,引起心脏抗氧化功能失衡,进而造成心功能不全[10]。蒽环类化疗药物所致的心脏毒性随着化疗药物剂量的累积而加重,心脏不可逆性损伤也随之加重,因此对于乳腺癌患者应用蒽环类化疗药物治疗进程中,加强心功能监测尤为重要[11-12]。
以往临床对于化疗所致心脏损害的评估,主要采用超声心脏参数LVEF,但LVEF对心功能变化的敏感度较差,单纯通过LVEF变化难以准确反映化疗引起的心脏损伤[13]。前期研究[14]发现,心脏损害早期,患者出现的心肌损害属于亚临床状态,此时心肌损伤标志物、左心室功能等常规指标均不会有阳性改变,当损伤加重、心脏整体功能降低时,才会引起左心室功能相关指标的异常变化。本研究显示,乳腺癌患者化疗后常规超声心动图指标LVEDd、LVED、LVEF等相比化疗前均无明显改变,进一步说明常规超声指标难以反映心功能损害早期的亚临床状态。
既往文献[15]报道,恶性肿瘤患儿在采用蒽环类化疗后,虽然左心功能正常,但左心室收缩不同步已经发生,这在一定程度上意味着左心室收缩不同步或许能够反映蒽环类化疗药物导致心脏损害。还有研究[16]表明,乳腺癌术后患者在应用蒽环类抗肿瘤药物进行化疗的早期,左心室收缩功能尚处于正常时,其左心室部分节段的心肌便产生了收缩不同步的现象。而心室收缩同步性作为与心室功能密切相关的因素,心室机械运动的协调性异常可导致心肌整体收缩力降低,进而导致心功能降低[17],因此,或许可通过评估左心室收缩同步性来评价化疗后心脏毒性损害的发生。GMPI作为冠心病诊断重要无创影像学方法,不但能够实现左心室舒张、收缩功能的定量评估,其相位分析技术还能进行左心室收缩协调性的评估,并且可重复性好[18];罗诗雨等[19]研究结果表明,在冠心病相关心血管不良事件的预测上,GMPI有重要应用价值;刘艳等[8]发现,GMPI技术可用于预测老年甲状腺癌患者行促甲状腺激素(thyroid stimulating hormone,TSH)抑制治疗后的心功能异常。但目前鲜有将GMPI应用于肿瘤化疗后心脏毒性评估的报道。本研究将GMPI应用于乳腺癌患者化疗前后心功能变化的评估,结果显示,相比化疗前,化疗后LVEF无明显改变,而BW、SD和熵则显著增大,即左心室收缩同步性变差,与既往报道[19]相符。由此进一步说明对于化疗导致心脏毒性的评估,左心室收缩不同步相比LVEF更优。分析其原因可能为:在初期,蒽环类药物主要是诱发局灶性心肌损伤,降低受累部位心肌运动幅度,而对其他部位的正常心肌运动基本无影响,进而出现左心室收缩不同步的状况,而该时期左心室整体收缩功能尚未发生异常[20]。
本研究进一步应用ROC曲线评价GMPI参数对乳腺癌化疗后心脏毒性的预测价值,结果显示,BW、SD、熵预测的AUC值分别为0.755、0.778、0.737,均>0.7,表明GMPI检测对乳腺癌化疗患者心脏毒性的早期预测有较高价值。
综上,GMPI相位分析获得的反映左心室收缩不同步的定量指标(BW、SD、熵)可用于乳腺癌化疗后心脏毒性的评估,有助于早期预测心脏毒性风险,可为及时进行治疗方案的调整和心脏损害的早防治提供重要参考。

