胎盘脐带和绒毛来源的间充质干细胞改善大鼠肝纤维化
郝广曙,周庆云,潘志凤,鲁平,赵洁
(甘肃省妇幼保健院病理科,甘肃 兰州 730050)
肝纤维化是由各种致病因子所导致的肝脏内结缔组织异常增生的病理生理性过程[1-2]。间充质干细胞(mesenchymal stem cells,MSCs)来源于中胚层,具有多向分化和自我更新潜能的成体干细胞[3-5],具有免疫原性低、免疫调节及抗炎等作用[6-8],广泛存在于骨髓、脂肪、胎盘、脐带等组织和器官中。与骨髓来源的间充质干细胞具有相似生物学特性的人脐带和胎盘绒毛来源的间充质干细胞(UC-MSCs和 hPMSCs)具有丰富来源、获取容易、低免疫原性、无伦理安全问题等优点,应用价值较高[9]。MSCs对肝纤维化和肝硬化动物模型具有有效的治疗作用,孙慧聪等[10]研究报道,UC-MSCs和hPMSCs移植可减弱大鼠肝纤维化程度;高琳琳等[11]则指出,脐带和脂肪来源的间充质干细胞能够改善大鼠肝硬化。本研究拟探讨UC-MSCs和hPMSCs治疗四氯化碳(carbon tetrachloride,CCL4)诱发的肝纤维化鼠模型的疗效。
1 材料与方法
1.1 材料
UC-MSCs和hPMSCs均取自课题组已建立的细胞库[12],选取冻存的第二代细胞,快速复温后传代培养至细胞呈现稳定状态。
1.2 方法
1.2.1 构建大鼠模型 6 周龄SPF(specific pathogen free,SPF)级健康雄性SD(Sprague Dawley,SD)大鼠,体重180 ~ 200 g,由具有标准饲养条件的浙江省医学科学院实验动物中心提供,饲养过程遵循GB/T 35892-2018实验动物福利伦理审查指南[13]。将50% CCl4橄榄油溶液,按照5 mL/kg皮下注射,每周两次,持续8周[1]。
1.2.2 实验分组 48只大鼠随机分为4组。正常组:造模时注射生理盐水;UC-MSCs移植组:模型构建完成后通过尾静脉注射生理盐水制备的3~6代UC-MSCs悬浮液1 mL,每只大鼠注射2.0×106个细胞;hPMSCs移植组:模型构建完成后通过尾静脉注射生理盐水制备的3~6代hPMSCs悬浮液 1 mL,每只大鼠注射2.0×106个细胞;肝纤维化模型组:模型构建完成后尾静脉注射生理盐水1 mL/只。每组各12只大鼠[1]。
1.2.3 肝功能检测 移植细胞12周后处死大鼠,收集血清,取肝脏。用全自动生化分析仪(Abbott)检测白蛋白(ALB)、丙氨酸氨基转移酶(ALT)、碱性磷酸酶(ALP)、天冬氨酸氨基转移酶(AST)的浓度。
1.2.4 肝脏病理组织学检测 大鼠肝脏组织,经过4%中性缓冲甲醛固定过夜,按照常规病理组织处理流程处理,进行苏木精/伊红染色(HE染色)、天狼星红染色、马松(MTC)染色,按照Jain-Garcia评分系统,对大鼠肝脏纤维化程度进行评分。
1.2.5 肝脏免疫组织化学染色 石蜡包埋的大鼠肝脏组织4~5 μm连续切片,脱蜡,利用链霉菌抗生物素蛋白- 过氧化物酶连结法(SP)进行免疫组织化学检测,二氨基联苯胺(DAB)显色,苏木精复染。光学显微观察,免疫组化阳性表达部位呈现棕褐色。
1.3 统计学分析
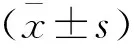
2 结果
2.1 UC-MSCs和hPMSCs的培养
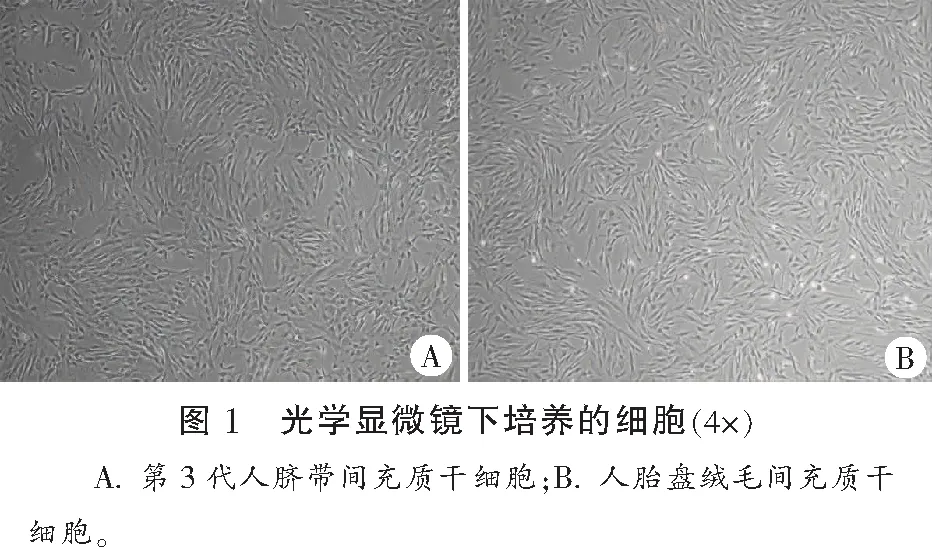
UC-MSCs贴壁生长呈良好的纤维细胞生长状态,培养至细胞融合度达70%~80%时,进行传代培养,传代频率3~4 d/次;hPMSCs贴壁生长,单层,纤维状,培养至细胞融合度达70%~80%时,进行传代培养,传代频率3~4 d/次。见图1。
2.2 各组肝脏病理学特征比较
HE和MTC染色结果显示,正常组大鼠的肝脏小叶结构正常,界限清晰,结构完整;模型组大鼠,正常肝小叶出现结构破坏,假小叶,且肝板排列呈紊乱状态,纤维组织增生严重;UC-MSCs和hPMSCs移植组,肝脏组织的纤维增生具有明显的改善。通过HE和MTC染色后依据Jain-Garcia评分系统进行评分,UC-MSCs和hPMSCs移植组较对照组纤维化程度有所改善,差异均具有统计学意义(P<0.05);UC-MSCs组与hPMSCs组的肝组织评分差异无统计学意义(P>0.05)。天狼猩红染色表明,正常组大鼠,肝小叶中央静脉管壁呈现红色纤维组织染色,少量的染色出现在小叶间隔及汇管区;而大量纤维组织沉积染色出现在模型组大鼠肝脏中,且包绕肝细胞形成假小叶,大鼠肝纤维化模型构建较成功。UC-MSCs和hPMSCs移植组纤维组织的沉积量明显少于肝纤维化模型组。见图2及表1。
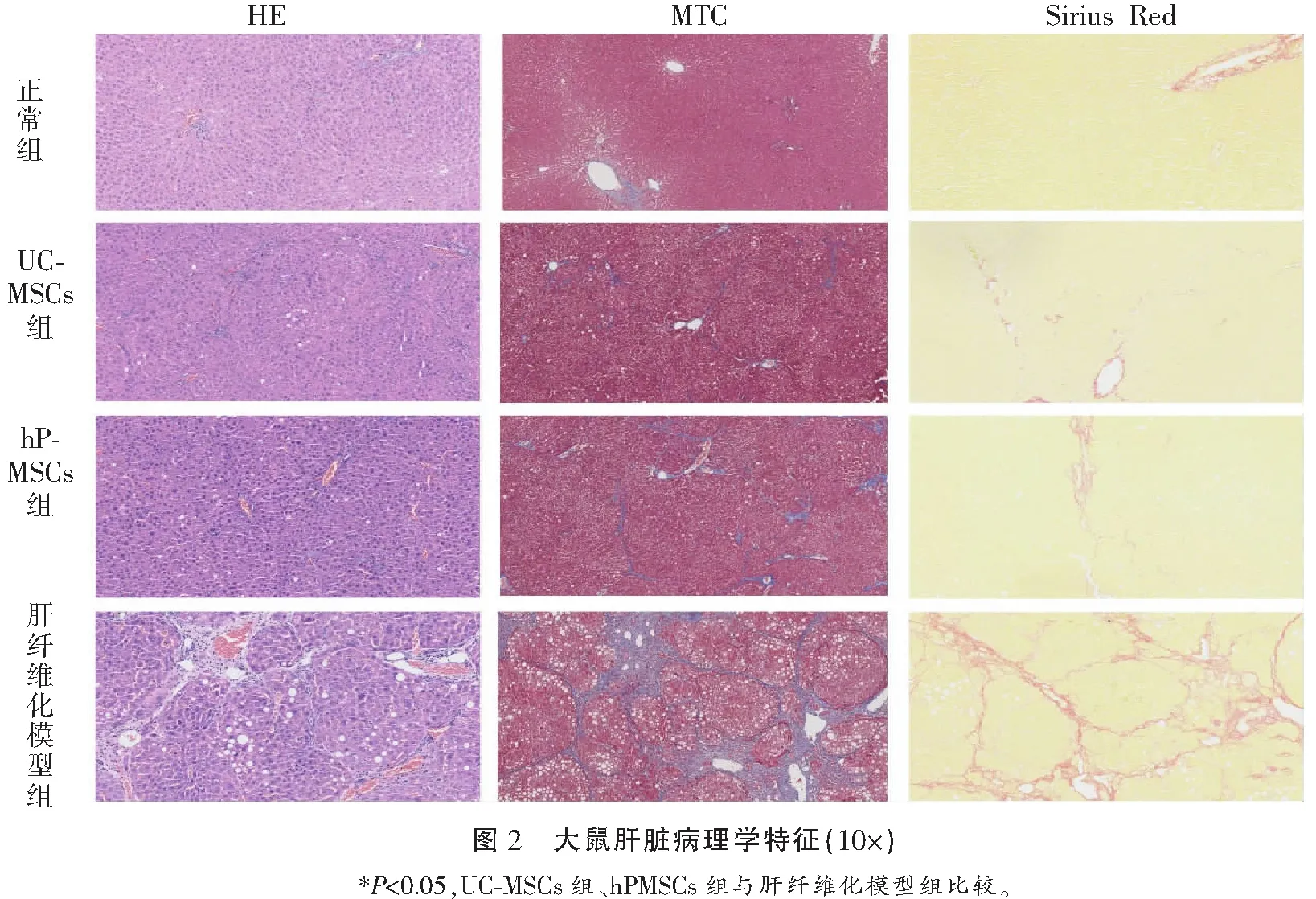
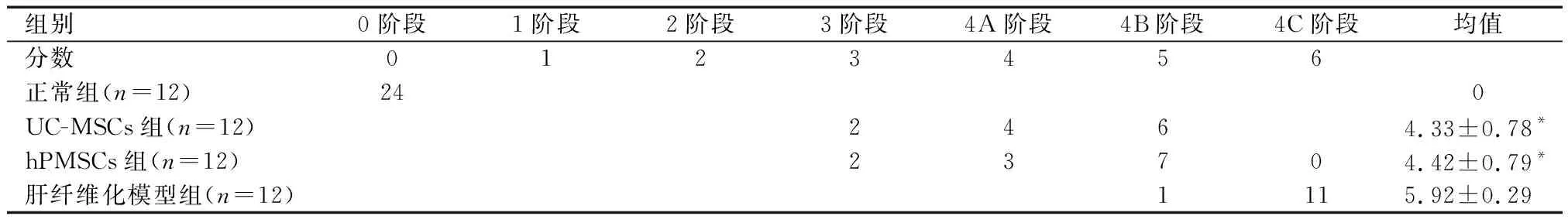
表1 UC-MSCs组与hPMSCs组的肝组织评分
2.3 各组肝脏功能比较
与肝纤维化模型组比较,UC-MSCs和hPMSCs移植组的肝功能指标(ALB、ALT、ALP、AST)均改善,差异均有统计学意义(P<0.05),UC-MSCs和hPMSCs移植能够提高肝功能;UC-MSCs和hPMSCs组大鼠的肝功能指标相比,差异无统计学意义(P> 0.05)。见表2。

表2 移植后大鼠肝功能指标检测结果
2.4 各组免疫组织化学比较
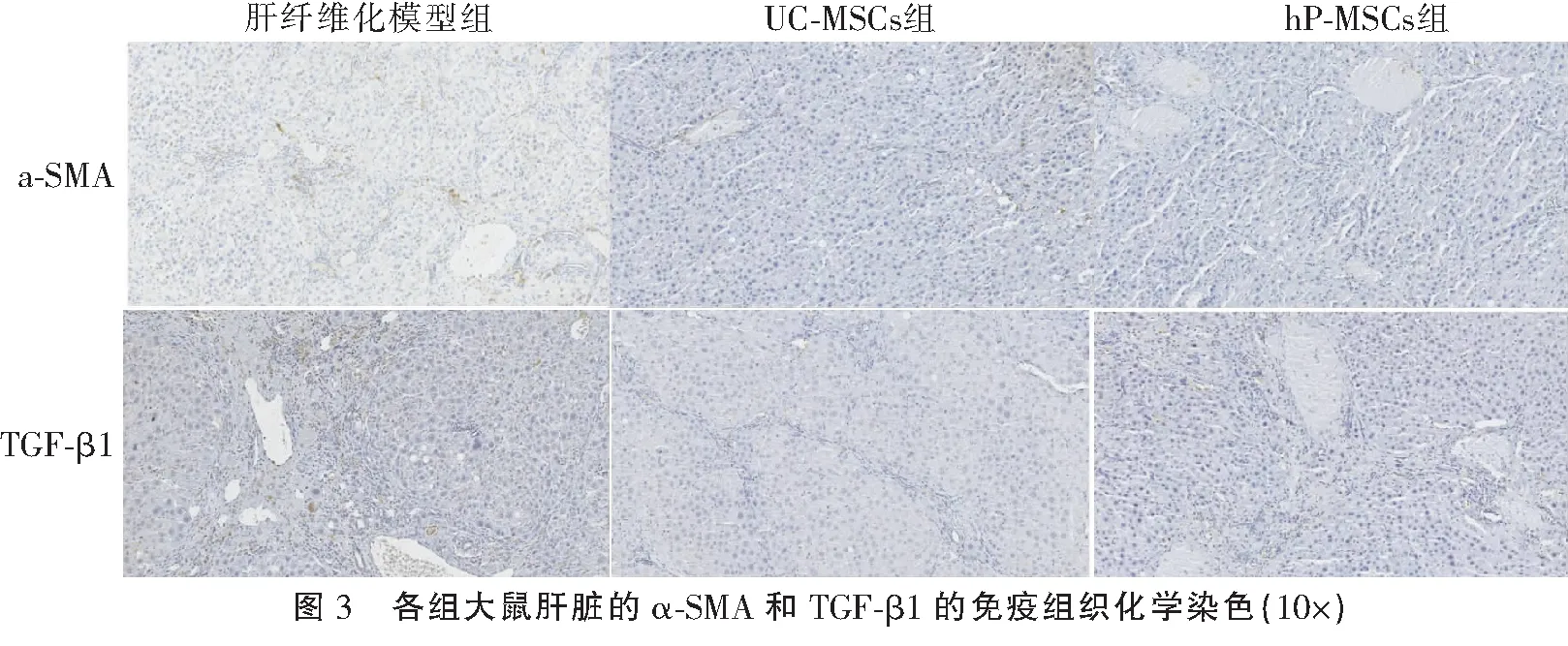
免疫组织化学结果显示,与肝纤维化模型组相比,UC-MSCs和hPMSCs移植组的α-平滑肌肌动蛋白(α-smooth muscle actin,α-SMA)、转化生长因子-β1(transforming growth factor-β1,TGF-β1)表达水平降低,表明UC-MSCs和hPMSCs移植可抑制肝星状细胞(hepatic stellate cell,HSC)活性和防止HSC分化。见图3。
3 讨论
肝硬化是由多种原因引起的肝脏慢性进行性病变,其主要特点是肝脏结构破坏,纤维状隔膜围绕再生或再生的实质结节,肝纤维化是肝硬化发展的中间阶段。目前,肝移植仍是临床治疗肝硬化的最有效方法,但碍于各种复杂因素,其临床应用受限[1-2]。近年来,随着干细胞移植治疗疾病的发展,干细胞移植治疗肝病逐渐成为研究热点,由于兼备移植细胞来源丰富、低免疫原性且创伤性小等优势,有望于成为改善终末期肝病的一种有前途的替代方法,使肝病治疗进入一个划时代再生治疗阶段[14]。Ryu等[4]指出,移植的MSC治疗效果可通过抗纤维化机制和促进肝细胞再生衡量,且其治疗肝纤维化的疗效较显著 。MSC可能通过分泌保护细胞免受损伤的有机营养因子,或通过激活内源性修复机制促进纤维基质降解,恢复受损肝脏[8,15]。本研究中, UC-MSCs和hPMSCs移植组纤维化程度的改善效应均强于肝纤维化模型组,纤维组织的沉积量也减少。既往研究[16]采用Laennec fibrosis scoring system对肝纤维化进行评分分类,但由于缺少确切的隔膜和结节大小,易误诊。本研究运用Jain-Garcia评分系统对肝硬化进行了更加确切和详细的分类,评分结果与H&E 、MTC和天狼星红染色结果一致,均表明移植治疗组能够改善肝纤维化。细胞外基质(extracellularmatrix,ECM)降解不足和HSC活化是肝纤维化发生的关键因素,激活的HSC可通过转化为鼠心肌成纤维细胞(mouse cardiac fibroblasts,MFC)促进ECM合成增多、降解减少或代偿不足,诱发肝脏细胞外基质异常沉积,进而引起肝纤维化[5,15]。α-SMA则是HSC激活标志,肝纤维化的发生和发展均与HSC过表达α-SMA密切相关[1,17]。TGF-β1具有调控细胞外基质的沉积和降解作用,不仅能够激活HSC、诱导肝细胞凋亡、抑制肝细胞增殖,促进ECM生成,还能够减少胶原酶和蛋白酶产生,增加组织抑制因子的生成,使ECM降解减少[1,18]。本研究显示,移植治疗组α-SMA和TGF-β1表达下调,表明UC-MSCs和hPMSCs的移植可抑制HSC活性并阻碍其分化。
综上,UC-MSCs和hPMSCs移植组对大鼠肝脏纤维化程度的改善程度明显优于对照组,一定程度上恢复大鼠肝脏功能。

