Foxp3/SMARCE1信号轴促进宫颈癌细胞侵袭和迁移
龙嘉莉,刘曙光,马红梅,曾超
(中山大学附属第八医院病理科,广东 深圳 518033)
目前,宫颈癌仍是妇女癌症相关死亡的主要原因。虽然近年来宫颈癌在全世界的发病率已显著下降,但其死亡率在发展中国家仍在增加。一般来说,早期宫颈癌患者治疗后的5年生存率可达90%以上,而中晚期患者的5年生存率不到30%[1]。因此,找到驱动宫颈癌进展的因素尤为重要。本团队前期实验研究[2]发现,随着宫颈病变级别的增加,叉头样转录因子3(forkhead box protein 3,Foxp3)表达强度和阳性率增加,证实Foxp3在宫颈癌的进展过程中起着重要作用。为进一步探究Foxp3对宫颈癌生物学行为的影响及分子调控机制,本实验采用基因芯片筛选出Foxp3下游基因SMARCE1,并证实Foxp3调控SMARCE1促进宫颈癌Hela细胞的侵袭和迁移。
1 材料与方法
1.1 材料
宫颈癌Hela细胞系由本实验室保存。DMEM培养基、10%胎牛血清、胰蛋白酶、Lipofectamine 2000均购自美国赛默飞公司;蛋白浓度测量试剂盒购自上海碧云天公司;一抗兔抗人单克隆抗体Foxp3、SMARCE1购自美国Abcam公司;兔多抗GAPDH购自杭州贤至生物公司;HRP标记羊抗兔二抗购自武汉博士德公司;Transwell小室购自美国康宁公司。
1.2 方法
1.2.1 细胞培养、转染 宫颈癌Hela细胞采用含10%胎牛血清及1%青霉素和1%链霉素的RPMI-1640培养基进行培养,置于37 ℃,5% CO2培养箱中。将生长状态良好、汇合度为85%左右的细胞,用0.25%胰蛋白酶消化传代。Foxp3 shRNA序列为:
CCTCCAGAGAGAGATGGTA,质粒表达载体由上海吉玛公司合成。Foxp3 shRNA配套的阴性对照质粒的Hela细胞作为对照组。利用从Hela细胞中提取的mRNA,通过逆转录聚合酶链反应扩增人Foxp3全长cDNA。引物序列设计如下:
Foxp3-F:5-′TGGTACCGAGCTCGCCACCATGCCCACCAGGCCTGGCAAG-3′;
Foxp3-R:5-′GATATCTGCAGAATTCTCAGGGGCCAGGTGTAGGGTTG-3′。将Foxp3 DNA片段克隆入pcDNA3.1构建重组pcDNA3.1-Foxp3质粒。取对数生长期的Hela细胞进行转染,按照脂质体转染试剂Lipofectamine 2000说明书转染干扰或过表达质粒表达载体,转染对应的空质粒的Hela细胞作为对照组。
1.2.2 Western blot(WB)实验 转染后继续培养48 h后采用WB法检测Hela细胞中Foxp3的表达情况。采用BCA试剂盒进行蛋白定量,使用SDS-PAGE凝胶电泳分离蛋白,PVDF转膜、5%脱脂奶粉封闭后使用1∶1 000稀释后的一抗过夜孵育,选择HRP标记的二抗标记后采用ECL发光试剂盒显影后采用Bio-Rad凝胶成像系统检测染色条带的强度,计算目的蛋白和内参蛋白的光密度比值。
1.2.3 细胞迁移和侵袭实验 取转染24 h的后的Hela细胞,用0.25%胰蛋白酶消化收集,无血清培养基调整细胞密度为3×105个/mL备用。在24孔板中预先加入1 mL的DMEM完全培养基(含双抗),并放入Transwell小室,1 h后在Transwell上室分别接入200 μL各组细胞悬液,37 ℃,5% CO2培养箱培养24 h。培养完成后,取出Transwell,固定、清洗后染色,于显微镜下观察拍照。侵袭实验需制备带Matrigel胶的Transwell上室,余步骤同迁移实验。
1.2.4 生物信息分析 基因芯片分析Hela细胞敲低Foxp3表达后的差异表达基因。生物信息分析由上海GENECHEM公司进行。
1.3 统计学分析
采用SPSS 23.0软件分析数据。两组间比较用独立样本t检验。P<0.05为差异有统计学意义。
2 结果
2.1 细胞转染效率
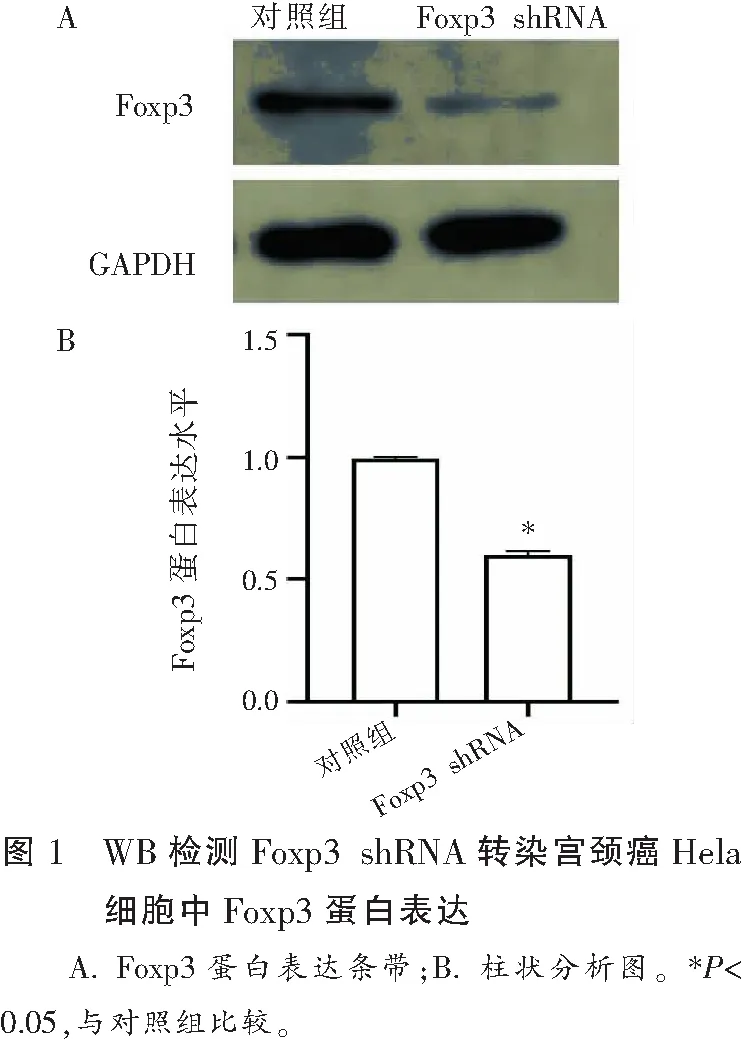
采用WB法观察Foxp3 shRNA转染Hela细胞的Foxp3表达情况。结果显示,Foxp3 shRNA转染组的Hela细胞中Foxp3蛋白表达比对照组下降(P<0.05)。见图1。
2.2 Foxp3 shRNA转染后对细胞迁移能力的影响
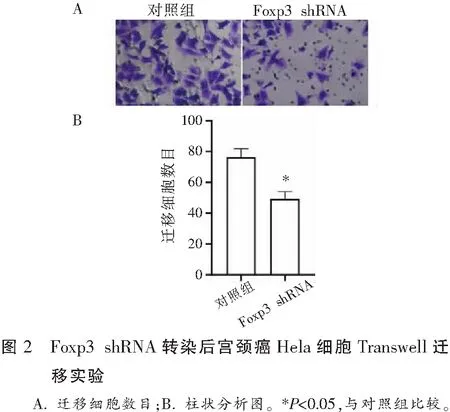
Transwell迁移实验结果表明,转染Foxp3 shRNA的Hela细胞迁移细胞数量较对照组Hela细胞细胞迁移数量少(P<0.05)。见图2。
2.3 Foxp3 shRNA转染后对宫颈癌Hela细胞侵袭能力的影响
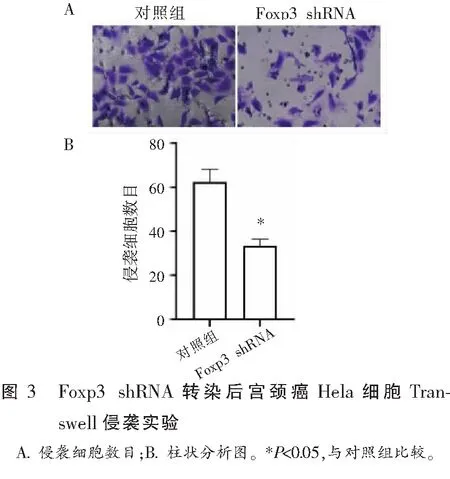
Transwell侵袭实验结果表明,转染Foxp3 shRNA的Hela细胞侵袭细胞数量较对照组Hela细胞细胞侵袭数量少(P<0.05)。见图3。
2.4 SMARCE1是Foxp3下游表达相关基因
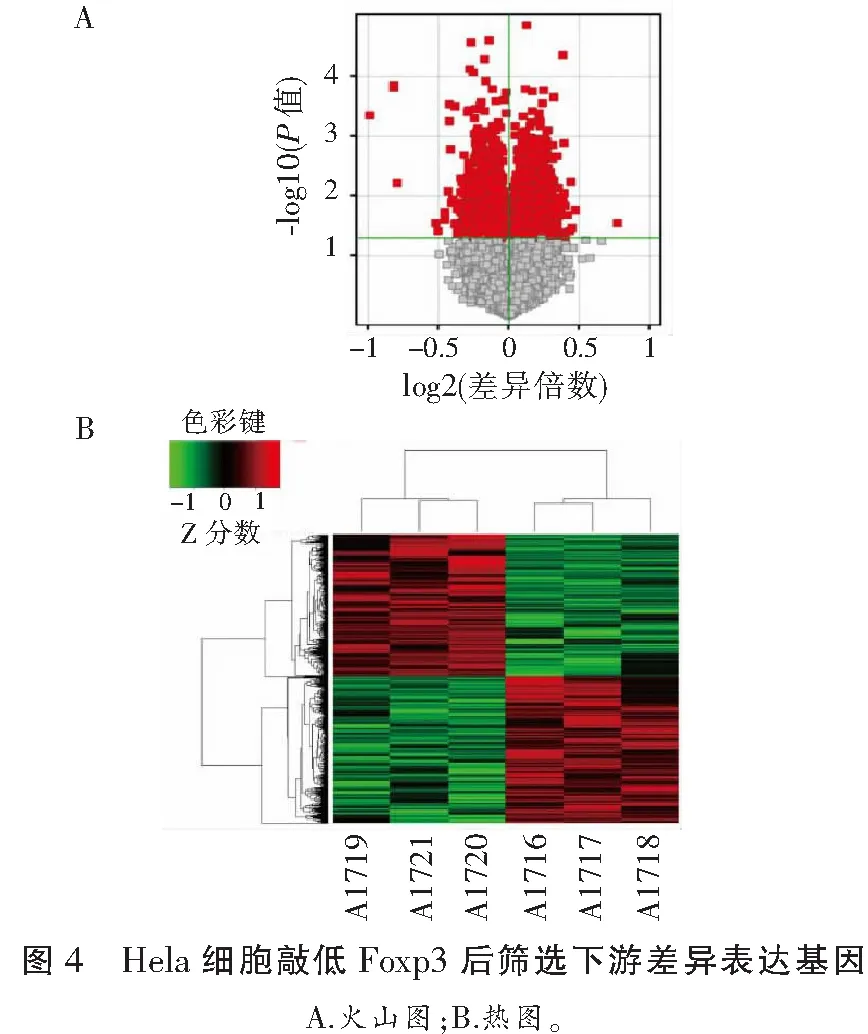
采用基因芯片技术寻找Foxp3下游基因。通过shRNA敲除Hela细胞中Foxp3的表达后,发现1 427个基因上调,1 511个基因下调,其中包括SMARCE1。见图4。
2.5 Foxp3 shRNA转染后宫颈癌Hela细胞SMARCE1表达下调
WB验证Foxp3 shRNA转染后Hela细胞中SMARCE1的表达情况。WB显示,转染Foxp3 shRNA后,与对照组相比,SMARCE1蛋白表达水平降低(P<0.05)。见图5。
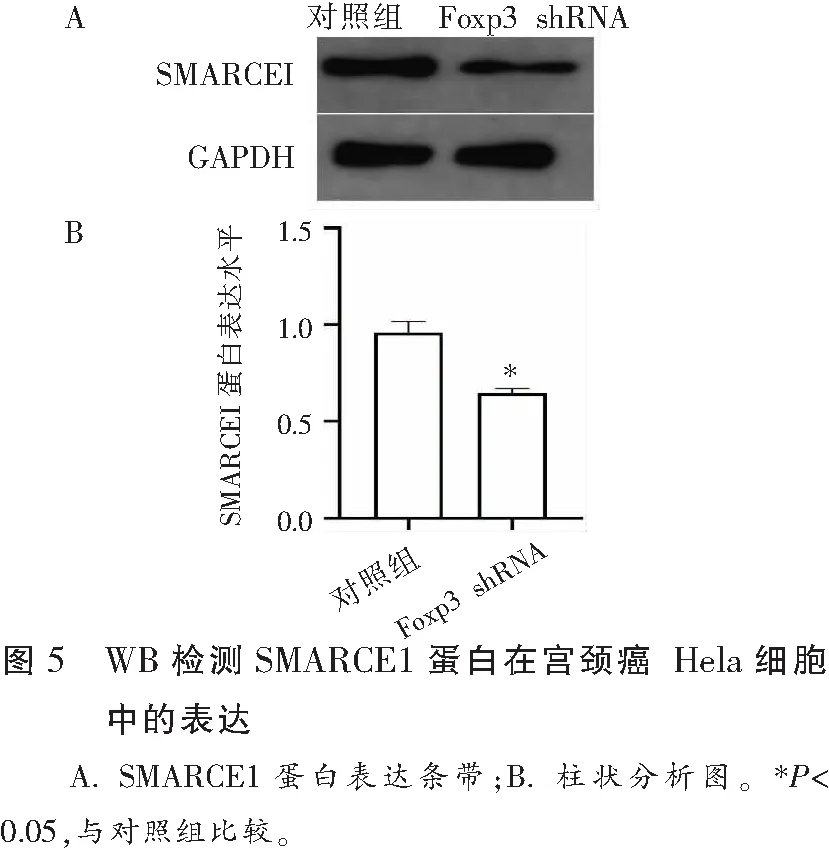
2.6 Foxp3 shRNA和转染SMARCE1质粒共转染后宫颈癌Hela细胞迁移情况
Transwell迁移实验表明,共转染Foxp3 shRNA和SMARCE1质粒组的细胞较共转染Foxp3 shRNA和pcDNA3.1空质粒组细胞迁移数量多(P<0.05)。见图6。
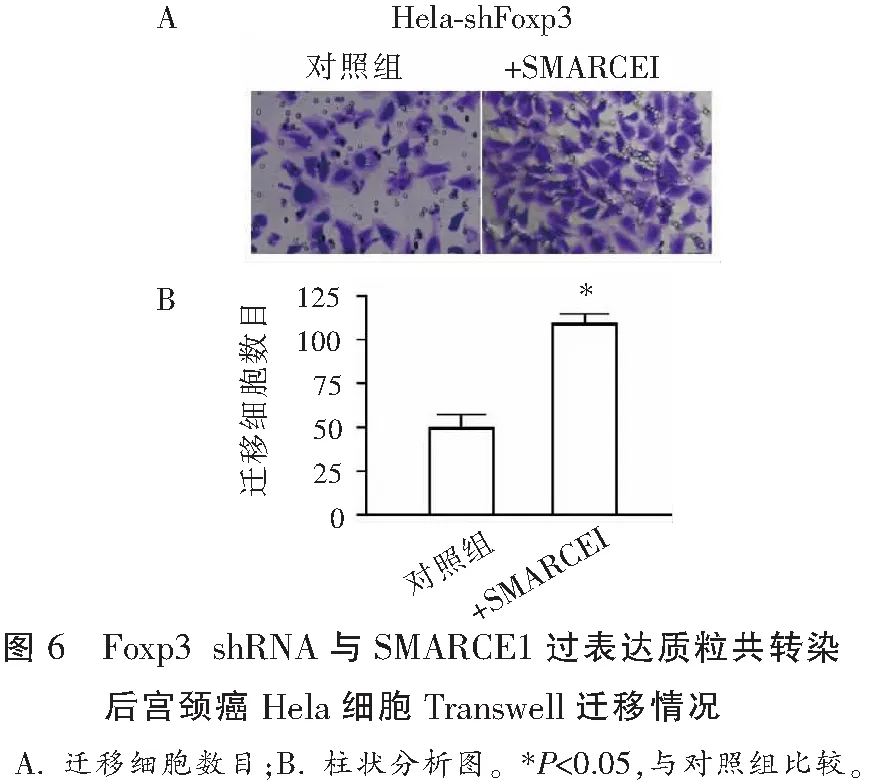
2.7 Foxp3 shRNA和转染SMARCE1质粒共转染后宫颈癌Hela细胞侵袭情况
Transwell侵袭实验表明,共转染Foxp3 shRNA和SMARCE1质粒组的细胞较共转染Foxp3 shRNA和pcDNA3.1空质粒组细胞侵袭数量多(P<0.05)。见图7。
3 讨论
宫颈癌是最常见的妇科恶性肿瘤之一,近年来更有向年轻化发展的趋势。宫颈癌的发生、发展是一个多基因改变且多步骤的复杂过程,因此,探讨宫颈癌发生发展过程中的分子机制,寻找有效分子的靶向治疗方法,将对加强和促进宫颈癌的防治工作提供实验研究的基础。
最新研究[3]表明,除了T细胞谱系之外,Foxp3在一系列癌症中表达,包括卵巢[4]、肺[5]和前列腺癌。然而,Foxp3对癌症的影响非常有争议。在结肠直肠癌[6]、黑色素瘤[7]和肺癌[8]中,高水平的Foxp3提示与不良的预后有关。相反,高水平的Foxp3却有利于乳腺癌的预后[9]。本团队前期实验发现,随着宫颈病变级别的增加,Foxp3表达强度和阳性率增加,提示Foxp3可能在宫颈病变组织水平的分化和生长中发挥重要作用[2]。研究组进一步证实,Foxp3通过外源敲低Foxp3表达抑制宫颈癌细胞的迁移和侵袭。染色质重塑对于全身性生理稳态是必不可少的。染色质重塑的异常通常导致癌症的发生和发展[10]。因此,在许多类型的癌症中经常观察到参与染色质重塑的基因突变[11]。SMARCE1是SWI/SNF染色质重塑复合物的组分,通过以ATP依赖性方式改变核小体内的DNA-组蛋白触点而改变染色质结构[12]。证据[13-15]表明,较高的SMARCE1表达与乳腺癌、胃癌和卵巢癌的预后相关,SMARCE1可以作为预测癌细胞侵袭和迁移能力的指标。在本研究中,课题组通过基因芯片分析,筛选出SMARCE1作为宫颈癌细胞中Foxp3的下游差异表达基因。此外,SMARCE1的过表达可以拮抗Foxp3敲低介导的宫颈癌细胞迁移和侵袭的抑制,表明SMARCE1至少部分促进Foxp3介导的迁移和宫颈癌细胞的侵袭。这是首次提出SMARCE1可作为Foxp3下游作用基因,并揭示了SMARCE1调节对Foxp3在宫颈癌中的致癌作用的功能意义。
综上,Foxp3可调控下游SMARCE1促进宫颈癌细胞的迁移和侵袭,该结果对Foxp3在宫颈癌中的致癌功能提供了新线索,这表明Foxp3/SMARCE1信号轴可能是宫颈癌进展的新途径。

