新疆和山东产地驴奶成分的代谢组和脂质组分析
罗依扎·瓦哈甫,李 会,徐 雷,徐贞贞,廖小军
(1.中国农业科学院农业质量标准与检测技术研究所,北京 100081;2.中国农业大学食品科学与营养工程学院,北京 100083;3.新疆大学生命科学与技术学院,新疆 乌鲁木齐 830046)
驴奶作为一种特种乳,其营养成分接近母乳且具有低致敏性[1],因此对于母乳或牛奶不耐受的婴幼儿来说,驴奶是个优质的选择[2]。作为世界主要毛驴养殖大国,目前我国毛驴库存总量为260多万头,居世界第4位,其中新疆和山东两省分别作为主要产区之一,占比约为14%和3%[3]。山东东阿县和新疆岳普湖县是中国一东一西两个颇具代表性的毛驴养殖基地,因此选择两地驴奶作为此研究的研究对象。
代谢组学作为一个新兴的重要的研究方法,在食品安全[4]、食品产地鉴别、转基因食品鉴别、伪劣产品鉴别、食品质量控制、食品存贮和加工、鉴别和预测食品味道[5]、营养学研究[6]等多个方面得以广泛应用。脂质对于人类健康具有重要作用,在生物系统中具有多种功能,主要包括细胞膜的结构和功能组分、细胞代谢、能量储存、激素和信号分子调节各种细胞和生理反应[7]。脂质组学也已经广泛用于不同领域[8-11],在奶及其制品方面的应用也越来越多,包括动物物种和品种识别、贮存加工、掺假鉴别、产地鉴别等[7,12-14]。代谢组学和脂质组学方面的信息有助于更加全面准确地了解乳的质量、加工特性、以及产地等方面的信息。
国外对于驴奶相关的研究起步较早,尤其是欧洲等国,针对驴奶已开展了从营养成分到加工等方面较为系统的研究[15-16]。然而,我国驴奶研究起步相对较晚,研究数量有限、角度单一,且严重缺乏系统性、综合性,尤其缺乏对主要产区驴奶的深入研究。针对以上问题,本研究使用非靶向代谢组学和脂质组学技术,对我国两个重要驴奶基地新疆岳普湖县(XJ)和山东东阿县(SD)的驴奶中的代谢物和脂质进行较为系统的分析并筛选主要特征标志物,从而为我国主要产区驴奶产品的开发提供可靠的代谢物和脂质组成的基础信息。
1 材料与方法
1.1 材料与试剂
驴奶样品于2018年6—7月分别采自新疆玉昆仑天然食品工程有限公司和山东东阿阿胶有限公司。从每个公司各选取20 头母驴为采样对象,每天采集1次新鲜驴奶,连续采集6 天。取样后立即冷藏并送至实验室,用无菌离心管分装后,在-80 ℃贮存。运输途中使用干冰。
1.2 仪器与设备
TripleTOF 6600超高效液相色谱-串联四极杆飞行时间质谱仪 美国AB SCIEX公司;Milli-Q ACADEEMIC净水系统 法国MiliQ公司。
醋酸铵(纯度≥98%) 默克美国西格玛奥德里奇公司;乙腈(液相色谱-质谱级) 德国默克股份两合公司;甲酸(色谱级) 北京迪科马科技有限公司;2-丙醇(液相色谱-质谱级) 上海安谱实验科技股份有限公司。
1.3 方法
1.3.1 代谢组学分析
1.3.1.1 样品前处理
从采集的12 份驴奶样品中各取2 mL,于4 ℃、5 000 r/min离心30 min。取1 mL上清液,向其中加入3 mL乙腈,旋涡混合10 min,于4 ℃、9 000 r/min离心15 min。取上清液过0.22 μm滤膜,滤液待测。取少量、等量的各驴奶样品,混合均匀后用作质控(quality control,QC)样本。
1.3.1.2 色谱条件
Agilent poroshell-C18色谱柱(2.1 mm×100 mm,2.7 μm);进样量5 μL;柱温40 ℃;流速0.4 mL/min;正离子模式的流动相:A为0.1%甲酸溶液,B为含0.1%甲酸的乙腈溶液;负离子模式的流动相:A为0.1%甲酸溶液,B为含0.1%甲酸的乙腈溶液,A、B均含5 mmol/L醋酸铵溶液;正离子模式和负离子模式的梯度洗脱程序如表1所示。
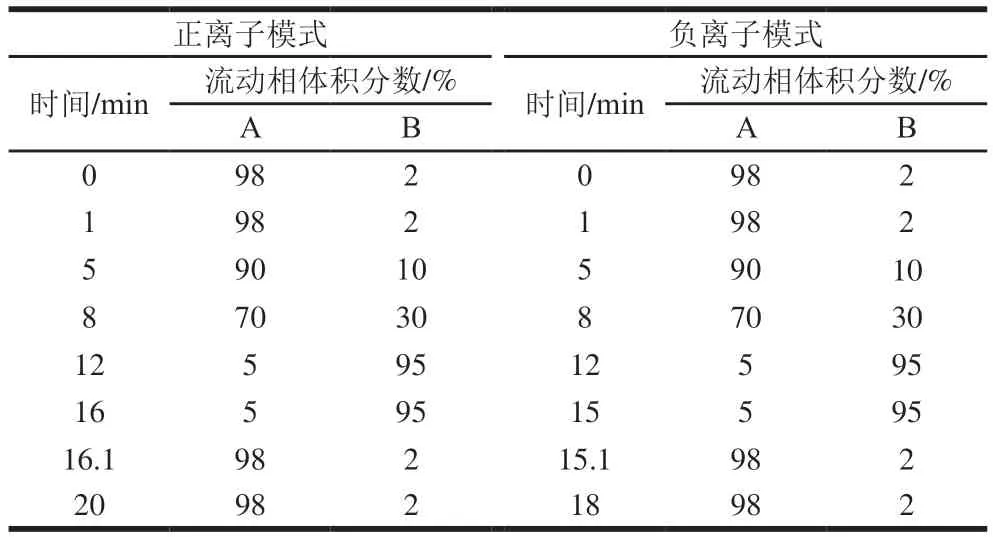
表1 代谢组学分析中色谱梯度洗脱程序Table 1 Chromatographic gradient elution procedure in metabolomic analysis
1.3.1.3 质谱分析
采用SCIEX Triple TOFTM6600系统进行质谱分析,分别在正电离和负电离模式下进行数据采集。电喷雾离子源的参数设置如下:雾化气压力50 psi;辅助干燥气压力50 psi;气帘气压力25 psi;离子源温度550 ℃;正离子模式:喷雾电压5 500 V,去簇电压80V;负离子模式:喷雾电压-4 500 V;去簇电压-80 V。采用数据依赖性(intelligent data acquisition,IDA)数据采集方法,一级质谱质量检测范围为m/z50~1 000,以高灵敏度模式采集二级质谱,碰撞能量(30±15)eV,二级质谱质量检测范围为m/z50~1 000。每5 针样品之后进一针QC样本,以确保系统的稳定性和重复性[17]。
1.3.2 脂质组学分析
1.3.2.1 样品前处理
从采集的12 份驴奶样品中各取600 μL,与1 mL水混合均匀,加入3 mL三氯甲烷-甲醇溶液(2∶1,V/V)混合摇匀10 min,于2 000 r/min离心15 min。取下层液体转移至玻璃管中,用氮气吹干。用400 μL三氯甲烷-甲醇溶液(2∶1,V/V)复溶,过0.22 μm滤膜,滤液待测。取少量、等量的各驴奶样品,混合均匀后用作QC样本。
1.3.2.2 色谱条件
Agilent poroshell-C18色谱柱(3.0 mm×100 mm,2.7 μm);进样量5 μL;柱温40 ℃;流速0.25 mL/min。流动相:A为乙腈-水溶液(60∶40,V/V),B为异丙醇-乙腈溶液(90∶10,V/V),A、B均含10 mmol/L醋酸铵。正离子模式和负离子模式的梯度洗脱程序如表2所示。
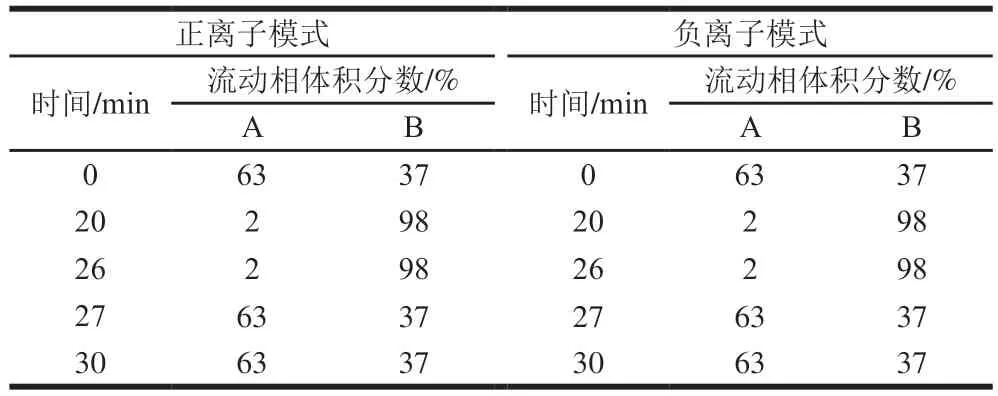
表2 脂质组学分析中色谱梯度洗脱程序Table 2 Chromatographic gradient elution procedure in lipidomic analysis
1.3.2.3 质谱条件
一级和二级质谱质量检测范围为m/z50~1 500,其余质谱条件与1.3.1.3节一致。
1.4 数据处理
使用过滤原始数据缺失值(每一组内缺失值都超过20%,则去除此特征值)、填充缺失值(使用极小值)、数据归一化(总和)、去除相对标准偏差(relative standard deviation,RSD)>30%的变量、数据转换(lg转化)进行代谢物学数据预处理。采用R包1.6.2的ropls对预处理后的代谢组学数据进行主成分分析(principal component analysis,PCA)和正交偏最小二乘鉴别分析(orthogonal partial least squares-discriminant analysis,OPLS-DA),再依据变量投影重要性(variable importance in projection,VIP)值。以VIP>1,P<0.05且差异倍数(fold change,FC)≥2或<0.5为阈值,筛选出对分类贡献较大的代谢物[17]。
脂质组数据经预处理(去除RSD>30%的变量)后,采用SIMCA 14.1软件进行PCA和OPLS-DA多元统计分析,以VIP≥3.0,P<0.001且FC≥2或<0.5为阈值,筛选出对分类贡献较大的脂类物质。
2 结果与分析
2.1 驴奶中代谢物组分析
在正离子和负离子模式下分别从驴奶中筛选出576、489个化合物。通过与数据库匹配,正离子模式下和负离子模式下分别注释到89、104个代谢物。将上述注释到的代谢物进行人类代谢组数据库(human metabolome database,HMDB)分类分析。由图1可知,代谢物数量前20的化合物被分类为11个一级类别,其中主要为脂质和类脂分子(主要包括磷脂酰乙醇胺、磷脂酰胆碱、磷脂酰丝氨酸、单硬脂酸甘油酯等),其次是有机酸及其衍生物,还有有机杂环化合物。
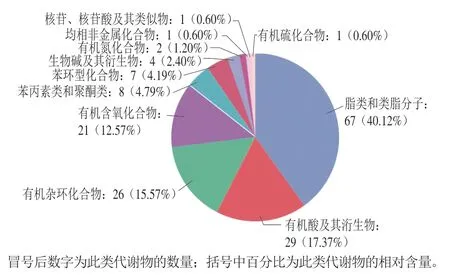
图1 驴奶中代谢物数量前20化合物的HMDB一级分类Fig. 1 HMDB superclasses of the top 20 metabolites in donkey milk
2.2 XJ与SD驴奶中差异代谢物分析
对预处理后的数据进行PCA。由图2可知,所有QC样本均集中分布在坐标轴中间,说明样品间分离是由于组间的差异变量,而非分析过程中的差异造成。正离子模式下,PC1和PC2的贡献率分别为29.5%和18.1%;负离子模式下,PC1和PC2的贡献率分别为42.6%和23.4%。可以看出,XJ与SD驴奶样品在PC1方向上能被很好地分开。
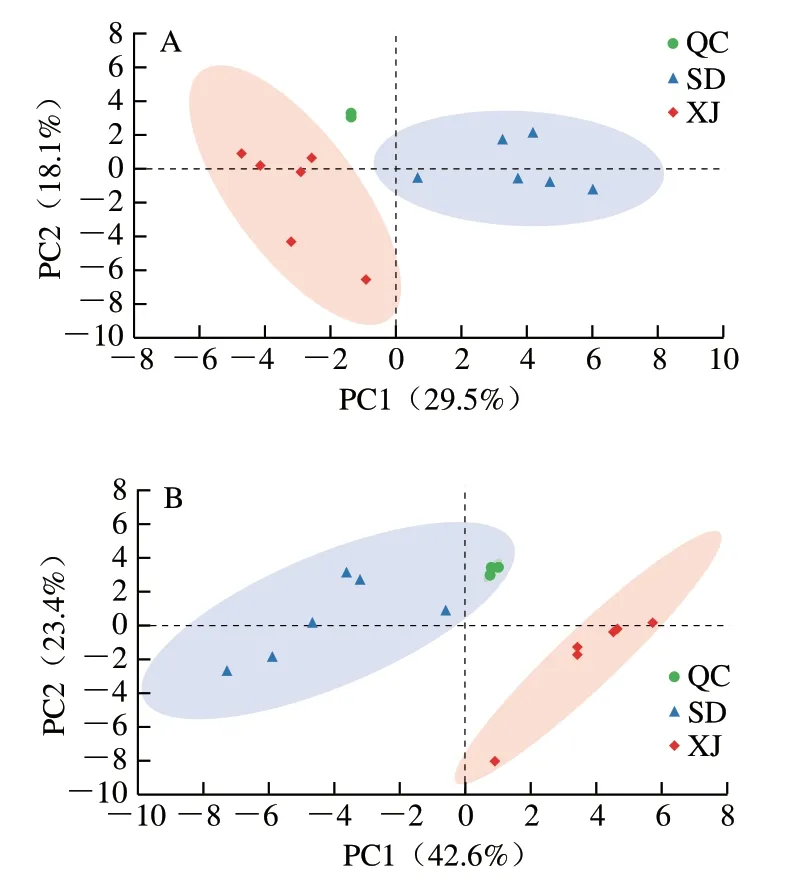
图2 正离子(A)和负离子(B)模式下XJ和SD驴奶中代谢物的PCA得分图Fig. 2 PCA score plots of metabolites in donkey milk from Xinjiang and Shandong in positive ion (A) and negative ion (B) modes
对过滤原始数据缺失值后的代谢物进行Venn图分析。由图3A可知,在正离子模式下,XJ与SD驴奶样品共有的代谢物有865个,其中XJ独有的代谢物有140个,SD独有的代谢物有55个。由图3B可知,在负离子模式下,XJ与SD驴奶样品共有代谢物有991个,XJ独有的代谢物有101个,SD独有的代谢物有57个。

图3 正离子(A)和负离子(B)模式下XJ和SD驴奶中代谢物的Venn图分析Fig. 3 Venn plots of shared and unique metabolites between donkey milk from Xinjiang and Shandong under positive ion (A) and negative ion (B) modes
由图4可知,两组样本都能够被明显区分,说明两组样本有明显的组间差异,而组内重复性较好。用交叉验证残差的变异分析检验OPLS-DA模型的有效性。正离子模式下,拟合模型(代表Y变量的可解释性),Q2=86%(代表模型的可预测性),即该模型用31.4%的原始变量解释了两组之间94.6%的差异,模型预测能力为86%。负离子模式下,拟合模型其Q2=86.8%,即该模型用43.8%的原始变量解释了两组之间92.3%的差异,模型预测能力为86.8%。当Q2>50%、认为模型有效[18],正负离子模式下均满足此标准,故OPLS-DA模型拟合效果良好。

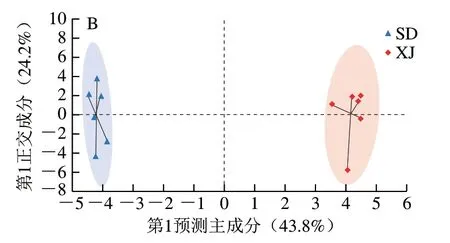
图4 正离子(A)和负离子(B)模式下XJ和SD驴奶中代谢物的OPLS-DA得分图Fig. 4 OPLS-DA score plots of metabolites in donkey milk from Xinjiang and Shandong in positive ion (A) and negative ion (B) modes
为了确保结果的可靠性,对OPLS-DA模型进行200次置换检验分析。由图5可知,在正离子模式下,置换检验产生的Q2截距为-0.050 7,而在负离子模式下Q2截距为-0.500 7。置换检验评价OPLS-DA模型稳健可靠,正负离子模式下模型均不存在过拟合(Q2截距<0.05),说明OPLS-DA模型可行,XJ和SD驴奶中的代谢物差异显著。

图5 正离子(A)和负离子(B)模式下XJ和SD驴奶中代谢物的OPLS-DA置换检验图Fig. 5 OPLS-DA permutation test charts of metabolites in donkey milk from Xinjiang and Shandong in positive ion (A) and negative ion (B) modes
基于OPLS-DA模型中VIP值、方差分析及FC分析分别在正离子和负离子模式下筛选出12、34种差异代谢物。其中一个差异代谢物被认为是特征成分(因为它只存在于一个样本中,但在另一个样本中未检测到),另外45个差异代谢物在XJ和SD驴奶中样品中均能检测到,但丰度不同。由表3可知,注释到的差异代谢物有16种。

表3 正负离子模式下XJ和SD驴奶中注释到的潜在差异代谢物Table 3 Potential differential metabolites annotated in donkey milk from Xinjiang and Shandong in positive ion and negative ion modes
2.3 驴奶中脂质组分析
经预处理后,在正离子模式下从驴奶中提取到3 594种化合物,其中有146种化合物仅存在于SD驴奶样品中,21种化合物仅存在于XJ驴奶样品中;在负离子模式下从驴奶中提取了5 724种化合物,其中有103种化合物仅存在于SD驴奶样品中,69种化合物仅存在于XJ驴奶样品中。
注释到的脂质多为不饱和脂肪酸(>70%),其中包括奶中常见的多种不饱和脂肪酸,例如:油酸、亚油酸、花生四烯酸、α-亚麻酸等。注释到的脂质中,共检测到1种心磷脂、1种鞘糖脂、3种甘油磷脂、4种鞘氨醇、10种单油酸甘油酯、36种磷脂酰肌醇、38种磷脂酰丝氨酸、52种鞘磷脂、56种磷脂酸、58种神经酰胺(其中包括28种糖苷神经酰胺,例如乳糖神经酰胺、葡糖基神经酰胺和半乳糖基神经酰胺等)、62种磷脂酰甘油、74种甘油二酯、83种磷脂酰乙醇胺、87种磷脂酰胆碱和168种甘油三酯等。
2.4 XJ与SD驴奶中脂质组学差异物分析
对预处理后的数据进行PCA。由图6可知,QC样本分组良好,同样说明组间分离是由于组间的差异变量,而不是由分析过程中的差异造成。PC1解释了大部分变化:正负离子模式下PC1的贡献率分别为36.7%、52.0%,说明XJ与SD驴奶样品能够被分开,并且在PC1方向上能被很好地分开。


图6 正离子(A)和负离子(B)模式下XJ和SD驴奶中脂质的PCA得分图Fig. 6 PCA score plots of lipids in donkey milk from Xinjiang and Shandong in positive ion (A) and negative ion (B) modes
对预处理后的数据进行OPLS-DA。由图7可知,两组样本同样都能明显被区分,说明两样本有明显组间差异,而组内重复性较好。在正离子模式下,OPLS-DA模型为74.5%,为99.3%,Q2为97.8%,即该模型用74.5%的原始变量解释了两组之间99.3%的差异,模型的预测能力为97.8%。在负离子模式下,OPLS-DA模型为63.0%,为98.3%,Q2为93.2%,该模型用63.0%的原始变量解释了两组之间98.3%的差异,模型的预测能力为93.2%。在正负离子模式下OPLS-DA模型的拟合效果良好。

图7 正离子(A)和负离子(B)模式下XJ和SD驴奶中脂质的OPLS-DA得分图Fig. 7 OPLS-DA score plots of lipids in donkey milk from Xinjiang and Shandong in positive ion (A) and negative ion (B) modes
对OPLS-DA模型进行200次置换检验,从图8可以看出,正负离子模式下Q2截距分别为-0.768和-0.335,均小于0.05,表明OPLS-DA模型未过拟合。
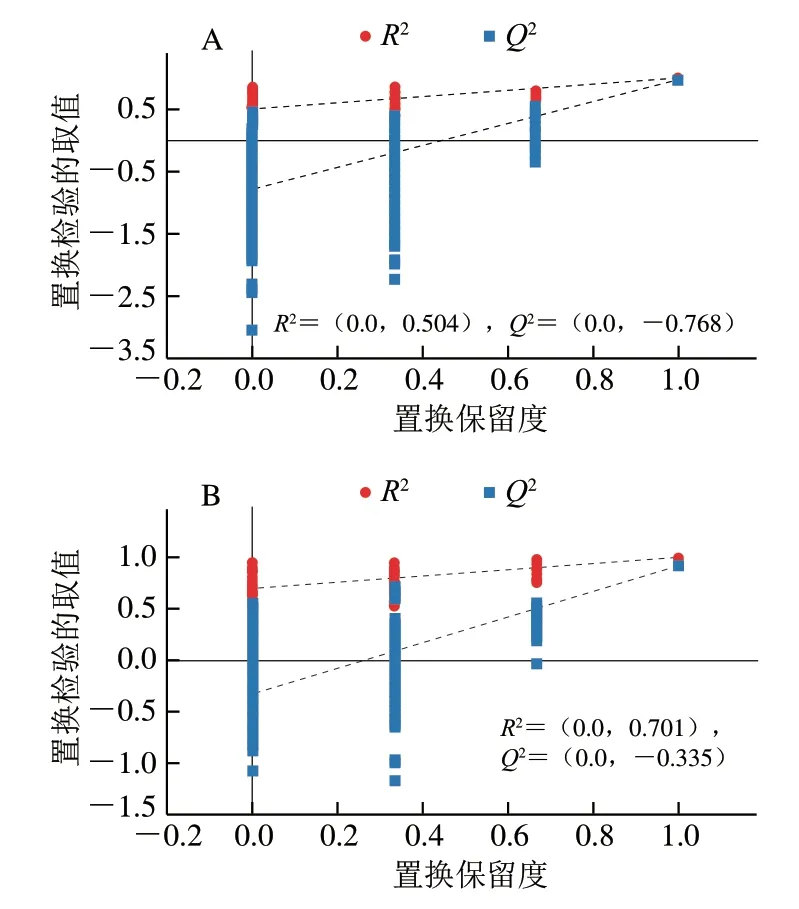
图8 正离子(A)和负离子(B)模式下XJ和SD驴奶中脂质的OPLS-DA置换检验图Fig. 8 OPLS-DA permutation test charts of lipids in donkey milk from Xinjiang and Shandong in positive ion (A) and negative ion (B) modes

表4 正负离子模式下XJ和SD驴奶中注释到的潜在脂质差异物Table 4 Potential differential lipids annotated in donkey milk from Xinjiang and Shandong in positive ion and negative ion modes
基于OPLS-DA模型中VIP值、方差分析及FC分析分别在正离子和负离子模式下筛选出50、36个差异脂质。如表4所示,与数据库比对后,在正离子和负离子模式下分别注释到18、9种差异脂质,并且这些差异脂质化合物的P值均小于0.001。
3 讨 论
对来自不同产区的两组驴奶样品的代谢组和脂质组进行了比较分析,结果显示两组样品在正负离子模式下的代谢谱和脂质谱均差异显著。
在差异代谢物中,吗啡感受素是一种阿片四肽,是一种高效、高选择性的μ-阿片受体激动剂。多个研究指出,同一家族的阿片肽可抑制疼痛,并且不会引起吗啡等经典阿片类镇痛药特有的副作用[19]。δ-癸内酯是一种无色或浅黄色液体,具有浓郁的奶油和坚果的芳香,是天然芳香奶油的主要成分,主要用于调节食品风味,特别是软饮料、冰淇淋、糖果、牛奶、乳制品、饼干、调味品和面包制品。该物质也是重要的高档饲料添加剂,能改善饲料风味,促进畜禽快速生长[20]。烟酰胺(未在表3列出,其FC接近2且为比较重要的代谢物)是烟酸的酰胺化合物,是一种亲水性内源物质。其在皮肤上的应用早已在文献中描述,如果给予足够的生物利用度,烟酰胺能起到止痒、抗菌、血管活性、光保护等作用,因其耐受性好且安全,因此常用于化妆品中[21]。烟酰胺还具有细胞保护作用,大量研究表明烟酰胺可通过修复线粒体功能恢复三磷酸腺苷水平、抑制多聚二磷酸腺苷核糖聚合酶的激活、抑制促炎介质及抗氧化损伤等机制,在感染和脓毒症治疗中发挥重要的作用[22]。寡肽H-Gly-Gln-Pro-Arg-OH是一种功能与吞噬作用激素类似的四肽,不仅在体外对大鼠血白细胞和金黄色葡萄球菌具有明显的吞噬活性[23],还能够有效地从人单核细胞释放白细胞介素-1和肿瘤坏死因子[24]。胭脂鸟氨酸也称为鸟氨酸,是一种谷氨酸衍生物,其中谷氨酸的一个氨基氢被4-氨基-1-羧丁基取代。鸟氨酸是一种多功能氨基酸,具有保肝护肝作用,对肝硬化以及无显著特点的感染、外伤和烧伤恢复有很大帮助。此外,通过增加聚乙烯胺的合成及促进细胞增殖,鸟氨酸在提高免疫力和抗癌方面也起到一定作用[25-26]。麦德龙苷C属于齐墩果烷型三萜皂苷类化合物,常分布于植物中,研究表明[27-28]从植物中提取的齐墩果烷型三萜皂苷类具有较强的抑菌活性,能够对变形链球菌、支气管炎链球菌、唾液链球菌、金黄色葡萄球菌和嗜酸乳杆菌起到杀菌效果。在用紫堇总生物碱治疗抗生素诱导的肠道菌群失调大鼠时发现,戊基羟脯氨酸可以作为参与肠道菌群失调过程的潜在特征标志物,并且与特定的菌株有着一定关联。研究表明[29],戊基羟脯氨酸与Blautia、Hungatella、Parabacteroides和Intestinibacter都存在正相关,并且在仅使用抗生素处理的小鼠中,戊基羟脯氨酸会显著增加。在注释的代谢物中,筛选出的δ-癸内酯、异丁酸异丁酯、寡肽H-Gly-Gln-Pro-Arg-OH、胭脂鸟氨酸(VIP>4且FC>3)为SD驴奶中潜在特征标志物。
在注释的脂质中,种类最多的是磷脂类(包括磷脂酰胆碱、磷脂酰乙醇胺、磷脂酰甘油、磷脂酸、鞘磷脂、磷脂酰丝氨酸、磷脂酰肌醇、心磷脂等),其次是甘油三酯和甘油二酯。研究表明[30],驴奶中的磷脂含量(5%~10%)与马奶类似,较其他哺乳动物奶和母乳更高。磷脂具有潜在的抗癌作用,特别是鞘磷脂对结肠癌具有保护作用[30-31]。磷脂是生物膜的重要组成部分,具有细胞信号传导、细胞能量储存、细胞结构维持、调节代谢、增强体能、调节血脂、降低胆固醇、防止动脉粥样硬化等重要的生理功能,与蛋白质、维生素并列为3大营养素。磷脂酰乙醇胺、鞘氨醇、鞘磷脂、糖苷神经酰胺在其他驴奶脂质组学研究中也被注释到[32-33]。
本研究结果表明产地对驴奶脂质组有较显著的影响,这可能与不同地域的饲料组成和气候有一定的关系[34-35]。例如:如果饲喂奶牛苜蓿青贮比例高于玉米青贮,则牛奶中亚麻酸及油酸含量增加[36]。亚麻酸含量的增加可能是由于高比例苜蓿青贮饲料中亚麻酸含量较高;油酸含量的增加主要由于苜蓿可提高硬脂酸的含量,而乳中50%的油酸是由乳腺Δ9-去饱和酶作用于硬脂酸产生[36]。注释的脂质结果显示特征差异物主要为二酰基甘油和前列腺素类,还包括一些过氧羟基型脂肪酸、甘油单酯、鞘糖脂。在正离子模式下筛选到的差异脂质主要为二酰基甘油类(二酰基甘油(14:1(9Z)/14:1(9Z)/0:0))、前列腺素类(前列腺素F2α甲基醚)、甘油单酯类(甘油单酯(0:0/20:5(5Z,8Z,11Z,14Z,17Z)/0:0))、鞘糖脂(葡萄糖基鞘氨醇/鞘氨醇半乳糖苷)等,这些差异脂质主要在SD驴奶中含量较高。在负离子模式下的差异组分主要为不饱和脂肪酸(例如α-亚麻酸、油酸等)、也包括一些三酰甘油、单酰甘油磷酸乙醇胺(磷乙醇胺(18:2(9Z,12Z)/0:0))等,这些也在SD驴奶中的含量更高。在注释的脂质差异物中,三月桂酰甘油、前列腺素F2α甲基醚、二酰基甘油(14:1(9Z)/14:1(9Z)/0:0))等脂质(VIP>3且FC>8),可作为SD驴奶中潜在特征标志物。
差异脂质中不乏一些具有生理功能的脂类物质,例如:膳食中的二酰基甘油可降低体脂、减少内脏脂肪积累和降低体质量;可改善高胆固醇血症、高甘油三酯血症和动脉粥样硬化等情况[37-38];可以降低空腹胰岛素和胰岛素抵抗指数[39-40]。彭丽媛[41]在体内动物实验角度证实了前列腺素F2α对于糖尿病视网膜病变的保护作用,前列腺素F2α对于II型糖尿病患者的非增殖性糖尿病视网膜病变的早期预防和治疗具有重要的意义。有研究表明[42],十七碳烷酸可以在耐抗肿瘤药物(吉非替尼)的非小细胞肺癌细胞中发挥抗癌作用,结果可能暗示摄入十七碳烷酸丰富的食物可能对非小细胞肺癌的治疗有益。另外,也有证据显示[43]奇数碳的长链脂肪酸对II型糖尿病有一定益处。
此外,本研究还注释到一些仅存在于XJ或SD驴奶中的脂质,例如在正离子模式下注释到的N-(2-氟乙基)2-甲基花生四烯醇胺、4,12-二羟基-十五烷酸、12S-羟基-16-庚二酸、8E-十七烯二酸仅存在于XJ驴奶样本中。N-(2-氟乙基)2-甲基花生四烯醇胺是花生四稀酸的代谢产物。花生四稀酸属长链多不饱和脂肪酸,是一类重要的调控炎症的介质,参与炎症因子的合成[44]。炎症是联系肥胖、II型糖尿病及糖尿病并发症的中心环节,炎症因子通过多种途径参与胰岛素抵抗及II型糖尿病的发生,并可能预测II型糖尿病的发生和发展[45]。
本研究发现的有些脂肪酸未见在乳脂质的研究中报道,例如:4,12-二羟基-十五烷酸仅从盒果藤中分离得到[46];12S-羟基-16-庚二酸和8E-十七烯二酸仅在紫花苜蓿中鉴定到[47]。
4 结 论
采用非靶向代谢组学和脂质组学的方法,对新疆和山东两个主要产区的驴奶进行比较研究,提供了驴奶代谢物组成和脂质组成的总体信息。通过代谢组分析发现,驴奶中主要的代谢物包括脂质和类脂分子(主要包括磷脂酰乙醇胺、磷脂酰胆碱、磷脂酰丝氨酸、单硬脂酸甘油酯等)。代谢组学结果显示XJ和SD驴奶样品差异显著,以VIP>1,P<0.05且FC≥2或<0.5为阈值,在正离子和负离子模式下分别筛选出12、34种差异代谢物,其中注释到的16种差异代谢物中FC较高(<0.2)的两种代谢物(麦德龙苷C、戊基羟脯氨酸),与细菌、肠道微生物菌群代谢等相关。通过脂质组学分析发现,驴奶中主要的脂质多为不饱和脂肪酸(>70%),其中种类最多的是磷脂类。脂质组学结果也显示XJ和SD驴奶样品差异显著,以VIP≥3.0,P<0.001且FC≥2或<0.5为阈值,在负离子和正离子模式下分别筛选了50、36个差异脂质,其中注释到的差异脂质在正离子模式下有18种化合物,在负离子模式下有9种。其中包括一些具有生理功能的脂类物质例如:二酰基甘油、前列腺素F2α、十七碳烷酸等。不同地域驴奶中的差异代谢物和脂质可能与人类营养与健康、驴奶风味等相关,本研究将为驴育种、饲养、驴奶营养研究等提供一定理论依据和参考信息。目前,不同地域驴奶代谢组及脂质组方面产生差异的具体原因尚不明确,因此还有待于进一步研究。
——碳正离子的产生及稳定性比较

