基于转录组学分析酸胁迫影响鼠伤寒沙门氏菌耐酸能力的机理
杨克慧,董鹏程,刘昀阁,张一敏,2,毛衍伟,梁荣蓉,罗 欣,2,3,朱立贤,*
(1.山东农业大学食品科学与工程学院,山东 泰安 271018;2.国家牛肉加工技术研发专业中心,山东 泰安 271018;3.江苏省肉类生产与加工质量安全控制协同创新中心,江苏 南京 210095)
沙门氏菌广泛存在于牛、羊、猪、家禽、鸟类等多种动物的肠道及内脏,并通过粪便传播,可导致人类发烧、肠胃炎、败血症等多种疾病,是世界范围内引起食品公共安全问题的主要食源性致病菌之一[1]。鼠伤寒沙门氏菌(Salmonella typhimurium)是与人类沙门氏菌病相关的重要血清型,每年在全世界造成约13亿 例胃肠炎、1 600万 例伤寒和300万 人死亡[2]。为此,食品工业已经制定了各种控制措施消减微生物,通常采用乳酸、柠檬酸、过氧乙酸等有机酸喷淋来消除肉类及蔬菜上的沙门氏菌[3-5]。但长期以及不适当的酸处理会使沙门氏菌处于一种弱酸的胁迫环境,进而诱导其产生耐酸反应(acid tolerance response,ATR)。类似地,在肉牛屠宰加工时,新鲜胴体的微生物通常来源于粪便或皮毛[6]。畜禽屠宰后胴体肌糖原降解产生乳酸、ATP分解产生磷酸根离子等会使胴体pH值下降到5.4左右,这种弱酸环境也会使沙门氏菌产生酸胁迫,进而产生ATR[7]。
ATR是指沙门氏菌经过温和酸胁迫后,在强酸致死条件下耐受能力增强的现象。沙门氏菌存在多种与ATR相关的调节因子,包括RpoS、Fur以及双组分信号传导系统OmpR/EnvZ和PhoP/PhoQ等,能够诱导酸休克蛋白的表达,进而防止或修复酸应激引起的大分子损伤[8]。此外,精氨酸代谢系统能够通过脱羧作用消耗细胞内质子,维持稳定的胞内pH值[9];ATP合酶系统通过质子排出产生质子迁移力,促进胞内多余质子排出,维持胞内pH值和细胞存活[10]。同时,经酸应激后鼠伤寒沙门氏菌细胞膜环丙烷脂肪酸合酶基因cfa的表达水平显著升高,增加细胞膜环丙烷脂肪酸含量,降低细胞膜对H+通透性,进一步降低质子流入胞质的程度[11]。目前对于沙门氏菌ATR的研究多集中于酸应激后其相应机制的探讨[12],而温和酸胁迫对鼠伤寒沙门氏菌ATR、交叉保护及毒力因子的相关影响机制尚不完全清楚。
此外,鼠伤寒沙门氏菌在强酸环境下仍可以存活并引起人类疾病,说明其具有较强的耐酸性以及在食品中形成危害的潜力。沙门氏菌产生ATR的因素有很多,除酸胁迫条件(胁迫pH值、温度、时间等)、酸激条件和培养基成分外,血清型和菌株特性也是重要的影响因素[13]。Lianou等[14]评估了酸胁迫对不同血清型及同一血清型不同来源沙门氏菌产生的ATR,结果表明沙门氏菌ATR的产生具有菌株依赖性。深入了解酸胁迫对鼠伤寒沙门氏菌ATR的影响机制,可以揭示ATR产生的真实规律,有助于针对性地制定控制和消除ATR的策略。为此,本研究采用转录组测序(RNA sequencing,RNA-seq)技术分析酸胁迫(pH 5.4)和非酸胁迫条件下鼠伤寒沙门氏菌转录反应特征,并通过DEGs富集分析阐明鼠伤寒沙门氏菌与酸胁迫相关的生物学途径,进一步明确酸胁迫对鼠伤寒沙门氏菌ATR及其他交叉保护抗性的产生机制,以期为鼠伤寒沙门氏菌在肉制品中的控制提供理论依据。
1 材料与方法
1.1 菌株与试剂
鼠伤寒沙门氏菌ATCC14028由山东农业大学食品科学与工程学院畜产品加工实验室保藏。
LB(Luria-Bertani)肉汤、LB琼脂 北京陆桥技术股份有限公司;盐酸(分析纯) 国药集团化学试剂有限公司;磷酸盐缓冲液(phosphate buffered saline,PBS)北京索莱宝科技有限公司;反转录试剂盒(Evo M-MLV RT Mix Kit with gDNA Clean for qPCR)、实时聚合酶链式反应(real-time polymerase chain reaction,real-time PCR)试剂盒(SYBR®Green Premix ProTaqHS qPCR Kit II)湖南艾科瑞生物工程有限公司。
1.2 仪器与设备
G154DWS灭菌锅 厦门致微公司;HF safe-MJQ1型红外线灭菌器 上海力申科学仪器有限公司;1300 SERISES A2生物安全柜 美国Thermo Scientific公司;细菌培养皿 美国康宁公司;Gene Quant微量核酸蛋白测定仪 英国Biochrom公司;PTC-200 PCR仪、CFX 96 real-time PCR检测系统 美国Bio-Rad公司;2100生物分析仪 美国Agilent公司;5804R离心机 德国Eppendorf公司。
1.3 方法
1.3.1 菌株活化及酸胁迫处理
将保存于-80 ℃的鼠伤寒沙门氏菌接种于新鲜LB培养基中,37 ℃振荡培养18 h活化2次。参照田牧雨等[15]的方法并稍作修改,取活化后菌液接种于pH 7.2的LB培养基(非酸胁迫对照组)及pH 5.4、5.0和4.5的LB培养基(3 mol/L盐酸溶液调节,酸胁迫处理组)中,37 ℃振荡培养4 h, 4 ℃、10 000×g离心10 min,去除上清液,无菌PBS洗涤菌体3次,收集菌体保存备用。
1.3.2 鼠伤寒沙门氏菌耐酸能力的测定
参照Ye Beining等[16]的方法并稍作修改,将各酸胁迫组和非酸胁迫组鼠伤寒沙门氏菌调整菌液浓度为7(lg(CFU/mL)),取1 mL菌液接种于9 mL pH 3的LB中(3 mol/L盐酸溶液调节),37 ℃酸激2 h。取酸激0 h和2 h菌液梯度稀释并涂布于LB平板,37 ℃倒置培养24 h后进行菌落计数,计算存活率。存活率为酸激2 h后菌落数与初始菌落数之比(%)。进行3次独立重复实验。
1.3.3 RNA提取、文库构建及测序
对上述酸胁迫组(pH 5.4)和非酸胁迫组的鼠伤寒沙门氏菌进行RNA提取,通过琼脂糖凝胶电泳和2100生物分析仪进行RNA完整性和质量检测。RNA检测合格后,去除rRNA,通过Oligo磁珠富集带有polyA尾的mRNA,加入Fragmentation Buffer通过二价阳离子将所得到的mRNA随机打断。以片段化的mRNA为模板,合成双链cDNA,并进行纯化。对纯化后的双链cDNA进行末端修复、加A尾、连接测序接头、筛选370~420 bp左右片段、PCR扩增并纯化以获取文库。cDNA文库在Illumina测序平台进行测序。
1.3.4 差异基因(differentially expressed genes,DEGs)表达分析
使用每百万碱基对测序转录本序列片段每千碱基片段的预期数量(fragments per kilobase of exon per million fragments mapped,FPKM)法计算组间及样本间的相关性系数,DEGs筛选标准为|log2差异倍数(fold change,FC)|≥1且错误发现率(false discovery rate,FDR)<0.05[17]。
1.3.5 GO和KEGG富集分析
以进行差异显著分析并注释到基因本体论(Gene Ontology,GO)和京都基因与基因组百科全书(Kyoto Encyclopedia of Genes and Genomes,KEGG)数据库的基因集为背景基因集,差异显著性分析所得到的DEGs注释到GO和KEGG数据库的基因集为DEGs集,运用超几何检验进行GO和KEGG富集分析。GO富集分析以term为单位,确定DEGs在GO中的分布。KEGG富集分析以pathway为单位,找出DEGs显著富集的pathway,并进一步确定DEGs参与的代谢通路及所发挥的生物学作用[18]。
1.3.6 real-time PCR验证相关DEGs
为了验证RNA-seq实验结果的可靠性,选取10个与耐酸相关的DEGs,根据NCBI所公布的鼠伤寒沙门氏菌的基因序列,以16S rRNA为内参基因,Oligo 6.0设计引物,基因名称及引物序列见表1。

表1 real-time PCR基因及引物序列Table 1 Primer sequences used for real-time PCR
1.4 数据处理与统计分析
耐酸能力实验数据采用SPSS 21.0软件的ANOVA法进行单因素方差分析。荧光定量基因表达结果采用Bio-Rad CFX Manager软件进行相对定量分析,使用Microsoft Office Excel软件对real-time PCR和RNA-seq结果进行Pearson相关性分析。实验结果使用Origin 2018软件绘图。实验结果用平均值±标准误表示,P<0.05,差异显著。
2 结果与分析
2.1 酸胁迫对鼠伤寒沙门氏菌耐酸能力的影响
将酸胁迫和非酸胁迫鼠伤寒沙门氏菌在pH 3的强酸条件下进行酸激,其存活率如图1所示,存活率越高,耐酸能力越强。各酸胁迫组的耐酸能力显著高于非酸胁迫组(P<0.05),表明鼠伤寒沙门氏菌经酸胁迫后能够产生ATR,与Lianou[14]和田牧雨[15]等的研究结果一致。经pH 5.4和pH 5.0酸胁迫后的存活率分别为33.33%和36.68%,pH 4.5时存活率高达71.72%,显著高于pH 5.4和pH 5.0(P<0.05)。鲜切番茄和苹果的pH值接近4.5[20],反映了鲜切水果被沙门氏菌污染后其致病风险的增加,为酸性食品实际生产加工过程中沙门氏菌的防控提供理论基础。为了在恶劣环境下存活,鼠伤寒沙门氏菌必须克服许多复杂的环境胁迫,其中酸胁迫是一个重要的影响因素[21]。不同酸胁迫pH值(5.4、5.0和4.5)处理均能够使鼠伤寒沙门氏菌产生ATR,且生鲜牛肉的极限pH值约为5.4,因此选择pH 5.4的酸胁迫条件开展后续RNA-seq。
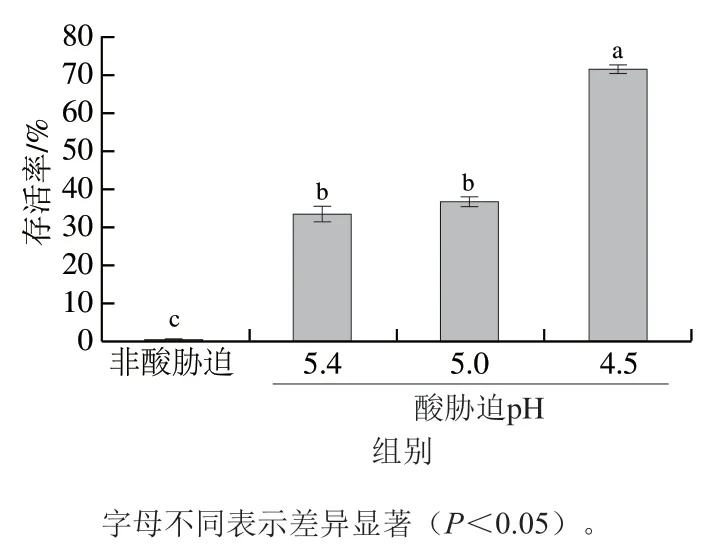
图1 酸胁迫对鼠伤寒沙门氏菌耐酸能力的影响Fig. 1 Effect of acid stress on the acid tolerance response of S. typhimurium
2.2 RNA-seq质量评估及基因组比对结果
RNA-seq数据中,将酸胁迫组及非酸胁迫组原始序列进行过滤剔除低质量数据,得到过滤后序列为原始序列的97.60%~99.00%,其错配率低于0.03%,Q30比率在93.97%~94.88%之间,GC含量均高于53.60%(表2)。酸胁迫处理组及非胁迫对照组的测序数据准确度较高,可以进行下一步数据分析。
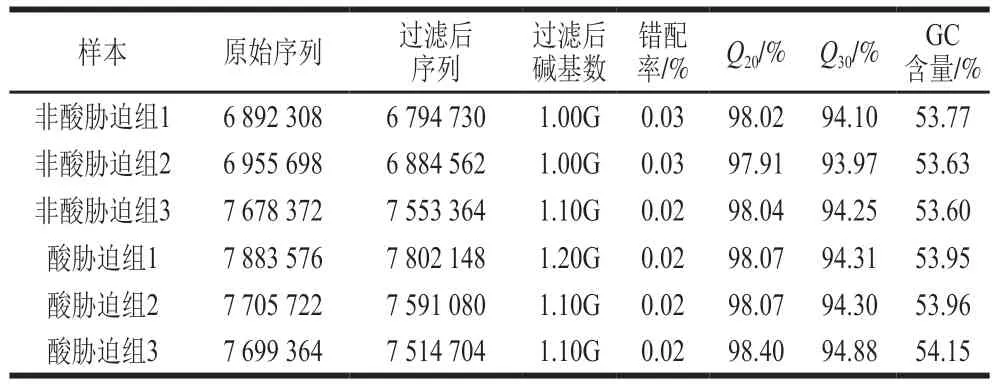
表2 测序数据质量评估Table 2 Quality assessment of sequencing data
2.3 DEGs可视化分析
以|log2FC|≥1且FDR<0.05为标准筛选DEGs。酸胁迫组相对于非酸胁迫组共筛选683个DEGs,其中上调基因343个,下调基因340个(图2),从上述结果中筛选部分耐酸相关DEGs进行后续分析。
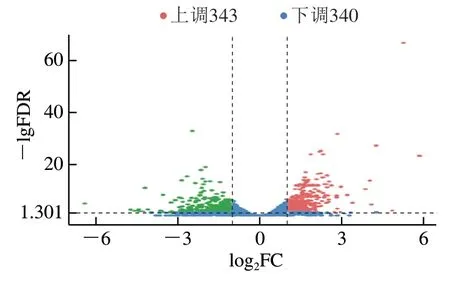
图2 DEGs分析火山图Fig. 2 Volcano plot of DEGs
2.4 DEGs GO富集分析

图3 DEGs GO富集分析Fig. 3 GO enrichment analysis of DEGs
通过Goseq将DEGs注释到GO数据库,得到DEGs可能具有的功能信息,其中GO包括生物过程、细胞组分和分子功能3个维度。如图3所示,经酸胁迫后,DEGs主要富集到生物过程和分子功能。其中生物过程显著富集到运动(GO:0040011)、对外部刺激的反应(GO:0009605)、氧化还原过程(GO:0055114)等,分别富集了19、13个和42个DEGs。分子功能中显著富集到氧化还原酶活性(GO:0016491)、辅因子结合(GO:0048037)等,分别富集到了39个和29个DEGs。细胞组分虽无显著富集的过程,但有较多DEGs富集到膜蛋白复合物(GO:0098796)和细胞质(GO:0005737)中。
2.5 DEGs KEGG富集分析
通过pathway显著性富集得到DEGs参与的信号转导途径,图4为DEGs KEGG富集分析散点图。与非酸胁迫组相比,经酸胁迫后DEGs富集到与全局和总览途径相关的碳代谢(seo01200)、微生物在不同环境中的代谢(seo01120)和次生代谢产物的生物合成(seo01110)等过程,分别富集到28、53个和64个DEGs;与碳水化合物代谢相关的三羧酸循环(tricarboxylic acid cycle,TCA)(seo00020)、磷酸戊糖途径(seo00030)、糖酵解(seo00010)等途径,分别富集到10、13个和8个DEGs;与细胞运动相关的细菌趋化(seo02030)和鞭毛组装(seo02040),分别富集到14个和18个DEGs;与氨基酸代谢相关的谷胱甘肽代谢(seo00480)、甘氨酸、丝氨酸和苏氨酸的代谢(seo00260),分别富集到9个和10个DEGs。其他氨基酸代谢如精氨酸和脯氨酸代谢(seo00330)、组氨酸代谢(seo00340)等途径虽无显著富集,但仍有较多DEGs表达上调。

图4 DEGs KEGG富集分析Fig. 4 KEGG enrichment analysis of DEGs
2.6 DEGs real-time PCR验证
结合RNA-seq结果选取10个与耐酸相关的DEGs,以16S rRNA为内参基因,对其进行real-time PCR验证。real-time PCR测定结果与RNA-seq的基因表达趋势一致,Pearson相关系数为0.98,验证了RNA-seq结果的可靠性(图5)。其中与赖氨酸代谢相关的cadA、细胞膜组成相关的ompC、鞭毛组装相关的fliC、细菌趋化相关的cheA、交叉保护相关的katG和oxyR以及双组分调控系统相关的pmrA表达上调,其他耐酸相关nlpD、rpoS和mgtA表达下调,表明鼠伤寒沙门氏菌耐酸能力的产生受到多个基因多条通路的调节。
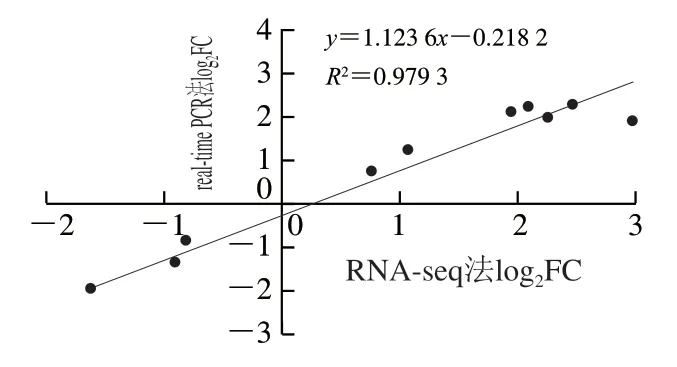
图5 real-time PCR和RNA-seq相关性分析Fig. 5 Correlational analysis between real-time PCR and RNA-seq
2.7 鼠伤寒沙门氏菌耐酸能力的影响机制
近年来,利用RNA-seq从分子水平上揭示细菌的耐酸机制已成为重要的研究方向之一。鼠伤寒沙门氏菌作为备受世界关注的食源性致病菌,经弱酸环境胁迫后,在致死酸环境下的存活率显著升高,这可能是细菌内部抵御应激环境的防御系统表达所致。为此,本研究根据RNA-seq相关DEGs,结合KEGG pathway富集分析和GO功能注释分别从氨基酸代谢、细胞膜组成、细菌趋化与鞭毛组装、能量代谢、碳水化合物代谢、交叉保护和毒力基因的调控7个方面系统分析影响酸胁迫鼠伤寒沙门氏菌耐酸能力的相关机制(图6)。
2.7.1 氨基酸代谢系统
鼠伤寒沙门氏菌经酸胁迫后赖氨酸代谢系统被激活,赖氨酸脱羧酶基因cadA和赖氨酸-尸胺转运蛋白基因cadB表达上调,其log2FC分别为2.94和2.97(图6)。当赖氨酸代谢系统激活后,cadA编码赖氨酸脱羧酶使赖氨酸分解为尸胺同时消耗1个质子,cadB编码尸胺转运蛋白将脱羧产物运出,维持细胞稳定的pH值。Hu Shuangfang等[22]在大肠杆菌O157:H7中研究表明,cadA和cadB介导的赖氨酸脱羧作用,能够消耗胞内多余的质子,保持胞浆稳定的pH值,从而提高菌株的耐酸能力。
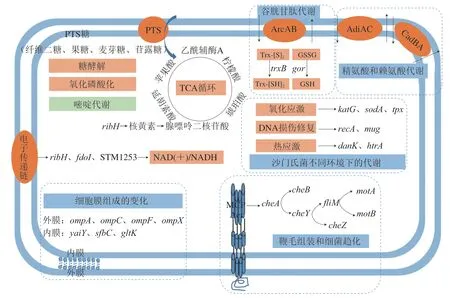
图6 鼠伤寒沙门氏菌耐酸机制Fig. 6 Acid tolerance response mechanism of S. typhimurium
此外,经酸胁迫后谷胱甘肽代谢(seo00480)相关基因的表达也出现了变化。谷胱甘肽是细胞活性氧的主要拮抗分子,有两种存在形式,分别为氧化型谷胱甘肽(oxidized glutathione,GSSG)和还原型谷胱甘肽(reduced glutathione,GSH),GSH在谷胱甘肽-S-转移酶和谷胱甘肽过氧化物酶作用下保护细胞使其免受氧化损伤[23]。与非酸胁迫组相比,经酸胁迫后arcA/B上调了gor(谷胱甘肽还原酶)和trxB(硫氧还蛋白还原酶)的表达,其log2FC分别为1.34和0.95(图6)。这表明鼠伤寒沙门氏菌在酸胁迫过程中经历了氧化损伤,并上调抗氧化相关基因修复酸胁迫造成的细胞损伤,以促进其在酸环境下的生存能力。Morales等[24]研究表明,鼠伤寒沙门氏菌ΔarcA缺失株经H2O2处理后,其gor和trxB酸环境转录水平较低,导致二硫键形成增加、蛋白质失活,抗氧化能力显著降低,最终造成细胞死亡。同时,糖酵解和磷酸戊糖途径能够提供NADPH,NADPH也是维持硫氧还蛋白和还原型谷胱甘肽的关键因子[25]。编码其他氨基酸代谢途径的基因也受到差异调节,特别是脯氨酸、甘氨酸、丝氨酸以及苏氨酸,这些代谢途径的上调也表明鼠伤寒沙门氏菌在酸胁迫过程中需要大量的营养。
2.7.2 细胞膜组成
HCl由离子的形式存在,主要通过破坏细胞膜及胞内酶对细菌造成伤害[26]。当细胞处于酸性环境中时,细胞膜的完整性和质子动力被破坏,细胞膜功能损伤,导致胞内质子过多,抑制细菌生长。此时鼠伤寒沙门氏菌外膜组分相关基因ompA、ompC、ompF、ompW和ompX显著上调,其log2FC分别为1.86、2.45、1.17、1.15和1.42;内膜组分相关基因yaiY、sfbC、gltK以及其他膜蛋白相关基因yoaE也呈现不同程度的上调,其log2FC分别为1.60、1.31、1.42和1.43(图6)。细胞膜损伤后,沙门氏菌上调细胞膜结构相关基因的表达,进一步增强鼠伤寒沙门氏菌的耐酸能力。其他研究也报道了酸胁迫造成细胞膜损伤,Bai Hong等[27]研究表明苹果汁产生的酸性环境造成细胞膜损伤后编码膜蛋白的相关基因表达上调,其耐酸能力得到增强;李琳琼等[28]使用柠檬酸对鼠伤寒沙门氏菌进行多次酸胁迫后发现其细胞膜磷脂的相变温度升高,细胞膜流动性降低,部分膜蛋白表达量及表达种类增加,促进菌株对酸环境的适应。
2.7.3 细菌趋化与鞭毛组装
当鼠伤寒沙门氏菌感受到酸胁迫后,甲基化受体趋化蛋白相关基因trg、tcp、cheM、tsr、STM3216和STM3152和Aer传感器相关基因aer表达显著上调,其log2FC分别为2.31、2.46、1.84、1.94、1.66、1.33和2.09(图6)。此时,趋化相关基因cheA(log2FC为1.93)识别到外界酸胁迫,将其磷酸基转移到cheB(log2FC为2.30)或cheY(log2FC为2.22)同源反应调节因子,磷酸化的cheY将化学信号传递至鞭毛马达fliM[29],fliM(log2FC为0.89)进一步促进鞭毛动力相关的motA(log2FC为0.76)和motB(log2FC为0.72)表达[30](图6)。而有研究表明,当单核细胞性李斯特菌暴露于胃液的强酸环境下时,其细胞运动相关基因的表达受到抑制[31];阪崎肠杆菌在缺乏氨基酸的M9培养基中生长时,与鞭毛形成和趋化相关的基因下调[32]。这可能是细胞运动需要消耗大量能量[33],而当菌株暴露于极端环境中时,鞭毛形成和趋化性等代谢活动降低,用以维持菌体的其他必需代谢活动,同时也可能与菌种的不同相关。
2.7.4 能量代谢调控
为了适应恶劣的生存环境,鼠伤寒沙门氏菌的磷酸转移酶系统(seo02060,phosphortransferase system,PTS)相关基因呈现不同程度上调。PTS系统是鼠伤寒沙门氏菌碳水化合物积累的主要机制之一,经酸胁迫后ptsI、ptsH、fruF和fruK等基因表达上调,其log2FC分别为0.66、1.10、1.49和1.27。PTS系统包含两个胞质磷酸转移酶(酶I和组氨酸磷酸载体蛋白)及糖特异性酶II复合物,其中ptsI编码酶I、ptsH编码组氨酸磷酸载体蛋白。当磷酸化的酶I将磷酸基团转移到组氨酸磷酸载体蛋白上时,磷酸化的组氨酸磷酸载体蛋白又会将磷酸基团传递到细菌中的糖特异性酶II复合物中[34]。最终被转运的碳水化合物经磷酸化转化为糖酵解、磷酸戊糖或TCA途径的磷酸化中间体,这也使得PTS成为高效的传感器和快速的信号转导系统[35-36]。而鼠伤寒沙门氏菌嘧啶代谢(seo00240)中cmk、yeiA以及nrdA等基因表达下调,其log2FC分别为-1.45、-1.00和-1.11,这可能是菌体为降低能量消耗,以维持其他必要代谢途径的方式[37]。
呼吸电子传递链(GO:0022904)中nuoK和fdoI表达上调,其log2FC分别为1.17、0.59,呼吸链活性的增加使得NADH氧化生成更多的NAD+,NAD+/NADH比率的提高能够调节细胞内质子水平[38]。同时,经酸胁迫后氧化磷酸化(seo00190)相关亚基表达上调,如琥珀酸脱氢酶亚基sdhA(log2FC为1.10)和NADH脱氢酶亚基(nuoN、nuoG、nuoF、nuoK、nuoL、nuoJ,log2FC分别为1.14、1.10、1.18、1.17、1.06和1.20),促进了ATP的合成,并消耗了NADH。编码“物质跨膜转运相结合”的基因表达下调,具体而言,经酸胁迫后编码质子转运ATP合酶的相关基因atpI、rho和atpB显著下调,其log2FC分别为-1.75、-1.32和-1.33。当ATP合酶相关基因下调时,能够减少质子进入菌体内部,从而在一定程度上提高鼠伤寒沙门氏菌的耐酸能力。如果ATP合酶再次将H+离子导入细胞,呼吸链将质子泵出胞浆的效率将在一定程度上被降低。因此,编码ATP合酶的基因下调可以看作是呼吸链消耗质子,以此提高菌株对酸环境的适应[31]。
2.7.5 碳水化合物代谢
在本研究中,与非酸胁迫组相比,酸胁迫组中TCA(seo00020)的相关酶,如苹果酸脱氢酶、异柠檬酸脱氢酶、延胡索酸酶和乌头酸酶编码基因mdh、icdA、fumC及acnA表达上调,其log2FC分别为1.22、0.88、1.47和1.33,促进了TCA循环的进行,并在有氧条件下产生大量ATP及NADPH。ribH(log2FC为0.99)和2-氧羧酸代谢通路(seo01210)相关基因的上调能够促进乙酰辅酶A的消耗,降低蛋白质乙酰化水平,防止酸胁迫下细胞内pH值进一步下降[12]。TCA循环还能为某些氨基酸在内的多种化合物提供前体[39]。糖酵解(seo00010)是将葡萄糖转化为丙酮酸并释放出能量的过程,经酸胁迫后,参与糖酵解途径的有8个基因显著上调,这表明糖酵解途径参与了鼠伤寒沙门氏菌酸胁迫的适应过程。
2.7.6 交叉保护反应调控
经酸胁迫后,鼠伤寒沙门氏菌在不同环境中的代谢(seo01120)53个DEGs表达显著上调。当细菌在酸性环境中培养时,细胞膜、蛋白质及DNA都会受到一定程度的损伤[28]。为了减少损伤,鼠伤寒沙门氏菌会增加修复和防御相关基因的表达(图6),如DNA复制和修复相关基因recA(log2FC为1.02),保护大分子使其免受损伤。与耐热相关的基因danK、htrA(log2FC分别为1.34和1.02)也表现出一定程度的上调,dnaK参与蛋白质的复性或分解,并且通过减少错误折叠蛋白质的聚集和促进蛋白质水解防止包涵体的形成[40]。另外Spiess等[41]报道htrA能降低肠炎沙门氏菌面临高温环境时细胞质中错误折叠蛋白的积累及蛋白质损伤。因此,鼠伤寒沙门氏菌经酸胁迫后,与高温抗性相关基因的上调为其耐热性的提高提供了理论支持[42]。oxyR(log2FC为1.06)可以感受氧化胁迫并参与过氧化物代谢和氧化胁迫防御相关基因(katG和sodA其log2FC分别为2.24和0.98)的调控,katG负责编码过氧化氢酶,对鼠伤寒沙门氏菌在强氧化环境下的存活至关重要。
2.7.7 对毒力基因的影响
外膜蛋白作为一种结构性毒力因子,其相关基因(详见2.7.2节)表达量的增加会使细菌的毒力增强,侵入巨噬细胞的沙门氏菌还会形成包含小泡(Salmonellacontaining vacuole,SCV),借助SPI-2产生效应蛋白,阻止SCV与溶酶体融合,以此逃避吞噬作用的杀伤[43]。Chowdhury等[44]研究表明,ompA缺失的鼠伤寒沙门氏菌在小鼠巨噬细胞感染后期激活了宿主巨噬细胞的自噬,其毒力比野生株明显降低。鞭毛合成因子(fliC、flgL、flgK、fliK、fliY和fliM,其log2FC分别为2.07、2.11、1.93、2.07、1.49和0.89)表达上调除了增强运动与趋化能力外,其毒力及黏附入侵能力也显著提高,以帮助鼠伤寒沙门氏菌定植于食物表面或入侵宿主细胞,增加对不利环境的抵抗能力。Choi等[45]研究表明,阪崎肠杆菌的mcp突变体对小鼠上皮细胞的侵袭和黏附能力减弱,在小鼠体内的毒力减弱。
PmrA/PmrB组分系统是鼠伤寒沙门氏菌重要的双组分调控系统,pmrA(log2FC为0.96)表达上调不仅参与酸环境的适应,还能够调控沙门氏菌的毒力,对脂多糖的修饰有重要作用。脂多糖位于细胞膜外膜的最表面,主要由类脂A、核心多糖和侧链多糖(O抗原)组成,在细菌定植、入侵宿主细胞以及抵御巨噬细胞吞噬作用时起到重要的自我保护作用[46]。Hua Jingjing等[47]研究表明,阪崎克罗诺肠杆菌pmrA过表达促进了类脂A的磷酸乙醇胺修饰。在低pH值条件下生长时,磷酸乙醇胺与类脂A结合可以增加对cAMP的抵抗力,并降低宿主固有免疫系统的识别力和杀伤力[48]。与O抗原生物合成酶相关的rfb基因簇(rfbB、rfbD、rfbH、rfbU和rfbI,其log2FC分别为-1.61、-1.24、-1.11、-0.90和-0.87)和rfa基因簇(rfaI、rfaG和rfaJ,其log2FC分别为-1.37、-1.77和-1.05)相关基因的表达一定程度上下调。而Bai Hong等[49]研究表明,酸应激后肠炎沙门氏菌与毒力相关的rfa、rfb和rfc基因簇相关基因表达上调,与本研究结果相反,这可能与不同血清型的菌株相关,其结果仍有待进一步研究。
鼠伤寒沙门氏菌外膜蛋白和鞭毛相关基因表达上调,促进了菌株的运动、趋化和细胞膜的稳定性并增强了毒力,其在酸胁迫下毒力基因高表达的趋势,揭示了人们摄入被沙门氏菌污染的含酸食品会增加其致病性风险。
3 结 论
利用RNA-seq技术分析了鼠伤寒沙门氏菌酸胁迫后的基因表达变化。在这683个DEGs中,其中上调基因343个,下调基因340个。酸性环境使得鼠伤寒沙门氏菌胞质内质子过多,为了平衡多余的质子,细胞内NAD+/NADH的比值升高,TCA促进乙酰辅酶A的消耗降低蛋白质乙酰化水平,同时降低ATP合酶的活性。鼠伤寒沙门氏菌的运动能力增强,一些功能基因包括应激反应调控蛋白、膜转运蛋白的上调以修复酸胁迫带来的损伤,促进细胞存活。碳水化合物代谢和PTS等产能系统上调,一些消耗能量的代谢过程下调,以维持细胞膜损伤、DNA损伤修复等必要过程提高鼠伤寒沙门氏菌的耐酸能力。最后,与毒力相关的鞭毛、外膜蛋白以及双组分系统等相关基因的表达上调揭示了鼠伤寒沙门氏菌在酸性环境下致病风险的增加。

