硒化猴头菇多糖的制备、结构表征及抗增殖活性
古佩娴,尹惠双,胡 坤,吴小勇,钟南京,郭 娟,黄 超,胡 勇,陈 云,王 颖,伍芳芳,*
(1.广东药科大学食品科学学院,广东 中山 528458;2.华南理工大学食品科学与工程学院,广东 广州 510641)
猴头菇(Hericium erinaceus),属于担子菌纲、多孔菌目、齿菌科、猴头属,又名猴头、猴头菌、猴头蘑等,是我国传统的食药两用真菌[1-2]。猴头菇与鱼翅并称“山珍猴头、海味燕窝”,不仅味道鲜美可口,还含有丰富的营养成分,如多糖、蛋白质、低聚糖、维生素、糖蛋白等[3-4]。作为猴头菇的主要功能成分之一,多糖具有调节机体免疫力、抗病毒、调节肠道菌群、降血糖、抗衰老、抗氧化、保护胃黏膜等生物活性[5-10],目前已成为国内外众多领域的研究热点[11]。
本课题组前期以猴头菇子实体为原料,采用水提醇沉、Sevag去蛋白、柱层析、透析、真空冷冻干燥等工艺得到了纯化多糖组分(猴头菇纯化多糖(Hericium erinaceuspolysaccharide,HEPS),总糖含量>92%),对其单糖组成、平均分子质量、单糖残基类型、糖苷键连接方式等进行了测定,初步得到了HEPS的结构特征,同时对其免疫调节活性进行了研究[12]。前期研究表明HEPS具有毒副作用小、安全性高等优点,同时能有效促进小鼠脾淋巴细胞的增殖,与脂多糖、伴刀豆球蛋白对B淋巴细胞以及T淋巴细胞产生协同刺激作用,并能显著增强小鼠巨噬细胞的免疫功能[12]。大量研究证实,绝大多数真菌多糖并不是直接杀伤肿瘤细胞,而是通过激活免疫细胞,增强患者的免疫防御系统而达到抗癌的效果[13]。同时,由于组成多糖的糖链上存在大量的羟基,这使多糖很容易与金属离子形成共价配合物,呈现出更多的功能特性[13]。近年来,越来越多的研究表明硒化改性可显著提高活性多糖对癌细胞的直接杀伤作用[14]。
硒(Se)是维持人体正常生命活动的必需微量元素之一,参与维持机体的健康与生长发育,在日常膳食中缺乏硒会增加机体心血管疾病、糖尿病等的发生风险。同时,硒还具有“抗癌之王”之称,对多种癌细胞均具有明显的杀伤作用[13]。但无机硒的使用剂量比较难控制,容易引起机体中毒或者遗传毒性,这大大限制了其应用。相关研究利用抗环血酸(VC)还原亚硒酸钠制备出红色的单质硒(纳米硒),因其具有较高的生物活性及低毒性迅速成为硒补充领域的研究热点[15]。但由于这种红色的单质硒具有很高的表面能,非常不稳定,极易转变成黑色或灰色的单质硒而失活。多年来,为构建高稳定且高生物活性的纳米硒,研究者一直在尝试寻找合适的生物分子模板(稳定剂、分散剂)[16]。大量研究表明,天然多糖具有高稳定性、低毒性、结构可控、生物可降解等优点,是一种极具潜力的生物分子模板[13-14,17]。
因此,本实验以HEPS为研究对象,在含有VC和亚硒酸钠的氧化还原体系中,制备得到猴头菇多糖纳米硒颗粒(HEPS-Se)。采用原子吸收分光光谱仪、傅里叶变换红外光谱仪、X射线衍射仪、扫描电子显微镜、EDX元素分析仪、X射线光电子能谱、纳米粒度仪对其结构进行表征;并研究HEPS-Se对人肺癌细胞A549、人前列腺癌细胞DU145的抗增殖作用。为猴头菇多糖的开发应用提供一定的理论基础。
1 材料与方法
1.1 材料与试剂
猴头菇子实体原料来自于福建省屏南县。人肺癌细胞A549、人前列腺癌细胞DU145、人正常肝细胞LO2中山大学医学院;亚硒酸钠(>97%) 天津市化学试剂公司;VC、二甲基亚砜(均为分析纯) 美国Sigma公司;溴化钾(色谱纯)、硝酸(分析纯) 国药集团化学试剂有限公司;DMEM高糖培养基、MEM培养基、磷酸盐缓冲液(pH 7.4)、胰蛋白酶(Trypsin)、青霉素与链霉素混合液(×100)、胎牛血清美国Gibco公司;CCK-8试剂盒 日本同仁化学研究所。其他试剂均为分析纯。
1.2 仪器与设备
LGJ-10冷冻干燥机 北京松源华兴科技发展有限公司;HJ-6A磁力加热搅拌器、HH-4数显恒温水浴锅 常州普天仪器制造有限公司;JW-3021HR高速冷冻离心机安徽嘉文仪器装备有限公司;Affinify-1傅里叶红外光谱仪、UV-1800紫外-可见分光光度计、AA-7000原子吸收分光光度计 日本岛津公司;DHG-9070电热恒温鼓风干燥箱 上海精宏实验设备有限公司;RE-52AA旋转蒸发器 上海亚荣生化仪器厂;D8 ADVANCE X射线多晶衍射仪 德国Bruker公司;Nano-ZS激光粒度分析仪英国Malvern仪器有限公司;EVO-18扫描电子电镜德国Zeiss公司;Axis Ultra DLD X射线光电子能谱仪英国Kratos公司。
1.3 方法
1.3.1 HEPS-Se的制备
HEPS按照Wu Fangfang等[12]方法:即采用水提醇沉、Sevag去蛋白、DEAE Sepharose fast flow柱层析及Sephadex G-100柱层析、透析、冷冻干燥等工艺所制得。HEPS的总糖含量大于92%。
HEPS-Se的制备参照Liao Wenzhen等[13]的方法并稍作改动。将新鲜配制的20 mL,3 mg/mL的HEPS溶液与20 mL,0.1 mol/L亚硒酸钠溶液旋涡混匀后,置于25 ℃环境中磁力搅拌10 min后,在保持磁力搅拌的情况下,用注射针慢慢加入5 mL,0.4 mol/L VC溶液。置于25 ℃环境中磁力搅拌24 h。将反应液转移至3.5 kDa透析袋中透析,每3 h换一次蒸馏水。通过VC检测透析液直至无红色时停止透析,收集截留液,经浓缩、冷冻干燥即为硒化纯化多糖HEPS-Se样品。
1.3.2 Se含量的测定
采用原子吸收分光光度计对样品中的硒离子含量进行测定,称取适量的HEPS-Se样品,加入5 mL硝酸溶液并进行消化处理,酸赶净后转移至10 mL容量瓶中定容后进行分析,采用内标法测定复合物中的硒含量,以HEPS为样品空白对照。
1.3.3 HEPS-Se的粒径分布和Zeta电位
准确配制10 mL、1 mg/mL的硒化多糖溶液,充分溶解后,采用马尔文纳米粒度仪测定其粒度分布和Zeta电位分析,以HEPS为样品空白对照。每个样品重复3次。
1.3.4 傅里叶变换红外光谱测定
分别取少量样品与适量的KBr干燥粉末混合,在玛瑙研钵中充分研磨后,在油压机上压成透明薄片,将薄片放入红外光谱仪中进行扫描,扫描范围为4 000~400 cm-1,分辨率为4 cm-1[18]。
1.3.5 X射线衍射测定
HEPS、HEPS-Se的晶体结构由X射线多晶衍射仪测得,测定参数为:Cukα辐射、2θ扫描范围4°~50°、管流40 mA、管压40 kV、扫描速率4 °/min[19]。
1.3.6 扫描电子显微镜观察
采用扫描电子显微镜观测猴头菇多糖HEPS、HEPS-Se的形貌。分别取冷冻干燥后的HEPS、HEPS-Se样品,取少量样品将其均匀地分散在导电双面胶上,使其固定在样品台上,将其放入离子溅射镀膜仪中,在真空环境中将其表面喷金以屏蔽离子的干扰,设置扫描电子显微镜的镀金条件为10 kV、15 mA,分别使用不同的放大倍数观察猴头菇多糖HEPS、HEPS-Se的形貌。
1.3.7 EDX元素测定
将真空冷冻干燥后的样品用导电双面胶均匀粘在载物台上,用X射线分析装置进行分析。
1.3.8 X射线光电子能谱测定
将真空冷冻干燥后的样品用导电双面胶均匀粘在样品台上,设置检测条件为:激发源Al Kα射线,束斑400 μm,对样品表面进行X射线光电子能谱扫描。采用Thermo ScientificTMAvantage软件对全谱图进行分析及分峰拟合,以C 1s=284.80 eV结合能为能量校正标准。
1.3.9 HEPS-Se对A549、DU145、LO2细胞存活率的影响
选用人肺癌细胞A549、人前列腺癌细胞DU145、人正常肝细胞LO2均置于37 ℃、5% CO2培养箱中培养,A549与LO2所用的培养基为含有10%胎牛血清,100 U/mL青霉素与100 μg/mL链霉素的DMEM高糖完全培养基。DU145所用的培养基为含有10%胎牛血清,100 U/mL青霉素与100 μg/mL链霉素的MEM培养基。
本实验采用cck-8法考察不同质量浓度的HEPS及HEPS-Se对A549、DU145、LO2细胞增殖能力的影响[20-21]。将处于对数生长期的各细胞系用胰蛋白酶消化后,以每孔3×103个的密度接种于96 孔细胞培养板中,置于CO2培养箱中继续培养使细胞重新贴壁。24 h后弃去培养液,实验组加入100 μL不同质量浓度(125、250、500、1 000 μg/mL)的HEPS-Se悬液,空白对照组分别加入100 μL DMEM培养基(A549、LO2细胞)或MEM培养基(DU145细胞),每组设3个平行孔。置于培养箱中继续培养48 h后,往每个细胞培养孔加入10 μL cck-8溶液,轻轻混匀后置于CO2培养箱中继续培养1 h,置于酶标仪中测定450 nm处的OD值。设实验组的OD值为A,空白对照组OD值为B,细胞存活率/%=A/B×100。
1.4 数据统计分析
2 结果与分析
2.1 Se元素含量
通过火焰原子吸收光谱法测得HEPS-Se中Se元素的含量为481.79 μg/g,而HEPS无Se元素检出,说明HEPS在VC和亚硒酸钠的氧化还原体系中,成功制备出HEPS-Se。
2.2 粒径与电位分析

表1 HEPS和HEPS-Se的粒径与电位分析Table 1 Particle sizes and zeta potentials of HEPS and HEPS-Se
如表1所示,在相同浓度下,HEPS-Se的粒径比HEPS降低了49.01%。有研究表明,粒径越小越容易被机体吸收并发挥生物活性。为了进一步考察HEPS-Se的稳定性,测定复合物粒子表面的Zeta电位。HEPS的Zeta电位为-13.00 mV,而HEPS-Se的Zeta电位为-42.10 mV,电位绝对值提高了69.12%,此结果与Liao Wenzhen等[13]的研究结果一致,表明复合物形成后,HEPS表面的羟基发生电离,使HEPS-Se表面带的负电荷大大增加,稳定性显著增强。上述结果也表明HEPS-Se制备成功。
2.3 傅里叶变换红外光谱分析
如图1b所示,3 400.39 cm-1附近比较宽的强吸收峰是由于HEPS-Se上的O—H伸缩振动引起的,2 913.38 cm-1以及1 727.19 cm-1处的弱吸收峰分别为C—H伸缩振动峰以及C=O伸缩振动峰[22-23]。1 620.15 cm-1处吸收峰是由于C—H伸缩振动以及结合水引起的[13]。综合来看,HEPS-Se中大部分的吸收峰与HEPS无明显变化,表明HEPS的基本骨架没有发生变化。然而,与HEPS相比,多糖纳米硒表面的OH伸缩振动峰发生蓝移现象(从3 326.12 cm-1移位至3 400.39 cm-1),并且C=O伸缩振动峰从1 641.36 cm-1移位至1 620.15 cm-1,提示猴头菇多糖的—OH、—C=O等基团与被还原后的纳米硒相结合,从而有效地阻止纳米硒进一步的结合与聚集,最终形成稳定的多糖纳米硒颗粒[13,24-25]。
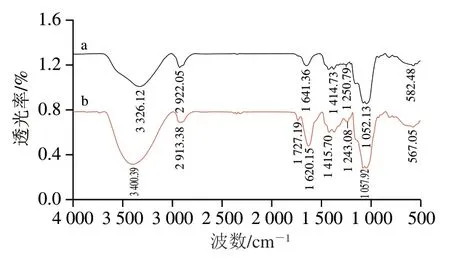
图1 HEPS(a)、HEPS-Se(b)的红外光谱图Fig. 1 FTIR spectra of HEPS (a) and HEPS-Se (b)
2.4 X射线衍射分析
由图2可知,在2θ为10°~90°范围内,HEPS与HEPS-Se复合物的X射线衍射强度曲线相似,均只有一个峰形圆顿、峰强度较低的衍射峰,最高峰分别出现在2θ为19.68°与22.23°附近,说明HEPS与HEPS-Se复合物的结晶度均较低,不能形成单晶,而是以无定型形态存在,也说明两者的分子刚性较差,这与其他真菌多糖的研究结果一致[24]。
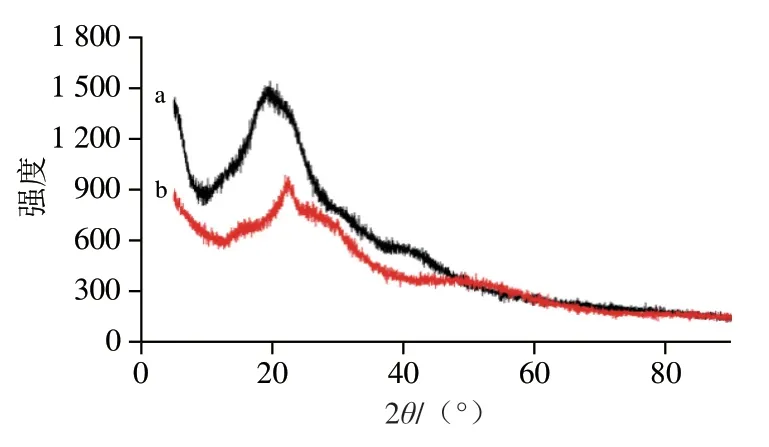
图2 HEPS(a)、HEPS-Se(b)的X射线衍射图Fig. 2 XRD spectra of HEPS (a) and HEPS-Se (b)
2.5 扫描电子显微镜分析

图3 HEPS(A)、HEPS-Se(B)的扫描电镜图(×10 000)Fig. 3 SEM images of HEPS (A) and HEPS-Se (B) (× 10 000)
从图3A可以看出,经过一系列纯化工艺得到的HEPS多糖链相互扭转、缠绕成团,并交织弯曲成形成连续的网状结构,这与猴头菇水洗多糖组分的链构象相一致[26],表明HEPS在溶液中以柔性链构象存在,分子整体不具有刚性,此结果与X射线衍射的结果一致,这可能与多糖结构中存在的α-(1→3,4)-、α-(1→6)-、β-(1→2)-糖苷键有关[27]。然而,硒化改性后,HEPS-Se的形貌特征发生较大的变化,如图3B所示,HEPS-Se为形貌规则、球体均一,粒径之间大小相近,粒子在溶液中呈分散状态使其不容易凝结和聚集,说明HEPS-Se体系的稳定性有所增强。
2.6 EDX表面元素分析
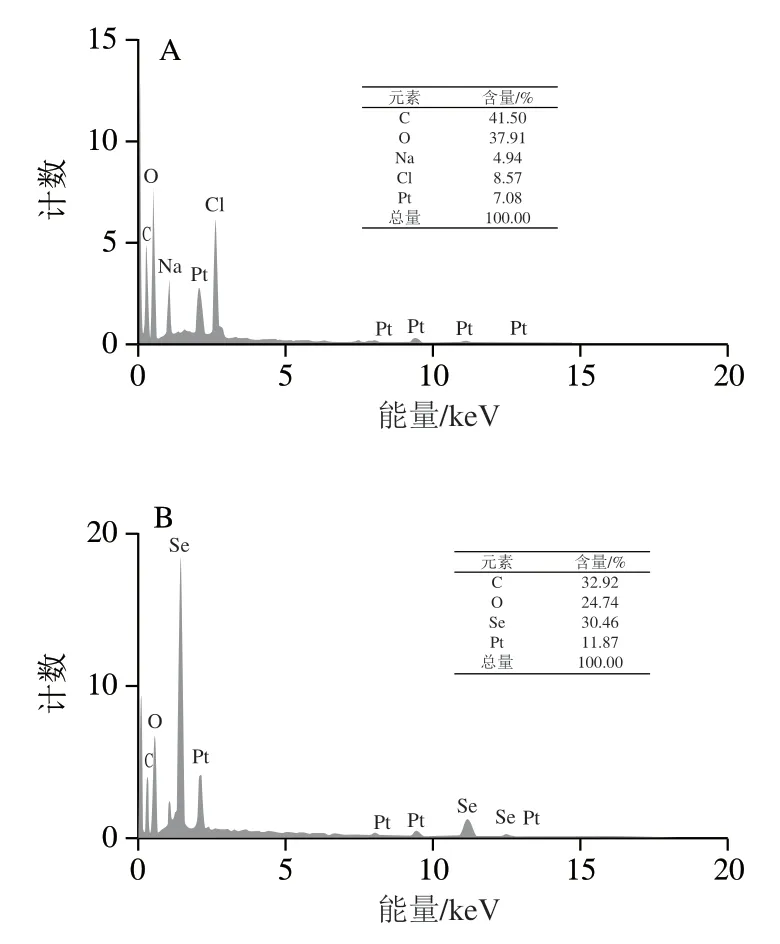
图4 HEPS(A)和HEPS-Se(B)的元素分析Fig. 4 EDX spectra of HEPS (A) and HEPS-Se (B)
通过对HEPS和HEPS-Se的元素进行分析可知(图4),HEPS的元素组成比例为C∶O∶Na∶Cl∶Pt=41.50∶37.91∶4.94∶8.57∶7.08,其中少量的Na元素和Cl元素是由于洗脱过程中使用了大量的0.05 mol/L NaCl洗脱液,有少量残留。而低剂量的Pt元素是由于扫描电子显微镜-EDX操作时,会在真空环境下将其表面喷金而残留少量的Pt,C元素和O元素均来自于HEPS。而HEPS-Se的元素组成比例为C∶O∶Se∶Pt=32.92∶24.74∶30.46∶11.87,同样地,其中的C元素和O元素来自于HEPS,除了制备样品喷金造成少量的Pt元素残留,并无其他杂质元素出现,说明HEPS-Se制备成功,纯度很高。
2.7 X射线光电子能谱分析
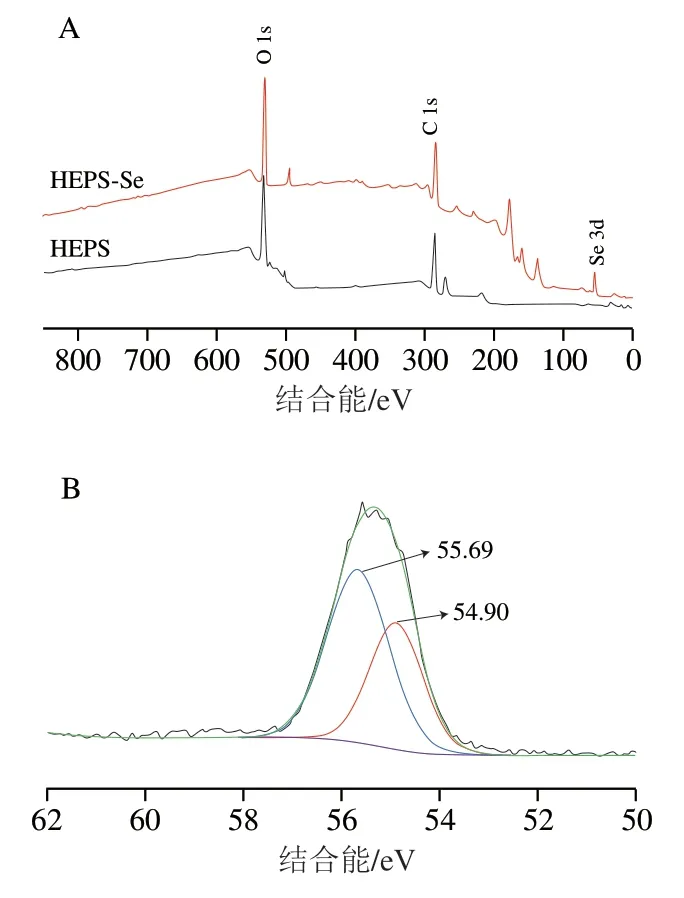
图5 HEPS和HEPS-Se的X射线光电子能谱全谱图(A)以及HEPS-Se的Se 3d分峰拟合图(B)Fig. 5 Wide-range XPS spectra of HEPS and HEPS-Se (A) and Se 3d spectra of HEPS-Se (B)
为了判断样品中Se元素的结合价态,采用X射线光电子能谱对HEPS及HEPS-Se样品进行全谱扫描,结果如图5所示。HEPS的X射线光电子能谱图中最强光电子线主要有C 1s和O 1s峰,这与EDX的测试结果一致,HEPS-Se的X射线光电子能谱图中除了C 1s和O 1s谱峰外,还在结合能约为55.08 eV处存在Se 3d谱峰,而代表高价态硒的Se 2p,2s和1s轨道均没有检测到光强值(图5A)。通过比对参考文献[28]及Avantage数据库中硒的价态,零价硒(纳米硒)的电子结合能位于54.6~57.5 eV范围内,由此可推断样品中的硒元素是以零价硒(纳米硒)的形式存在。通过对50~62 eV的谱图进行分峰拟合,发现Se 3d的2个拟合峰分别在54.90、55.69 eV处(图5B),进一步说明HEPS-Se样品不存在无机硒,该结果与其他多糖纳米硒的研究结果一致[24,29]。
2.8 抗肿瘤细胞增殖活性
HEPS具有毒副作用小、安全性高等优点,同时能有效促进小鼠脾淋巴细胞的增殖,并能显著增强小鼠巨噬细胞的免疫功能[12]。然而,前期的预实验结果也显示HEPS在所测定的质量浓度梯度(100~5 000 μg/mL)范围内对几种常见的癌细胞(人乳腺癌细胞MCF-7、人肝癌细胞HepG2、人前列腺癌细胞PC3、人宫颈癌细胞Hela等)并未出现显著的抑制作用。为了进一步评价硒化前后猴头菇纯化多糖样品对癌细胞的增值抑制作用,本实验采用cck-8法考察不同质量浓度的HEPS及HEPS-Se对人肺癌细胞A549、人前列腺癌细胞DU145、人正常肝细胞LO2增殖能力的影响[30]。
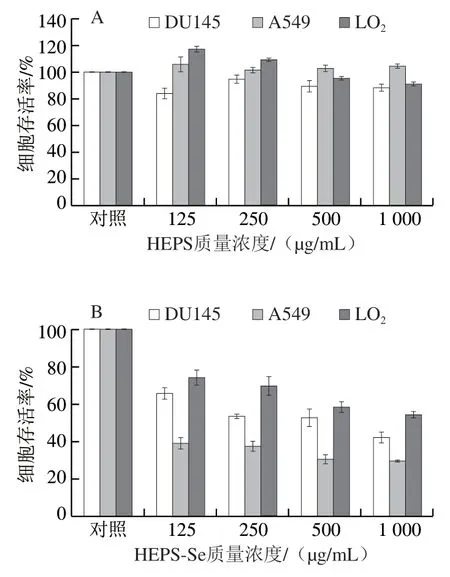
图6 HEPS(A)、HEPS-Se(B)对DU145、A549、LO2细胞的增值抑制作用Fig. 6 Anti-proliferation effects of HEPS (A) and HEPS-Se (B) on DU145, A549 and LO2 cells
从图6A可以看出,与空白对照组相比,HEPS在所测定的质量浓度梯度(125~1 000 μg/mL)范围内对LO2细胞基本无细胞毒性,对DU145细胞和A549细胞的增殖作用均较弱,当HEPS的质量浓度达到最大剂量1 000 μg/mL时,2种癌细胞的存活率分别为88.10%与104.45%。然而,当HEPS硒化处理生成HEPS-Se后,HEPS-Se对2种癌细胞增殖的抑制能力显著提高,并呈现明显的剂量效应相关性(图6B)。与空白对照组相比,当HEPS-Se质量浓度达到500 μg/mL时,DU145细胞和A549细胞的存活率分别为52.73%、30.46%。当其质量浓度由125 μg/mL增加至500 μg/mL,DU145细胞和A549细胞的细胞存活率分别下降了19.84%和22.28%。虽然HEPS-Se对人正常肝细胞LO2的增值也有一定的抑制作用,但是这种作用要比2种癌细胞弱(特别是高浓度时)。该结果表明HEPS-Se对癌细胞具有较显著的抑制能力。研究表明,硒化多糖能够促进死亡结构域相关蛋白FADD的表达,增强Caspase-3、-8和-9的活性,通过死亡受体介导的外源性细胞凋亡通路和线粒体介导的内源性细胞凋亡通路两条途径介导肿瘤细胞的凋亡[13]。结果表明,HEPS-Se对肿瘤的化学预防和治疗方面具有一定的应用潜力,但其作用机制仍有待进一步深入研究。
3 结 论
以HEPS为研究对象,在含有VC和亚硒酸钠的氧化还原体系中,成功制备出HEPS-Se。所制备出的HEPS-Se为形貌规则、均一的球体,其元素组成比例为C∶O∶Se∶Pt=32.92∶24.74∶30.46∶11.87;其中Se元素的含量高达481.79 μg/g,傅里叶变换红外光谱表明猴头菇多糖的—OH、—C=O等基团与被还原后的纳米硒相结合,从而有效地阻止纳米硒间的相互结合与聚集,最终形成稳定的多糖纳米硒颗粒。与HEPS相比,HEPS-Se的粒径显著降低,电位绝对值提高了69.12%。同时,体外抗增殖活性结果表明,HEPS-Se能显著抑制人前列腺癌细胞DU145、人肺癌细胞A549的增值活性,并呈现明显的剂量效应。

