miR-122在乙型肝炎病毒感染小鼠病毒复制与肝功能损伤中的作用*
李 莉,马 红
新疆维吾尔自治区乌鲁木齐市中医医院检验科,新疆乌鲁木齐 830000
乙型肝炎病毒(HBV)感染是全球肝病流行的主要原因,HBV作为一种DNA病毒,属于嗜肝DNA病毒科,通过前基因组RNA反转录复制DNA[1]。HBV感染增加了慢性乙型肝炎、肝硬化和肝细胞癌等疾病的发生风险[2],其中,慢性乙型肝炎对人类健康影响较大,根据世界卫生组织公布的数据,全球约有2.4亿人患有慢性乙型肝炎,其中20%~30%的患者会发展为肝硬化或肝细胞癌,导致患者肝衰竭[3]。目前,抗病毒疗法是治疗HBV感染相关疾病的有效方法。然而,由于停药后复发和一些其他不良反应等影响,使该疗法的应用受到限制[4]。因此,迫切需要阐明HBV感染后的发病机制并探索抑制或消除人体内HBV的新型有效方法。微小RNA(miRNA)是在转录后水平调节基因表达的非编码功能性小RNA分子,长度为21~24个核苷酸,在许多生理和病理过程中发挥重要作用。研究表明,miRNA在HBV感染中发挥作用,在HBV感染期间,病毒复制和表达的产物导致内源性miRNA出现异常表达,并使感染持续存在,从而促进组织或机体损伤[5];然而,宿主细胞内也有一些miRNA,如miR-1231、miR-204和miR-1236[6-7],可通过直接或间接机制抑制HBV的复制和表达。miR-122是在肝内特异性高表达的一种miRNA,约占肝内所有miRNA的70%,在调节肝细胞分化与功能维持中起着关键作用[8]。已有体外研究表明,miR-122能够明显抑制HBV的复制[9],但关于miR-122在体内HBV感染中作用的相关研究较少,为了进一步揭示miR-122对HBV感染后病毒复制的影响,本研究通过构建HBV感染小鼠模型,检测给予miR-122处理后的病毒复制水平变化,并观察其对肝功能损伤的影响,以期为HBV感染性疾病的诊疗研究提供新的思路。
1 材料与方法
1.1实验动物 选择40只无特异病原体(SPF)级C57BL/6小鼠,6~8周龄,体质量20~25 g,雌雄各20只,购自新疆医科大学实验动物中心。小鼠分笼饲养,期间自由进食、饮水,饲养室温维持在 20~25 ℃,相对湿度为40%~60%,每日光照/黑暗各12 h交替。所有小鼠饲喂1周后进行实验。
1.2仪器与试剂 乙型肝炎表面抗原(HBsAg)和乙型肝炎e抗原(HBeAg)酶联免疫吸附试验(ELISA)检测试剂盒购于北京万泰生物药业股份有限公司,肿瘤坏死因子(TNF)-α、白细胞介素(IL)-2及IL-6 ELISA检测试剂盒购于北京索莱宝科技有限公司,Trizol试剂盒购于美国GIBCO公司,TaqMan MicroRNA assay试剂盒购于北京百奥莱博生物科技有限公司,HBV核酸提取试剂盒和HBV-DNA检测试剂盒(PCR-荧光探针法)购于北京索奥生物医药科技有限公司,二氨基联苯胺(DAB)试剂盒和苏木精-伊红(HE)染色试剂盒购于北京百奥莱博生物科技有限公司,Masson染色试剂盒购于上海贝博生物科技有限公司,小鼠抗人乙型肝炎核心抗原(HBcAg)单克隆抗体购于北京博尔西科技有限公司,辣根过氧化物酶标记的山羊抗兔IgG抗体购于英国Abcam公司。rAAV8-1.3HBV重组腺病毒载体购于北京五加和分子医学研究所有限公司,pAV.Ex1d-CMV miR-122慢病毒载体构建与包装均交由生工生物工程(上海)股份有限公司完成。SMT100V便携式全自动生化分析仪购于南京普朗医疗设备有限公司,LabServTMK3型酶标仪购于美国Thermo Fisher Scientific公司,CFX96 Touch实时荧光定量PCR(qRT-PCR)检测系统购于美国BIO-RAD公司,XSP-1200光学显微镜购于上海光学仪器五厂有限公司。
1.3方法
1.3.1动物模型建立与分组 采用随机数字表法将40只小鼠随机分为对照组、HBV组、miR-NC组、miR-122组,每组各10只。除对照组外,其余小鼠均根据文献[10]报道的方法建立HBV感染模型,给予小鼠尾静脉高压注射50 μL rAAV8-1.3HBV重组腺病毒载体(拷贝数5.0×1010copies/mL),5 s内注射完毕。对照组采用同样方法注入等体积磷酸盐缓冲液(PBS)。注射后,miR-NC组小鼠经尾静脉注射50 μL空载体病毒,miR-122组小鼠经尾静脉注射50 μL含miR-122的慢病毒载体,对照组和HBV组分别注射等体积PBS,所有处理结束后将小鼠继续分笼饲养。
1.3.2小鼠血清HBsAg、HBeAg、天门冬氨酸氨基转移酶(AST)及丙氨酸氨基转移酶(ALT)水平检测 各组小鼠处理完毕饲养4周后,全身消毒,经尾静脉取血,静置30 min,以12 000 r/min离心10 min后,收集上清液。各组小鼠血清HBsAg、HBeAg水平检测采用ELISA试剂盒,AST、ALT水平检测采用SMT100V便携式全自动生化分析仪,具体步骤严格参照说明书进行。
1.3.3ELISA检测小鼠血清炎症因子水平 取分离的各组小鼠血清,采用ELISA试剂盒检测血清TNF-α、IL-2及IL-6水平,具体步骤严格参照说明书进行。
1.3.4qRT-PCR检测小鼠肝组织miR-122与血清HBV-DNA水平 取血后,处死各组小鼠并剪开腹腔获取肝组织,在无菌环境下剪碎,加入液氮研磨,采用Trizol试剂盒提取肝组织RNA,反转录合成cDNA,再以cDNA为模板,采用qRT-PCR检测肝组织内miR-122表达水平,以U6作为内参,具体根据TaqMan MicroRNA assay试剂盒说明书操作,反应条件:95 ℃ 5 min;94 ℃ 30 s,55 ℃ 30 s,72 ℃ 60 s,循环30次;72 ℃ 1 min。取各组小鼠血清标本,根据HBV核酸提取试剂盒说明书提取血清DNA,采用qRT-PCR检测HBV-DNA水平,以GAPDH作为内参,根据HBV-DNA检测试剂盒(PCR-荧光探针法)说明书进行检测,反应条件:94 ℃ 2 min;94 ℃ 10 s,60 ℃ 30 s,循环40次。各引物序列如下:miR-122上游引物5′-TGGAGTGTGACAATGGTG-3′,下游引物5′-GTCAGGGTCCGAGG-3′;U6上游引物5′-CTCGCTTCGGCAGCACA-3′,下游引物5′-AACGCTTCAC GAATTTGCGT-3′;HBV-DNA上游引物5′-ACCGACCTTGAGGCATACTT-3′,下游引物5′-GCCTACAGCCTCCTAGTACA-3′;GAPDH上游引物5′-ACCACAGCTCAAGCCATCAC-3′,下游引物5′-TCCACCACCCTGTTGCTAT-3′。
1.3.5免疫组织化学染色法检测小鼠肝组织HBcAg表达情况 取各组小鼠肝组织固定后,常规石蜡包埋,切片,烤箱内烤片,脱蜡水化,利用柠檬酸钠加热修复抗原和0.3%过氧化氢液孵育以封闭过氧化物酶活性,PBS冲洗,10%山羊血清封闭,滴加小鼠抗人HBcAg单克隆抗体(1∶100),4 ℃过夜,滴加对应二抗(1∶1 000)室温孵育1 h。处理结束后用PBS冲洗,DAB显色,予以苏木素染色,脱水透明,中性树胶封片。在光学显微镜下观察染色情况并采集图像,阳性表达为细胞质、细胞核呈棕色至棕褐色。随机选择5个视野,镜下计数总细胞数与HBcAg阳性细胞数,计算HBcAg阳性细胞率。
1.3.6HE染色观察小鼠肝组织病理形态变化 将制备的各组小鼠肝组织切片经脱蜡后浸入梯度乙醇中处理。切片上加入Harris苏木精染色5 min,流水冲洗,滴加1%盐酸乙醇分化数秒,流水冲洗,加入伊红染色3 min,脱水透明,中性树胶封片,在光学显微镜下观察各组小鼠肝组织病理形态并采集图像。
1.3.7Masson染色观察小鼠肝组织纤维化情况 取制备的各组小鼠肝组织切片,脱蜡,再浸入梯度乙醇中处理。切片上加入weigert氏铁苏木精溶液染色10 min,流水冲洗,滴入1%盐酸乙醇分化,流水冲洗,再用Masson染液染色3 min,丽春红酸性品红液染色5 min,1%磷钼酸水溶液处理3 min,苯胺蓝染液染色5 min,采用1%冰醋酸水溶液浸泡后洗涤切片,脱水透明,中性树胶封片,在光学显微镜下观察肝组织内蓝染胶原表达情况并采集图像。

2 结 果
2.1各组小鼠血清HBsAg、HBeAg、AST及ALT水平比较 对照组小鼠血清中未检测到HBsAg和HBeAg,HBV组小鼠血清中均检测到HBsAg和HBeAg,且二者水平较高,由此判断建模成功。HBV组小鼠AST、ALT水平较对照组明显升高,差异有统计学意义(P<0.05);与HBV组比较,miR-122组小鼠血清HBsAg、HBeAg、AST、ALT水平均明显降低,差异有统计学意义(P<0.05),而HBV组和miR-NC组小鼠AST、ALT水平比较,差异无统计学意义(P>0.05),见表1。

表1 各组小鼠血清HBsAg、HBeAg、AST及ALT水平比较
2.2各组小鼠血清炎症因子水平比较 HBV组小鼠血清TNF-α、IL-2及IL-6水平均明显高于对照组,差异有统计学意义(P<0.05);与HBV组比较,miR-122组小鼠血清TNF-α、IL-2、IL-6水平明显降低,差异有统计学意义(P<0.05);HBV组和miR-NC组小鼠血清TNF-α、IL-2及IL-6水平比较,差异无统计学意义(P>0.05),见表2。
2.3各组小鼠肝组织miR-122与血清HBV-DNA水平比较 与对照组比较,HBV组小鼠肝组织miR-122水平明显下降,差异有统计学意义(P<0.05);与HBV组比较,miR-122组小鼠肝组织miR-122水平明显升高,差异有统计学意义(P<0.05);而HBV组和miR-NC组小鼠肝组织miR-122水平比较,差异无统计学意义(P>0.05),见图1A。对照组小鼠血清中未检测到HBV-DNA,检测结果呈阴性;miR-122组小鼠血清HBV-DNA水平较HBV组明显降低,差异有统计学意义(P<0.05);HBV组和miR-NC组小鼠血清HBV-DNA水平比较,差异无统计学意义(P>0.05),见图1B。
表2 各组小鼠血清TNF-α、IL-2及IL-6水平比较
2.4各组小鼠肝组织HBcAg表达情况比较 在对照组小鼠肝组织内未出现着色细胞核或细胞质,而HBV组小鼠肝组织内染色明显加深,HBcAg阳性细胞率较高;与HBV组比较,miR-122组小鼠肝组织染色较浅,HBcAg阳性细胞率明显降低,差异有统计学意义(P<0.05);而miR-NC组与HBV组HBcAg阳性细胞率比较,差异无统计学意义(P>0.05),见图2、3。
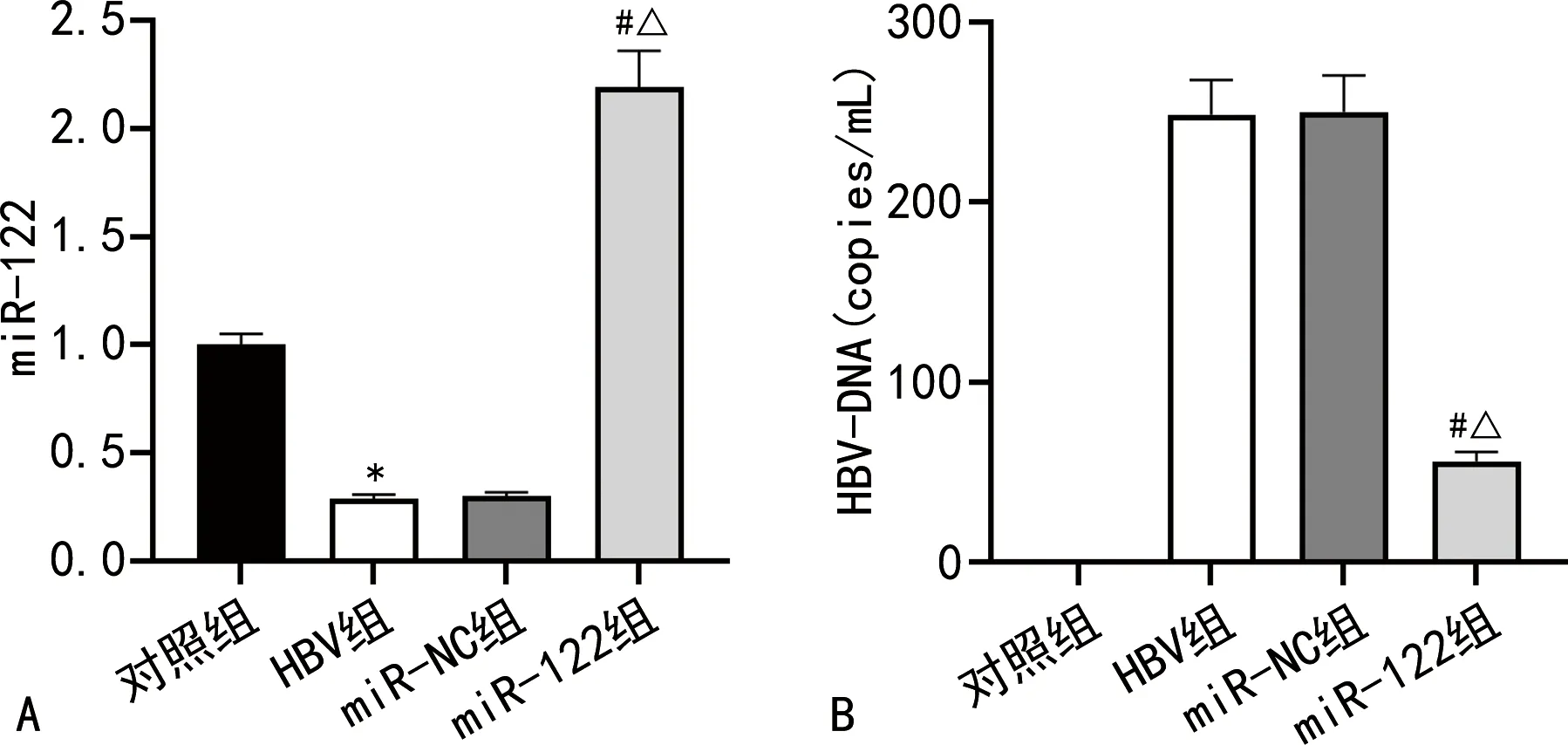
注:A为各组小鼠肝组织miR-122水平比较;B为各组小鼠血清HBV-DNA水平比较;与对照组比较,*P<0.05;与HBV组比较,#P<0.05;与miR-NC组比较,△P<0.05。图1 各组小鼠肝组织miR-122与血清HBV-DNA水平比较

图2 各组小鼠肝组织HBcAg表达情况(免疫组织化学染色,×100)

注:与HBV组比较,#P<0.05;与miR-NC组比较,△P<0.05。图3 各组小鼠肝组织HBcAg阳性细胞率比较
2.5各组小鼠肝组织病理形态变化比较 对照组小鼠肝组织结构完整,细胞排列整齐且紧密;HBV组小鼠肝组织内细胞形态发生明显改变,排列紊乱,有大量炎性细胞浸润;miR-122组小鼠肝组织损伤程度较HBV组明显减轻,组织内细胞排列较为整齐,炎性细胞浸润减少,而miR-NC组小鼠肝组织损伤现象与HBV组比较未发生改善,见图4。
2.6各组小鼠肝组织纤维化情况比较 对照组小鼠肝组织内蓝染区域少,未发生明显纤维化;相较于对照组,HBV组小鼠肝组织内有大量蓝染区域出现,组织发生明显纤维化;miR-122组小鼠肝组织内蓝染区域较HBV组减少,组织纤维化现象减轻,而miR-NC组肝组织仍有大量纤维化,较HBV组未发生明显改变,见图5。

图4 各组小鼠肝组织病理形态变化(HE染色,×100)

图5 各组小鼠肝组织纤维化情况(Masson染色,×100)
3 讨 论
HBV感染是引起肝脏疾病的主要原因之一,探讨针对HBV的抗病毒途径对开发严重肝脏疾病的有效预防及治疗方法至关重要。HBV基因组长3.2 kb,包含4个基因:核心蛋白(HBc)、X蛋白(HBx)、表面蛋白(HBs)和P蛋白[1]。HBV作为一种非致细胞病变病毒,优先在肝细胞中复制,其进入肝细胞后,病毒DNA被转移到细胞核,形成共价闭合环状DNA(cccDNA);cccDNA生成病毒RNA,包括复制中间体,称为前基因组(pg)RNA和HBs、HBx的病毒mRNA。HBc、P蛋白和pgRNA组装成核衣壳,P蛋白利用其反转录酶活性将pgRNA转化为松弛环状DNA,而成熟的核衣壳在作为感染性病毒体分泌之前最终与HBs结合[11]。然而,迄今为止,抗病毒免疫的机制和HBV感染的机制尚未完全阐明。近年来研究表明,miRNA可作为HBV感染机制中的一类新型调节因子,细胞 miRNA能够通过直接或间接作用对HBV转录、复制及表达产生影响,并在HBV感染相关疾病的发病机制中发挥重要作用[12]。
目前,关于miRNA调节HBV复制和表达的研究越来越多,有研究表明,一些miRNA能够抑制HBV复制,从而阻碍疾病进展,例如,miR-130a可以通过靶向两种宿主因子——过氧化物酶体增殖物激活受体γ(PPARγ)和PPARγ共激活因子-1α的表达来抑制HBV复制和表达[13];miR-98-5p通过靶向核因子-κB诱导激酶抑制HBV的复制与分泌,从而抑制HBV感染相关肝细胞癌的细胞增殖、迁移和侵袭[14];在HBV感染相关肝细胞癌的细胞和组织中miR-1271-5p表达均下调,过表达miR-1271-5p可通过靶向抑制水通道蛋白5来阻断HBV复制以及其诱导的肝细胞癌进展[15]。miR-122作为一种在肝脏中高表达的miRNA,其不仅在控制肝细胞生长和肿瘤转化方面发挥关键作用,还参与调节代谢、肝硬化的发生与发展等[16-17]。关于miR-122在HBV感染后的表达与作用已有报道,miR-122在HBV感染相关肝细胞癌患者及HBV转染的人肝癌细胞系Huh7中表达明显降低,miR-122能够与HBV的pgRNA双顺反子mRNA的高度保守区域结合,阻止编码HBV聚合酶和HBc,进而抑制HBV表达和复制[18];还有研究证实,miR-122通过间接调控靶基因或有关机制来影响HBV复制,例如增加人肝癌细胞系Huh7中miR-122的水平可通过介导p53信号通路来降低HBV RNA和DNA的表达[19]。但目前关于miR-122在体内HBV感染后的作用机制相关研究相对较少,体内调节机制更加复杂,而动物实验的有效结果是进行临床研究的支撑条件之一,鉴于此,本研究通过构建 HBV感染小鼠模型,经体内注射miR-122并观察模型小鼠HBV复制变化,结果显示,miR-122能够降低HBV感染小鼠血清HBsAg与HBeAg水平,下调血清HBV-DNA的表达,并抑制小鼠肝组织内HBcAg的表达。HBsAg、HBeAg及HBcAg是评价HBV感染情况的常用标志物,降低这些指标水平是延缓 HBV感染相关疾病进展的重要措施。HBsAg和HBeAg是HBV基因组编码的两种主要抗原,这两种抗原存在不仅会导致免疫耐受,还会导致肝细胞癌发病率升高[20]。
HBV在体内不断复制可通过异常免疫攻击介导肝脏炎症反应,使ALT和AST水平升高,影响肝功能,甚至导致肝衰竭[21]。本研究结果显示,miR-122能够降低HBV感染小鼠血清AST和ALT水平,减轻肝组织病理损伤与纤维化,提示miR-122对HBV感染小鼠的肝组织具有保护作用。此外,经检测发现,miR-122降低了HBV感染小鼠血清炎症因子TNF-α、IL-2及IL-6的水平。现已知HBV感染可诱导机体免疫失衡,使免疫细胞及其释放的细胞因子发生改变,从而参与HBV感染期间的肝脏炎症反应,最终促进肝细胞癌的发生、发展。炎症因子TNF-α、干扰素-γ、IL-2、IL-6和IL-12等的释放可促进细胞间的相互作用,加重炎症反应[22],因此,如何抑制炎症因子的释放以维持免疫平衡也是HBV感染相关疾病治疗的关键步骤。由此推测,miR-122能够调控HBV感染小鼠后炎症因子的释放,减轻炎症反应。
综上所述,在HBV感染小鼠中,miR-122能够明显抑制HBV-DNA在体内的复制与表达,并抑制炎症因子的释放,减轻肝组织损伤与纤维化,发挥良好的肝脏保护作用,该发现为HBV感染治疗提供了新思路。但本研究未对miR-122作用的分子靶点及详细机制进行深入研究,后续将进一步探究。

