类风湿关节炎相关间质性肺疾病血清CCL18及PTX3的水平变化及临床意义*
罗 珊,蔡俊玮,李 敏,李雪锋
十堰市太和医院(湖北医药学院附属医院)内分泌风湿病科,湖北十堰 442000
类风湿关节炎(RA)是一种主要累及外周关节,引起关节畸形的慢性炎症性关节炎,除关节受累外,该病可能同时累及全身多个脏器,其中类风湿关节炎相关间质性肺疾病(RA-ILD)是RA最具破坏性的并发症[1],RA-ILD可逐渐发展成为肺间质纤维化,预后比RA其他类型的肺部并发症更差[2]。RA-ILD的早期诊断与治疗对改善预后至关重要,但多数RA-ILD患者早期缺乏特异性的症状及体征,增加了确诊的难度。研究表明,血清生物标志物可能对RA-ILD的早期筛査及预后评估有一定临床意义[3]。血清趋化因子CC配体18(CCL18)属于趋化因子家族成员,其主要由M2型巨噬细胞分泌,可趋化幼稚淋巴细胞,在肺成纤维细胞持续纤维化过程中发挥重要作用[4]。正五聚蛋白3(PTX3)是正五聚蛋白家族成员,主要由中性粒细胞、巨噬细胞和血管内皮细胞合成,其通过多种生物学途径参与炎症、纤维化与肿瘤等的病理生理过程[5]。本研究分析了血清CCL18、PTX3在RA-ILD诊断中的价值,现报道如下。
1 资料与方法
1.1一般资料 纳入2020年1月至2022年1月于本院门诊就诊及住院的82例RA患者为研究对象,其中男33例,女49例;年龄20~65岁,平均(42.34±20.45)岁。对所有入组的RA患者进行胸部高分泌率CT(HRCT)检查,依据2010年美国胸科协会/欧洲呼吸协会(ATS/ERS)制定的诊断标准[6]判断是否有RA-ILD,将82例RA患者分为RA-ILD组25例与未合并ILD组(non-ILD组)57例。RA-ILD组中男10例,女15例;年龄20~60岁,平均(41.36±17.56)岁。non-ILD组中男23例,女34例;年龄20~65岁,平均(41.78±19.95)岁。纳入标准:RA患者均符合RA相关诊断或分类标准[7]。排除标准:肥胖者[体质量指数(BMI)≥28 kg/m2)];大量吸烟者;合并肿瘤者;合并严重心、肝、肾疾病者;其他呼吸系统疾病(肺部感染、肺结核、慢性阻塞性肺疾病、支气管扩张)导致的间质性肺疾病(ILD);尘肺、吸入有机物引起的ILD;药源性ILD。另选取同期本院体检中心胸部CT检查正常的健康体检者40例为对照组,其中男15例,女25例;年龄20~65岁,平均(41.41±20.89)岁。对照组排除肥胖者及大量吸烟者。所有研究对象对本研究均知情同意,并签署知情同意书,本研究经本院医学伦理委员会审核批准。
1.2方法 (1)实验室指标检测。留取RA患者和健康体检者空腹静脉血5 mL,1 h内离心分离血清,分装后置于-80 ℃冰箱低温保存待检。采用酶联免疫吸附试验(ELISA)检测血清CCL18和PTX3水平,检测试剂盒由上海碧云天生物技术有限公司提供,检测方法参照ELISA试剂盒说明书。类风湿因子(RF)、C反应蛋白(CRP)检测采用免疫比浊法;红细胞沉降率(ESR)采用魏氏法检测;抗环瓜氨酸肽(anti-CCP)抗体采用化学发光微粒子免疫分析法检测(检测仪器为雅培i1000全自动化学发光分析仪)。(2)对RA患者进行28处关节疾病活动度(DAS28)评分以评估病情活动情况,该评分主要根据患者的关节压痛数、肿胀关节数、ESR水平及患者自评近7 d病情活动性来进行评定。(3)评估RA患者肺通气功能及弥散功能,检测指标包括第1秒用力呼气容积占用力肺活量百分比(FEV1/FVC)及一氧化碳弥散量(DLCO),所有RA患者肺功能相关指标均由同一名经验丰富的呼吸内科医师进行检测。

2 结 果
2.1RA-ILD患者HRCT结果及3组临床资料比较 RA-ILD患者主要HRCT异常表现为牵张性支气管扩张(15例,60.0%)、网格/蜂窝影(13例,52.0%)、磨玻璃影(8例,32.0%)和胸膜下实变影(4例,16.0%)。RA-ILD组、non-ILD组、对照组年龄、性别、BMI比较,差异无统计学意义(P>0.05);RA-ILD组、non-ILD组ESR、CRP、RF、anti-CCP抗体水平均明显高于对照组,差异有统计学意义(P<0.05)。与non-ILD组比较,RA-ILD组病程更长,DAS28评分与CRP水平升高,FEV1/FVC、DLCO下降,差异有统计学意义(P<0.05),见表1。
2.23组血清CCL18和PTX3水平比较 RA-ILD组血清CCL18水平为204.60(118.92,306.03)pg/mL,PTX3水平为2 066.38(1 312.56,2 443.75)pg/mL,均高于non-ILD组[CCL18水平为111.20(98.89,123.54)pg/mL,PTX3水平为1 117.62(942.98,1 371.89)pg/mL]与对照组[CCL18水平为64.89(56.94,68.46)pg/mL,PTX3水平为765.83(710.34,940.57)pg/mL],差异有统计学意义(P<0.05);non-ILD组血清CCL18、PTX3水平均高于对照组,差异有统计学意义(P<0.05),见图1、2。

表1 3组临床资料比较或n/n)

组别nESR(mm/h)RF(IU/L)anti-CCP抗体(U/mL)FEV1/FVC(%)DLCO(%)RA-ILD组2534.66±11.55∗68.65±15.67∗54.51±12.38∗73.51±17.46#70.21±10.67#non-ILD组5722.64±10.68∗59.64±20.71∗48.39±19.53∗85.07±18.5280.98±17.38对照组4014.11±6.558.91±4.0215.32±7.09——F/χ2/t6.3886.0806.4562.1763.884P<0.05<0.05<0.05<0.05<0.05

图1 3组血清CCL18水平比较
2.3RA患者血清CCL18、PTX3水平间及与其他临床指标水平间的相关性 Spearman相关分析结果显示,RA患者血清CCL18水平与PTX3水平呈正相关(r=0.631,P<0.001);血清CCL18水平与RF水平呈正相关(r=0.428,P<0.05);血清CCL18、PTX3水平与年龄、病程、BMI、肺功能指标(FEV1/FVC、DLCO)、DAS28评分、ESR、CRP、anti-CCP抗体水平均无相关性(P>0.05)。
2.4血清CCL18、PTX3对RA-ILD的诊断价值 血清CCL18检测诊断RA-ILD的曲线下面积(AUC)为0.739(95%CI:0.605~0.875),灵敏度为82.1%,特异度为71.5%;血清PTX3检测诊断RA-ILD的AUC为0.757(95%CI:0.613~0.900),灵敏度为84.0%,特异度为75.4%,见图3。

图2 3组血清PTX3水平比较
2.5RA-ILD发生的影响因素分析 将RA-ILD组与non-ILD组比较差异有统计学意义的指标(病程、DAS28评分、CRP、FEV1/FVC、DLCO、CCL18与PTX3)纳入多因素Logistic回归分析模型,结果显示,病程、CRP、FEV1/FVC、DLCO、DAS28评分、CCL18与PTX3水平是RA-ILD发生的独立影响因素(P<0.05),见表2。
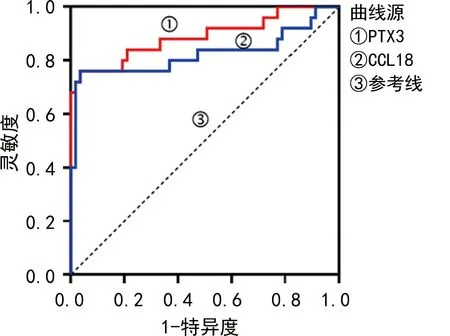
图3 血清PTX3、CCL18诊断RA-ILD的ROC曲线

表2 影响RA-ILD发生的多因素Logistic回归分析结果
3 讨 论
随着RA治疗理念的改变和“生物制剂时代”的到来,RA的治疗技术取得了较大的进步,患者临床疗效不断改善[8]。与此同时,较多循证医学证据显示,RA患者关节外表现,尤其是RA-ILD逐渐成为影响患者生活质量与预后的重要原因[9]。ILD病因多样,比如粉尘吸入、肺部感染、环境影响、药物不良反应、放射性损伤等,而免疫介导的炎症细胞浸润引起肺间质组织重塑与纤维化可能是RA-ILD形成的重要因素[10]。
目前,关于RA-ILD的发病机制已有较多临床研究。KHAN等[11]研究发现,RA相关自身抗体RF与anti-CCP抗体可与特异性抗原结合形成免疫复合物,通过趋化炎症细胞和成纤维细胞至肺间质,经免疫学途径导致肺血管炎症和肺泡损伤,最终引起肺纤维化表现,参与RA-ILD的发生。有报道显示,胸部HRCT检查可以替代有创性肺组织活检作为诊断RA-ILD的“金标准”[12]。本研究纳入的82例RA患者中,RA-ILD占30.5%,其典型HRCT表现为牵张性支气管扩张、网格影、蜂窝影、磨玻璃影和胸膜下实变影,与文献报道一致[13]。对患者的肺功能检测发现,RA-ILD组较non-ILD组FEV1/FVC、DLCO明显降低(P<0.05),提示经HRCT检查确诊的RA-ILD患者肺通气及弥散功能均已受到不同程度的影响。胸部HRCT检查存在一定局限性及滞后性,其不能在疾病的启动阶段(肺组织的炎症浸润状态)诊断RA-ILD[14]。本研究结果也提示,在临床中应重视RA患者的肺功能检查,及早对患者进行肺通气和肺弥散功能评估。
CCL18通过介导免疫损伤、激发炎症反应、参与血管炎症反应等多种途径激活并趋化多种炎症细胞至肺间质炎症部位[15],由于其在肺间质纤维化、慢性阻塞性肺疾病、肺结节病、支气管哮喘等肺部疾病中发挥重要作用,因此也被作为肺损害严重程度的判断指标之一[16]。此外,SCHUPP等[17]发现,系统性硬化症患者血清CCL18水平明显升高;也有报道显示CCL18水平在RA患者血清和关节滑液中有不同程度升高,且与DSA28评分密切相关,提示CCL18参与了结缔组织病的发生、发展,在RA活动情况判断中具有重要价值[18]。PTX3是一种急性炎症反应相关蛋白,由多种类型的细胞受刺激后产生,参与包括RA在内的多种自身免疫性疾病的血管炎症反应与组织纤维化的病理过程[19]。在小鼠肺纤维化模型中PTX3可促进纤维细胞分化和胶原沉积,参与肺间质纤维化[20]。本研究中,RA-ILD组患者血清CCL18、PTX3水平较non-ILD组、对照组均明显升高(P<0.05),提示血清CCL18与PTX3可能在RA-ILD的发生过程中发挥作用。
研究较多的涎液化糖链抗原6在皮肌炎、系统性硬化症等部分结缔组织病相关ILD的诊断、预后评估和风险分层方面的意义近年来逐渐被阐明[21]。而RA-ILD的血清学标志物仍相对缺乏,贺新伟等[22]研究发现,RA-ILD、干燥综合征相关ILD、皮肌炎相关ILD等患者的肺泡灌洗液CCL18水平明显升高,且CCL18水平可能与肺部病变严重程度及患者预后相关。本研究通过ROC曲线分析发现,血清CCL18与PTX3对RA-ILD具有良好的诊断价值;进一步行Logistic回归分析发现,血清CCL18、PTX3、CRP、病程、FEV1/FVC、DLCO及DAS28评分是RA-ILD发生的独立影响因素(P<0.05),对RA患者检测血清CCL18与PTX3水平可帮助临床早发现、早诊断RA-ILD。
综上所述,血清CCL18与PTX3水平升高可能与RA-ILD的发生有关,并且其对RA-ILD具有一定的诊断价值。本研究主要的不足之处在于未能探讨血清CCL18、PTX3在不同严重程度RA-ILD患者中的水平差异,同时后续还需通过扩大样本量进一步验证二者在RA-ILD诊断、治疗及预后判断中的价值,并开展更多的基础研究,了解血清CCL18、PTX3在RA-ILD发生、发展中的具体作用机制。

