杂质离子对AA5052铝合金在模拟冷却液中耐蚀性能的影响
尤良洲,衡世权,陆佳敏,李晓徽 ,高立新,张大全
(1. 华电电力科学研究院有限公司,浙江 杭州 310030;2. 上海电力大学环境与化学工程学院,上海 200090)
[收稿日期] 2022-01-26
[基金项目] 国家自然科学基金项目(52071198);中国华电集团有限公司科技项目 风电机组变频器冷却液运行指标研究(CHDKJ19 - 02 - 202)资助
[通信作者] 张大全(1968-),博士,教授,主要研究方向为防腐蚀化学品,电话:021-35303891,E - mail:zhangdaquan@shiep.edu.cn
0 前 言
铝合金由于具有良好的导热性和力学性能、价格便宜、比重轻,近年来作为热交换材料得到广泛的应用。通常情况下,铝及其合金在pH值为4.0~8.5的水溶液中,能够形成具有一定耐蚀性的氧化膜。然而,这层氧化膜在含有杂质离子的溶液中并不稳定[1,2],尤其是溶液中含有析氢超电压低的金属离子杂质时,金属离子杂质能成为阴极相,显著加快铝合金的腐蚀[3]。Khedr等[4]发现,当溶液中存在低浓度的Cu2+时,Cu2+发生还原反应,可抑制铝合金的阴极吸氧反应过程,从而降低铝合金的初始腐蚀速率,但是当溶液中的Cu2+超过一定浓度时,沉积在铝合金表面的金属离子会与铝基体发生电偶腐蚀,从而加速铝合金的腐蚀速率。然而,并不是所有的金属离子都会加速铝合金的腐蚀。Arnott等[5]发现低浓度的Co2+、Ni2+、La+、Ce2+和Fe3+等金属离子对铝合金具有一定的缓蚀作用,这是因为这些金属离子能够在铝合金表面沉积并形成保护膜,从而抑制铝合金的阴极反应。有研究[4]表明,Cd2+对铝合金也有一定的缓蚀作用,Cd2+与铝合金表面的氧化膜发生化学反应从而形成混合氧化膜,能抑制溶液中Cu2+和Fe3+对铝合金的腐蚀。
目前,大型风电机组变频器主要采用液 - 空冷却系统,该系统由水泵驱动冷却液循环换热,吸热后的冷却液经风冷器与空气进行二次热交换,从而降低系统的温度。风机变频器冷却系统的冷却介质应具有良好的散热功能以及防冻、防腐蚀、防结垢等功能。目前使用的普通冷却液主要是由30%~70%(质量分数)乙二醇水溶液、缓蚀剂和其他功能成分物质组成。AA5052铝合金是常用的铝合金热交换材料。由于整个冷却系统含有泵、阀等组件,采用工业品原料配制的冷却液中不可避免含有杂质离子,这些杂质离子会严重影响铝合金热交换管的耐蚀性。本工作采用失重法、等离子色谱和扫描电镜研究AA5052铝合金在含杂质离子(Cl-、Fe3+、Cu2+)的模拟冷却液[33%(质量分数)乙二醇水溶液]中的耐蚀特性,并考察了AA5052铝合金在上述溶液的腐蚀动力学行为。
1 试 验
1.1 实验材料
实验所用的材料为AA5052铝合金,其化学成分为(质量分数,%):Mg 2.46,Fe 0.27,Cr 0.19,Cu 0.10,Zn 0.10,Si 0.06,Mn 0.06,Al 余量。将AA5052铝合金制作成尺寸为0.12 cm×3.00 cm×5.00 cm的挂片。实验所用的氯化钠、硫酸铜、硫酸铁以及乙二醇,均为分析纯试剂。基础液为33%乙二醇水溶液,向其中添加[Fe3++Cu2+]、[Fe3++Cu2++Cl-]、[Cl-+Fe3+]、[Cl-+Cu2+]的混合离子,各离子为等摩尔比,杂质离子总浓度保持为0.01 mol/L,所用的溶液均用去离子水配制,未调整pH值。
1.2 失重法
将铝合金试样用400、800、1 200目的金相砂纸逐级抛光,用乙醇清洗其表面上的油脂,去离子水冲洗,吹干后称重。测试液为含有和不含杂质离子的250 mL 33%乙二醇溶液。将处理好的铝合金挂片浸于测试液中,每隔设定时间取出,用橡皮擦擦除挂片表面的腐蚀产物,去离子水冲洗,干燥称重。在实验过程中,不搅动溶液且不对溶液进行除氧。用水浴锅分别控制实验温度在20,30,40,50 ℃。
1.3 等离子色谱
将3.00 cm×5.00 cm的AA5052铝合金用400、800、1 200目的金相砂纸逐级抛光至镜面,用乙醇清洗其表面上的油脂,去离子水冲洗,冷风吹干后,在含0.01 mol/L杂质离子和不含杂质离子的250 mL 33%乙二醇溶液中浸泡6 h,实验温度为20 ℃。实验结束后,取100 mL上清液至100 mL容量瓶,分别向各容量瓶中滴加1 mL浓硝酸使样品完全分解,采用ICPS - 7510电感耦合等离子体发射光谱仪测试其中的Al3+含量,测试波长选择396.2 nm。
1.4 扫描电镜及能谱分析
将AA5052铝合金制作成尺寸约为0.5 cm × 0.3 cm的试片,表面经打磨抛光、除油、干燥后浸入20 ℃的含有不同杂质离子的33%乙二醇溶液中浸泡2 h,取出后用去离子水冲洗、干燥后测量。采用SU - 1500扫描电子显微镜(SEM)联用EMAX Energy X射线能量色散光谱仪(EDS)对试片进行表面形貌检测及表面元素分析。SEM测试室真空度小于1 Pa,加速电压为15 kV。
2 结果与讨论
2.1 腐蚀失重实验
实验失重数据可以按下式计算:
(1)
式中:Rc为单位面积的质量损失,g/m2;W0是铝合金挂片在腐蚀浸泡前的质量,g;Wcorr是铝合金挂片浸泡后去除腐蚀产物后的质量,g;A是挂片的表面积,m2。
图1为AA5052铝合金挂片在含有不同杂质离子的33%乙二醇水溶液中失重量随时间的变化曲线。从图1可以看出,铝合金单位面积的腐蚀失重损失均随着浸泡时间的延长而增大。相同温度下,在含4种不同组合的杂质离子溶液中铝合金失重大小排序为:[Fe3++Cu2+]>[Fe3++Cu2++Cl-]>[Fe3++Cl-]>[Cu2++Cl-]。
当铝合金发生腐蚀时,铝失去电子而形成Al3+,Al3+形成的中间体脱附后可以进入溶液中,通过检测溶液中Al3+的浓度可以推测铝合金发生腐蚀的程度。表1为采用等离子色谱测定的腐蚀后溶液中Al3+的含量。

表1 腐蚀后溶液中Al3+的含量
从表1可以看出,腐蚀实验结束后溶液中Al3+的含量排序为:[Fe3++Cu2+]>[Fe3++Cu2++Cl-]>[Fe3++ Cl-]>[Cu2++Cl-],说明AA5052铝合金在含有杂质离子的模拟冷却液中发生腐蚀的严重程度排序为:[Fe3++Cu2+]>[Fe3++Cu2++Cl-]>[Fe3++ Cl-]>[Cu2++Cl-],这与失重法得到的结果一致。
2.2 腐蚀动力学分析
记Wt为腐蚀浸泡时间为t时刻样品的质量,将lnWt对t作图,得到一直线,相关指数R2大于0.99,不同温度下AA5052铝合金在挂片含有不同杂质离子的乙二醇水溶液中的腐蚀动力学曲线见图2。由图2可以看出,铝合金在含有不同杂质离子的乙二醇水溶液中的腐蚀反应符合一级动力学方程。腐蚀速率常数k按下式计算:
(2)
式中,W0是样品初始质量,g;Wt是浸泡时间为t时刻样品的质量,g;t是浸泡时间,h。由式(2)计算所得的腐蚀速率常数见表2。
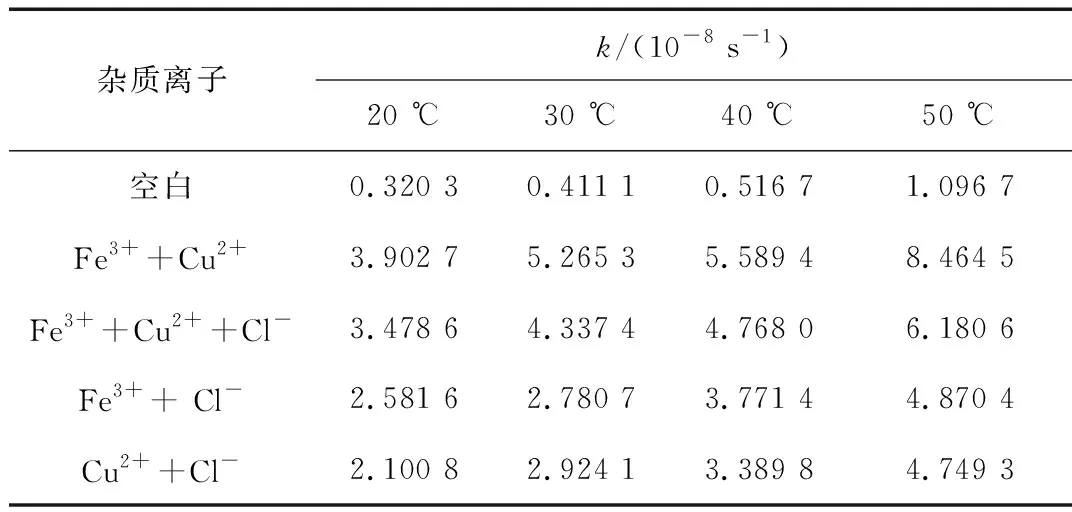
表2 不同温度下AA5052铝合金挂片在含有Fe3+、Cu2+和Cl-的乙二醇水溶液中的腐蚀反应速率常数k
从表2可以看出,在同一温度下含不同杂质离子的乙二醇溶液中,AA5052铝合金腐蚀速率常数大小排序为:[Fe3++Cu2+]>[Fe3++Cu2++Cl-]>[Fe3++Cl-]>[Cu2++Cl-],表明了在同一温度含不同杂质离子的乙二醇溶液中,AA5052铝合金的腐蚀速率大小排序为:[Fe3++Cu2+]>[Fe3++Cu2++Cl-]>[Fe3++Cl-]>[Cu2++Cl-]。
2.3 腐蚀热力学分析
根据Arrhenius公式:
(3)
式中,Rc表示腐蚀速率,由公式(1)获得;Ea为表观活化能,kJ/mol;T为热力学温度,K;A为指前因子。按浸泡10 h的腐蚀失重数据,以lnRc~1/T作图得一直线,见图3,所得腐蚀反应的表观活化能Ea列于表3中。由表3可以看出,在含有不同杂质离子的模拟冷却液中,铝合金的腐蚀反应活化能大小排序为:[Fe3++Cu2+]>[Fe3++Cu2++Cl-]>[Fe3++Cl-]>[Cu2++Cl-]。活化能较大的反应,其反应速率随温度升高增加较快,具有较大的温度系数。所以温度升高时,含有[Fe3++Cu2+]的模拟冷却液中铝合金的腐蚀反应速率增加更快。
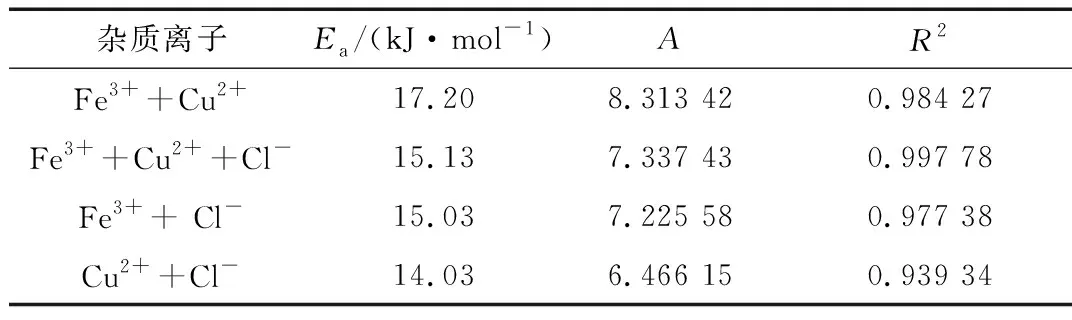
表3 AA5052铝合金挂片在含不同杂质离子的乙二醇溶液中的拟合腐蚀反应活化能
2.4 表面形貌及能谱分析
图4是20 ℃下AA5052铝合金在含有不同杂质离子的33%乙二醇水溶液中浸泡2 h的SEM形貌。从图4a可以看出,铝合金表面出现了点状颗粒物,发生了严重的局部腐蚀,这是因为溶液中的Cu2+被还原成Cu吸附在铝合金表面。观察图4b发现,铝合金表面有红色的Cu沉积,并出现“白斑黑心”状的腐蚀产物,这是因为阴极相周围的铝优先溶解,生成的Al3+向阴极扩散,阴极反应产生的OH-向阳极扩散,最终在阴、阳极的界面上生成Al(OH)3沉淀物,形成白斑,而坑中阴极质点的存在导致出现黑心特征。图4c是铝合金在含有Fe3++Cl-的乙二醇水溶液中的腐蚀形貌,可以看出,铝合金表面并不平整,表面有大量的点蚀孔和白色颗粒物存在。图4d表明,铝合金在该体系下同样出现“白斑黑心”状的腐蚀产物。AA5052铝合金在含有不同杂质离子中的乙二醇溶液中浸泡2 h的EDS数据见表4。表4中的A~I分别对应图4中方框部分A~I区域。
由表4可见,腐蚀区域均伴随着Cu元素或Fe元素的沉积,表明乙二醇溶液中的Cu2+、Fe3+促进了AA5052铝合金的腐蚀。在图4中D、E、I区域存在少量的Cl元素,说明Cl-参与腐蚀过程。
铝合金主要腐蚀反应主要包括以下几个过程[6]:
阳极反应:
Al → Al3++3e
(4)
阴极反应:
2H++2e → H2
(5)
O2+2H2O+4e → 4OH-
(6)
Fe3++e → Fe2+
(7)
Cu2++2e → Cu
(8)
有研究表明[7],铝合金在含Cl-、Fe3+、Cu2+的溶液

表4 AA5052铝合金在含有不同杂质离子中的乙二醇溶液中浸泡2 h的EDS数据
中的腐蚀控制过程由阴极反应控制。在含有杂质离子的冷却液中,随着铝合金表面氧化膜的破坏,铝合金发生腐蚀溶解。模拟冷却液中的杂质离子在铝合金表面富集,H+、O2、Fe3+和Cu2+在阴极区发生还原反应,从而促进铝合金的腐蚀溶解,进而加速点蚀的产生与扩展。在腐蚀过程中,Fe3+和Cu2+存在协同作用,Fe3+的还原电位高于Cu2+,在溶液中Fe3+优先被还原,因此铝合金在[Fe3++ Cl-]存在条件下较[Cu2++Cl-]存在条件下腐蚀速率增加。
3 结 论
考察AA5052铝合金在含有[Fe3++Cu2+]、[Cl-+Fe3+]、[Cl-+Cu2+]和[Cl-+Fe3++Cu2+]杂质离子的乙二醇水溶液模拟冷却液中的腐蚀情况。结果表明:
(1)AA5052在含有杂质离子的模拟冷却液中发生腐蚀的严重程度排序为:[Fe3++Cu2+]>[Fe3++Cu2++Cl-]>[Fe3++Cl-]>[Cu2++Cl-];
(2)AA5052铝合金在含复合杂质离子的乙二醇水溶液中的腐蚀动力学反应级数为一级。
(3)AA5052铝合金在含有不同复合杂质离子的乙二醇水溶液中的腐蚀质量损失均随着溶液温度的升高而增大。

