急性脑梗死患者外周血LncRNA-NEAT1,miR-93-5p表达水平及临床意义
聂晓慧,薛 茜,寇文辉,张烨君(河北北方学院附属第一医院神经内科,河北张家口 075000)
中国急性脑梗死(acute cerebral infarction)住院患者的死亡率/致残率为34.5%~37.1%,严重威胁人类健康[1-3]。对患者实施危险分层并预测不良预后,对于改善预后至关重要。既往研究中长链非编码RNA核富集转录体1(long non-coding RNA nuclear paraspeckle assembly transcript 1,LncRNANEAT1)、微小核糖核酸(microRNA,miR)-93-5p虽均与神经系统疾病有关[4-6],但目前尚缺乏二者在急性脑梗死中的研究,因此本研究以探讨LncRNA-NEAT1,miR-93-5p与急性脑梗死患者梗死病灶面积、神经功能缺损程度及预后的关系为目的,旨在通过预测急性脑梗死患者死亡风险,降低患者死亡率。
1 材料与方法
1.1 研究对象 选取河北北方学院附属第一医院2020年1月~2022年2月收治的84例急性脑梗死患者作为脑梗死组,患者年龄40~76(59.42±8.65)岁,其中男性48例,女性36例;吸烟43例,饮酒35例,高血压46例,高血脂42例。另选取本院同期健康体检者84例为对照组,年龄40~78(60.07±8.73)岁,其中男性46例,女性38例;吸烟36例,饮酒30例,高血压41例,高血脂39例。收集患者年龄、性别、病灶类型、吸烟、饮酒、高血压、高血脂等临床资料,脑梗死组与对照组年龄、性别、吸烟、饮酒、高血压、高血脂比较,差异无统计学意义(t/χ2=0.485,0.097,1.171,0.627,0.596,0.215,均P>0.05)。研究经伦理委员会批准,家属知情同意并签署知情同意书。
纳入标准:①患者符合中华医学会神经病学分会拟定的标准[7],经颅脑CT或MRI扫描证实;②首次发病,发病24 h内入院,发病前三个月内无手术、外伤及感染史。排除标准:①心、肝、肾功能障碍者;②有其他脑部占位性疾病或重度颅脑损伤者;③妊娠或哺乳期女性;④并发凝血障碍疾病或恶性肿瘤者。
1.2 仪器与试剂 RNA提取试剂盒(无锡菩禾生物医药技术有限公司,货号:M005),反转录试剂盒(上海吉至生化科技有限公司,货号:RP1105-100T),NanoDrop 2000c分光光度计(德国Thermo公司),Light Cycler 480 II荧光定量PCR仪(瑞士罗氏公司)。
1.3 方法
1.3.1 血清LncRNA-NEAT1,miR-93-5p表达水平测定:收集体检者体检当日及急性脑梗死患者入院24 h内外周静脉血液样本10 ml,静置约1 h后离心取血清,于-80℃保存。采用实时荧光定量PCR法检测血清LncRNA-NEAT1和miR-93-5p表达水平。应用RNA提取试剂盒提取总RNA,采用分光光度计检测其浓度和纯度,当A260nm/A280nm比值为1.8~2.1时样品合格。应用反转录试剂盒将模板cDNA合成,之后采用荧光定量PCR仪进行反应,引物序列见表1。循环结束后采用2-∆∆Ct法计算LncRNANEAT1,miR-93-5p相对表达水平,本实验操作重复三次以减小误差。
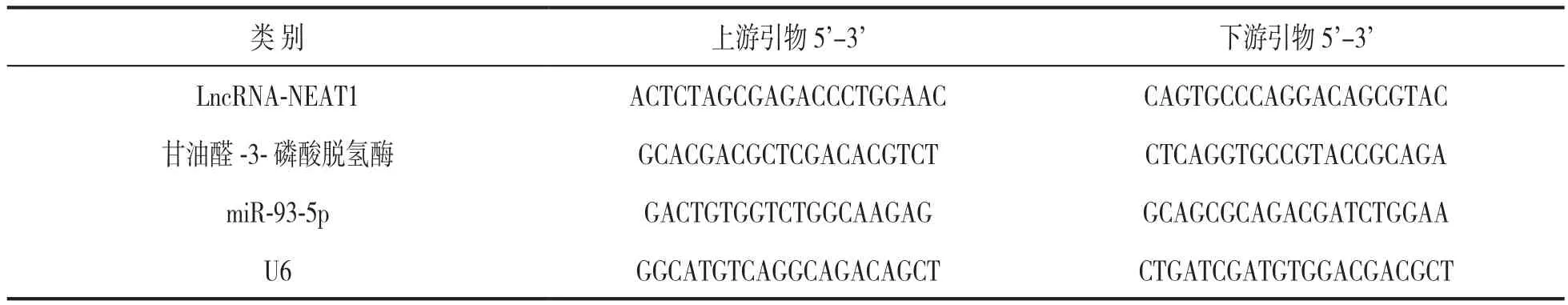
表1 引物序列
1.3.2 急性脑梗死患者梗死病灶面积、神经功能缺损程度评估及随访:梗死病灶面积:采用颅脑MRI或CT检查后评估梗死病灶面积,直径<1.5 cm为小面积梗死组(n=26),直径1.5~3 cm为中面积梗死组(n=34),直径>3 cm为大面积梗死组(n=24例)。神经功能缺损程度:采用美国国立卫生研究院卒中量表(National Institute of Health Stroke Scale,NIHSS)评分[8]评估患者神经功能缺损程度,NIHSS评分≤4分为轻度组(n=27),NIHSS评分5~20分为中度组(n=32),NIHSS评分≥21分为重度组(n=25)。随访:对急性脑梗死患者随访三个月,采用短信、电话、门诊复查方式,根据预后结局分为生存组(n=69)和死亡组(n=15)。
1.4 统计学分析 采用Excel整理数据,采用SPSS 25.0统计学软件分析数据。计量资料符合正态分布,以均数±标准差(±s)表示,两组行独立样本t检验,三组行单因素方差,进一步两两比较行SNK-q检验;采用受试者工作特征(receiver operating characteristic,ROC)曲线分析血清LncRNA-NEAT1,miR-93-5p表达水平对急性脑梗死患者预后的预测效能,曲线下面积(area under curve,AUC)行Z检验。P<0.05为差异具有统计学意义。
2 结果
2.1 两组血清LncRNA-NEAT1,miR-93-5p比较 与对照组相比,脑梗死组血清LncRNA-NEAT1表达水平显著升高(2.46±0.38 vs 1.01±0.20),miR-93-5p表达水平显著降低(0.42±0.16 vs 1.02±0.22),差异具有统计学意义(t=30.948,33.796,均P<0.05)。
2.2 血清LncRNA-NEAT1,miR-93-5p与临床特征的关系 见表2。LncRNA-NEAT1,miR-93-5p在不同年龄、性别、病灶类型及有无吸烟、饮酒、高血压、高血脂的患者中比较,差异均无统计学意义(均P>0.05)。
表2 不同临床特征患者血清LncRNANEAT1,miR-93-5p表达水平比较(±s)

表2 不同临床特征患者血清LncRNANEAT1,miR-93-5p表达水平比较(±s)
类 别 n LncRNANEAT1 t值 P值 miR-93-5p t值 P值年龄(岁) <60 39 2.42±0.36 0.838 0.405 0.43±0.15 0.655 0.514≥60 45 2.49±0.40 0.41±0.13性别 男 48 2.44±0.38 0.577 0.566 0.44±0.16 1.494 0.139女36 2.49±0.41 0.39±0.14吸烟 无 41 2.45±0.40 0.235 0.815 0.43±0.17 0.555 0.580有43 2.47±0.38 0.41±0.16饮酒 无 49 2.46±0.41 0.000 1.000 0.41±0.15 0.539 0.592有35 2.46±0.39 0.43±0.19高血压 无 38 2.44±0.38 0.345 0.731 0.43±0.14 0.603 0.548有46 2.47±0.41 0.41±0.16高血脂 无 42 2.44±0.37 0.469 0.640 0.44±0.16 1.110 0.270有42 2.48±0.41 0.40±0.17病灶类型 单发 49 2.44±0.37 0.577 0.565 0.44±0.18 1.314 0.193多发 35 2.49±0.42 0.39±0.16
2.3 血清LncRNA-NEAT1,miR-93-5p与梗死病灶面积的关系 血清LnRNA-NEAT1水平随梗死病灶面积增加而升高(2.21±0.36, 2.45±0.39,2.75±0.45),血清miR-93-5p表达水平随梗死病灶面积增加而降低(0.68±0.20, 0.43±0.17,0.12±0.04),差异均有统计学意义(F=11.434,79.777, 均P=0.000)。与小面积梗死组相比,中面积梗死组、大面积梗死组LnRNA-NEAT1表达水平升高(q=3.262, 6.756), miR-93-5p表达水平显著降低(q=8.657, 17.847),差异具有统计学意义(均P<0.05)。与中面积梗死组比较,大面积梗死组LnRNA-NEAT1表达水平升高,miR-93-5p表达水平降低,差异有统计学意义(q=3.985, 10.490, 均<0.05)。
2.4 血清LncRNA-NEAT1,miR-93-5p与神经功能缺损程度的关系 血清LncRNA-NEAT1表达水平随神经功能缺损程度增加而升高(2.24±0.34,2.46±0.40,2.70±0.45),而血清miR-93-5p表达水平随神经功能缺损程度增加而降低(0.63±0.49,0.41±0.16,0.21±0.08),差异均有统计学意义(F=8.674, 49.316, 均P=0.000)。与轻度组相比,中度组、重度组血清LncRNA-NEAT1表达水平均显著升高,miR-93-5p表达水平显著降低,差异具有统计学意义(q=7.803,14.025,均P<0.05);与中度组比较,重度组血清LncRNA-NEAT1表达水平升高,miR-93-5p表达水平降低,差异有统计学意义(q=3.195, 6.945, 均P<0.05)。
2.5 血清LncRNA-NEAT1,miR-93-5p与预后的关系 与生存组相比,死亡组血清LncRNA-NEAT1表达水平显著升高(2.78±0.43 vs 2.39±0.40),miR-93-5p表达水平显著降低(0.28±0.09 vs 0.45±0.18),差异具有统计学意义(t=3.378,3.550,均P<0.001)。
2.6 血清LncRNA-NEAT1,miR-93-5p的预后预测效能 见图1,表3。血清LncRNA-NEAT1,miR-93-5p单独及联合预测急性脑梗死患者死亡的AUC分别为0.733(95%CI: 0.591~ 0.876),0.784(95%CI:0.669~0.898)和0.849(95%CI: 0.752~0.946),其联合预测AUC大于单独预测AUC,差异具有统计学意义(Z=2.929,1.642,均P< 0.05),LncRNA-NEAT1和miR-93-5p截断值为2.66,0.34。

图1 血清LncRNA-NEAT1,miR-93-5p表达水平预测急性脑梗死患者预后的ROC曲线

表3 LncRNA-NEAT1,miR-93-5p单独及联合预测急性脑梗死患者预后的价值分析(%)
3 讨论
脑卒中最常见类型为急性脑梗死,近些年全球急性脑梗死患者死亡率和致残率均有所上升[9]。急性脑梗死发病机制较复杂,患者病发后局部血运减少,进而造成周围神经角质细胞和神经元细胞损伤,进一步出现神经功能严重缺损[10-12]。
既往研究表明,微血管新生与急性脑梗死神经功能恢复及预后有重要作用[13]。LncRNA-NEAT1可通过调节血管平滑肌细胞表型转化及上皮细胞过度凋亡促进内膜增厚或血管闭塞,且LncRNANEAT1可通过与细胞内调节因子相互作用参与癌症及急性脑梗死[14-15]。因此初步推测LncRNA-NEAT1可能通过调节血管平滑肌细胞及上皮细胞功能参与急性脑梗死的疾病进展。LI等[15]研究结果显示,急性脑梗死患者血清LncRNA-NEAT1表达高于对照组,本研究结果与其具有一致性。提示LncRNANEAT1可能是急性脑梗死的新型生物标志物。既往研究表明,大脑中动脉阻塞后LncRNA-NEAT1异常高表达,敲除后可通过减少激活的小胶质细胞数量及促炎细胞因子的释放,显著减轻脑损伤[16-17]。基于上述研究推测LncRNA-NEAT1也可能通过直接影响炎症水平、组织细胞凋亡和氧化应激,进而影响急性脑梗死病情进展及脑损伤。
许多分子生物学研究揭示了miRNA在中枢神经系统中的作用机制,miRNA调控多个靶基因的特点也决定了其在急性脑梗死发生发展中的重要性[18]。本研究结果显示,急性脑梗死患者血清miR-93-5p低表达,与WANG等[5]人研究结果中小胶质细胞以及脑出血患者脑组织中miR-93-5p表达趋势一致。结合LncRNA-NEAT1,miR-93-5p的靶向关系推测LncRNA-NEAT1表达增加后通过负向调节miR-93-5p表达影响血管平滑肌细胞及上皮细胞的过度凋亡,进而促进内膜增厚或血管闭塞,这可能增强了动脉粥样硬化病变,使脑梗死程度加重。进一步说明LncRNA-NEAT1表达升高、miR-93-5p表达降低与急性脑梗死患者梗死病灶面积、神经功能缺损程度增加有关。
依据本研究结果不同预后患者中LncRNA-NEAT1,miR-93-5p表达的差异性进一步推测:LncRNANEAT1,miR-93-5p可能通过影响血管闭塞、脑组织细胞凋亡、氧化应激和炎症因子释放增加脑损伤,本研究推测机制均有待进一步基础研究验证。ROC曲线分析结果表明,当血清LncRNA-NEAT1检测水平高于2.66,miR-93-5p检测水平低于0.34时,急性脑梗死患者发生死亡的风险较高,临床医师需及时采取有效措施。
综上,急性脑梗死患者血清LncRNA-NEAT1高表达,miR-93-5p低表达,其表达异常与梗死病灶面积、神经功能缺损程度及预后均有关。LncRNANEAT1,miR-93-5p有作为急性脑梗死患者病情监测及预后预测指标的潜力。然而本研究仍存在局限性:样本量较少且缺乏对不同时间点急性脑梗死患者血清LncRNA-NEAT1,miR-93-5p水平的动态检测,今后将通过动态监测指标变化情况,结合影像学结果及患者临床表现进一步探讨二者在预后中的作用。

