AML和ALL患者骨髓DNMT1,SFRP1基因甲基化及其与临床病理特征和预后相关性研究
陈 莉,张丛丛,李青山,索晓慧,吉慧娟,刘洪峰
(邯郸市中心医院a.血液内科;b.骨科,河北邯郸 056001)
近年来,随着现代工业的快速发展,化学因素、物理因素、生物因素、环境污染等均成为诱发恶性血液病的直接原因,导致其发病率逐年增高,严重威胁着人类的生命,其中急性白血病病情发展迅速,患者预后生存率较低[1]。若能在早期及时诊断发现,并进行适当治疗,对延长患者生存周期、提高患者生存质量具有十分重要的意义。研究发现,白血病的发生发展可能与基因的异常变化有关,其中DNA甲基化在恶性血液病中的研究是现代社会研究的热点[2-3]。DNA甲基化转移酶1(DNA methyltransferase 1,DNMT1)在DNA甲基化修饰过程中起关键作用,其异常的高甲基化可以引起抑癌基因的失活,导致慢性白血病向急性转化[4]。分泌型卷曲相关蛋白1(secreted frizzled related protein 1, SFRP1)作为Wnt信号通路的拮抗剂,可以通过其启动子区甲基化导致其表达水平下调,促进Wnt 通路靶基因过度表达,引起肿瘤细胞过度增殖、促进其迁移和侵袭,诱导凋亡[5]。目前,已有研究报道DNMT1和SFRP1基因甲基化状态可能在多种恶性肿瘤的发生发展中发挥作用[6-7],但在急性白血病患者中该基因的报道还较少,故本研究检测探究了骨髓标本中DNMT1和SFRP1基因甲基化状态及其mRNA表达水平与急性髓系白血病(acute myeloid leukemia,AML)和急性淋巴细胞白血病(acute lymphoblastic leukemia,ALL)患者临床病理及预后的关系,报道如下。
1 材料与方法
1.1 研究对象 选取2019年11月~2020年11月于邯郸市中心医院新诊断的急性白血病患者70例,其中AML患者50例,男性 26例,女性24例,年龄15~66(41.62±10.12)岁,临床分型包括:M1 5例,M2 25例,M3 5例,M4 6例,M5 9例;ALL患者20例,男性12例,女性8例,年龄15~64(45.10±8.64)岁。纳入标准:①所有急性白血病患者均经细胞形态学和流式细胞免疫分型等检查确诊;②所有患者符合法-美-英分型系统(French-American-British classification systems, FAB)分型标准;③随访资料完整;④本研究经医院伦理委员会批准,所有患者均知情并同意。排除标准:①存在心、肺、肾等重要器官功能障碍;②并发其它恶性肿瘤影响本研究者。另选取同时期诊断为非恶性血液病患者65例作为对照(包括贫血29例、原发性血小板减少36例),其中男性39例,女性26例,年龄15~62(39.10±9.53)岁。三组患者在性别、年龄比较中差异无统计学意义(P>0.05),具有可比性。
1.2 仪器与试剂 DNA提取试剂盒、反转录试剂盒(美国Sigma公司);紫外分光光度计(北京卓立汉光仪器有限公司);PCR仪(南京贝登医疗股份有限公司);PCR引物(武汉博士德生物工程有限公司);酶标仪(深圳迈瑞生物医疗电子股份有限公司)。
1.3 方法
1.3.1 治疗方案:AML患者治疗方案及细胞遗传学预后分组参照《中国急性髓系白血病诊疗指南2017 版》,非M3型AML患者的化疗方案以蒽环类药物+阿糖胞苷为基础;M3型AML患者采用以维甲酸联合砷剂的诱导巩固方案;ALL患者的治疗方案及细胞遗传学预后分组参照中国《成人急性淋巴细胞白血病诊疗规范 2018 版》,化疗方案均以柔红霉素+长春新碱+左旋门冬酰胺酶+泼尼松为基础。化疗后疗效诊断参照血液病诊断及疗效标准[8],完全缓解是指临床、血象及骨髓细胞学缓解。
1.3.2 骨髓标本单个核细胞分离:所有患者入院后均予以常规骨髓检查,采用肝素抗凝管于髂后上棘取患者化疗前骨髓3~5 ml,加入淋巴细胞分离液,梯度离心获得骨髓单个核细胞沉淀,-80 ℃冻存备用。
1.3.3 MSP检测DNMT1和SFRP1基因甲基化状态:根据DNA试剂盒提取骨髓标本中的总DNA,紫外分光光度计检测其纯度,A260nm/A280nm比值一般在1.8~2.0之间即为提取成功,根据甲基化检测试剂盒对DNA进行修饰。反应体系为25 μl,反应条件为95 ℃ 3 min(预变性),95 ℃ 30 s(变性),60 ℃ 30 s(退火),72 ℃ 45 s(延伸),共 35 个循环。PCR 产物在2g/dl琼脂糖凝胶电泳30 min后凝胶成像仪下观察并拍照。基因甲基化特异性PCR引物设计见表1。

表1 DNMT1和SFRP1基因甲基化特异性PCR引物
1.3.4 PCR检测DNMT1,SFRP1和β-catenin mRNA表达水平:首先提取骨髓标本中总RNA,使用反转录试剂盒合成cDNA,并以此作为模板进行RT-PCR扩增,扩增体系为25 µl,实时PCR条件:94℃5 min(预变性),94℃40 s(变性),40℃40 s(退火),72℃1 min(延伸),循环35次。采用荧光定量PCR仪进行检测,以GAPDH为内参,采用相对定量2-ΔΔCt法计算目的基因相对表达水平。引物序列见表2。
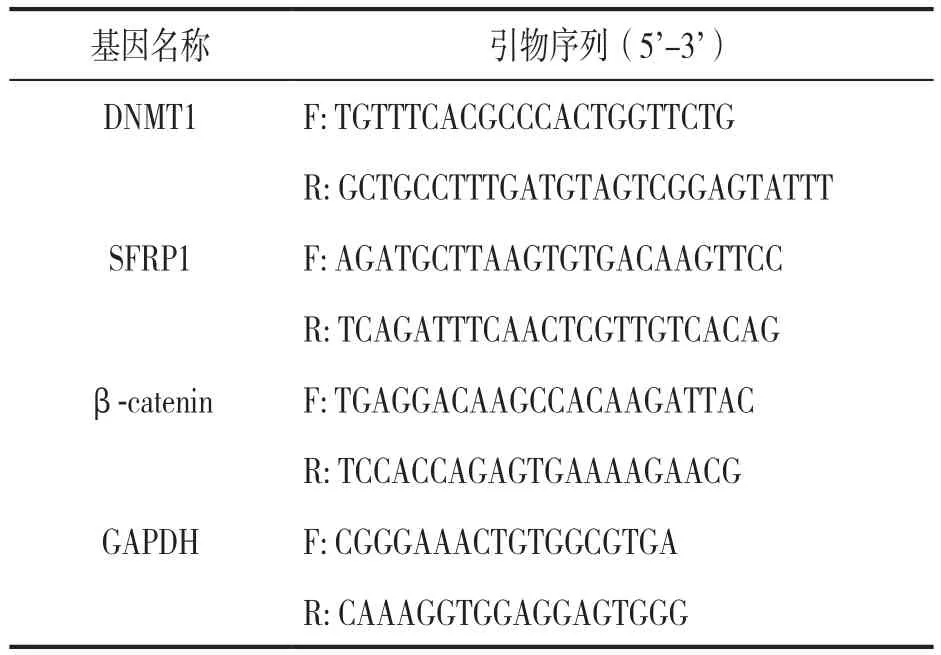
表2 PCR引物序列
1.3.5 随访:对所有AML和ALL患者采用门诊复查及电话的方式进行随访,随访内容包括:患者一般情况、是否生存、有无复发等,时间截止到2021年11月,观察患者术后生存情况,观察终点为患者死亡或随访时间截止。
1.4 统计学分析 采用SPSS 22.0软件进行数据分析,骨髓标本中DNMT1,SFRP1和β-catenin相对表达水平等计量资料符合正态分布的以均数±标准差(±s)表示,两组间比较采用独立样本t检验;多组间比较采用One Way ANOVA分析,组间两两比较采用LSD检验。DNMT1,SFRP1基因甲基化状态等计数资料以(n%)表示,组间比较采用卡方检验。相关性分析用Pearson法,生存情况采用Kaplan-Meier法进行Log-rank检验。P<0.05为差异有统计学意义。
2 结果
2.1 急性白血病患者DNMT1和SFRP1基因甲基化状态 AML组和ALL组患者中,DNMT1基因甲基化发生率(26.0%,25.0%)均低于正常对照组(73.8%),差异有统计学意义(χ2=47.683,P<0.05);SFRP1基因甲基化发生率(78.0%,85.0%)均高于正常对照组(18.5%),差异有统计学意义(χ2=55.265,P<0.05)。
2.2 急性白血病患者骨髓中DNMT1,SFRP1和β-catenin mRNA 表达水平 见表3。与对照组相比,AML组和ALL组患者化疗前DNMT1和β-catenin mRNA表达均显著升高(t=8.361,10.456;4.807,9.202),SFRP1表达水平显著下降(t=24.791,12.069),差异均有统计学意义(均P<0.05)。与化疗前相比,AML组和ALL组患者化疗后DNMT1和β-catenin mRNA表达水平均显著下降(t=6.374,5.097;3.461,4.008),SFRP1表达水平显著上升(t=17.076,7.454),差异均有统计学意义(均P<0.05)。
表3 三组患者骨髓中DNMT1,SFRP1和β-catenin mRNA 表达水平比较(±s)
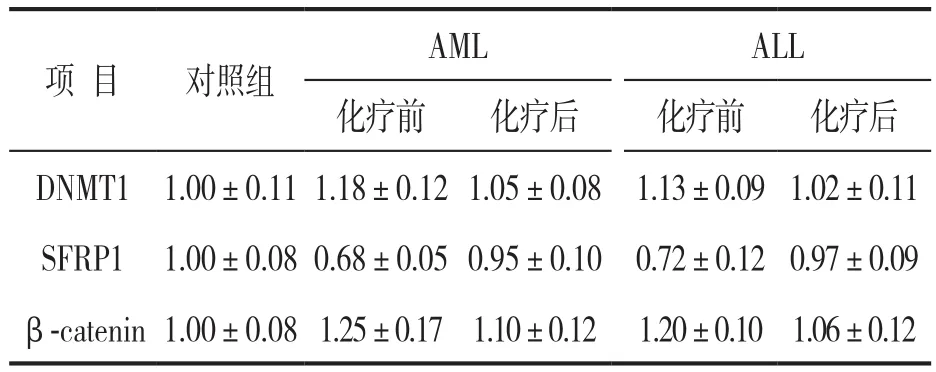
表3 三组患者骨髓中DNMT1,SFRP1和β-catenin mRNA 表达水平比较(±s)
项 目 对照组AML ALL化疗前 化疗后 化疗前 化疗后DNMT1 1.00±0.11 1.18±0.12 1.05±0.08 1.13±0.09 1.02±0.11 SFRP1 1.00±0.08 0.68±0.05 0.95±0.10 0.72±0.12 0.97±0.09 β-catenin 1.00±0.08 1.25±0.17 1.10±0.12 1.20±0.10 1.06±0.12
2.3 DNMT1和SFRP1基因甲基化与AML,ALL患者临床病理参数的关系 见表4和表5。AML患者骨髓中DNMT1基因甲基化与WBC水平、遗传学预后分组有明显相关性(P<0.05);SFRP1基因甲基化与WBC水平、BM水平及遗传学预后分组有明显相关性(P<0.05)。ALL患者骨髓中DNMT1基因甲基化与遗传学预后分组有明显相关性(P<0.05);SFRP1基因甲基化与WBC水平、遗传学预后分组有明显相关性(P<0.05)。
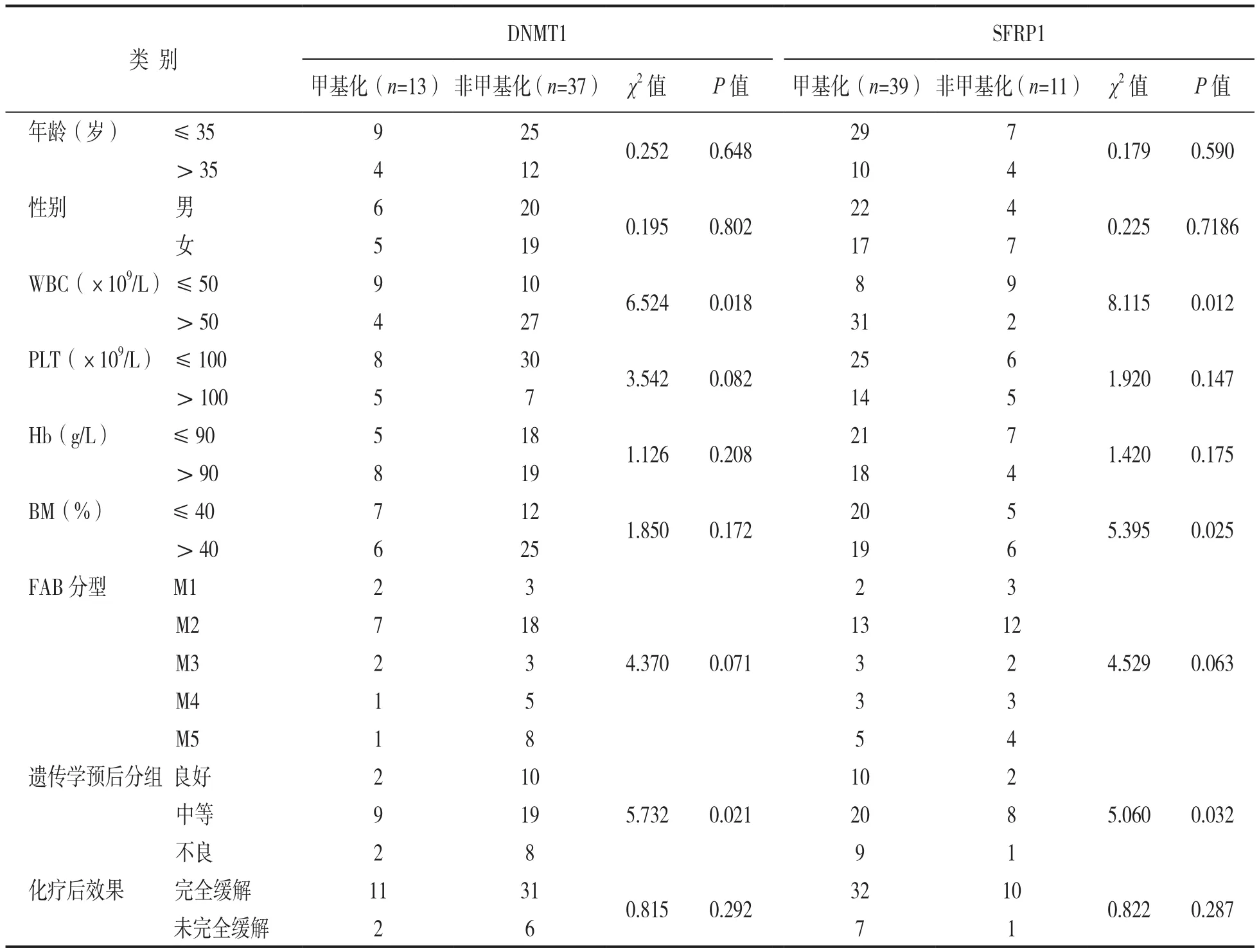
表4 AML患者DNMT1和SFRP1基因甲基化与临床病理参数的关系
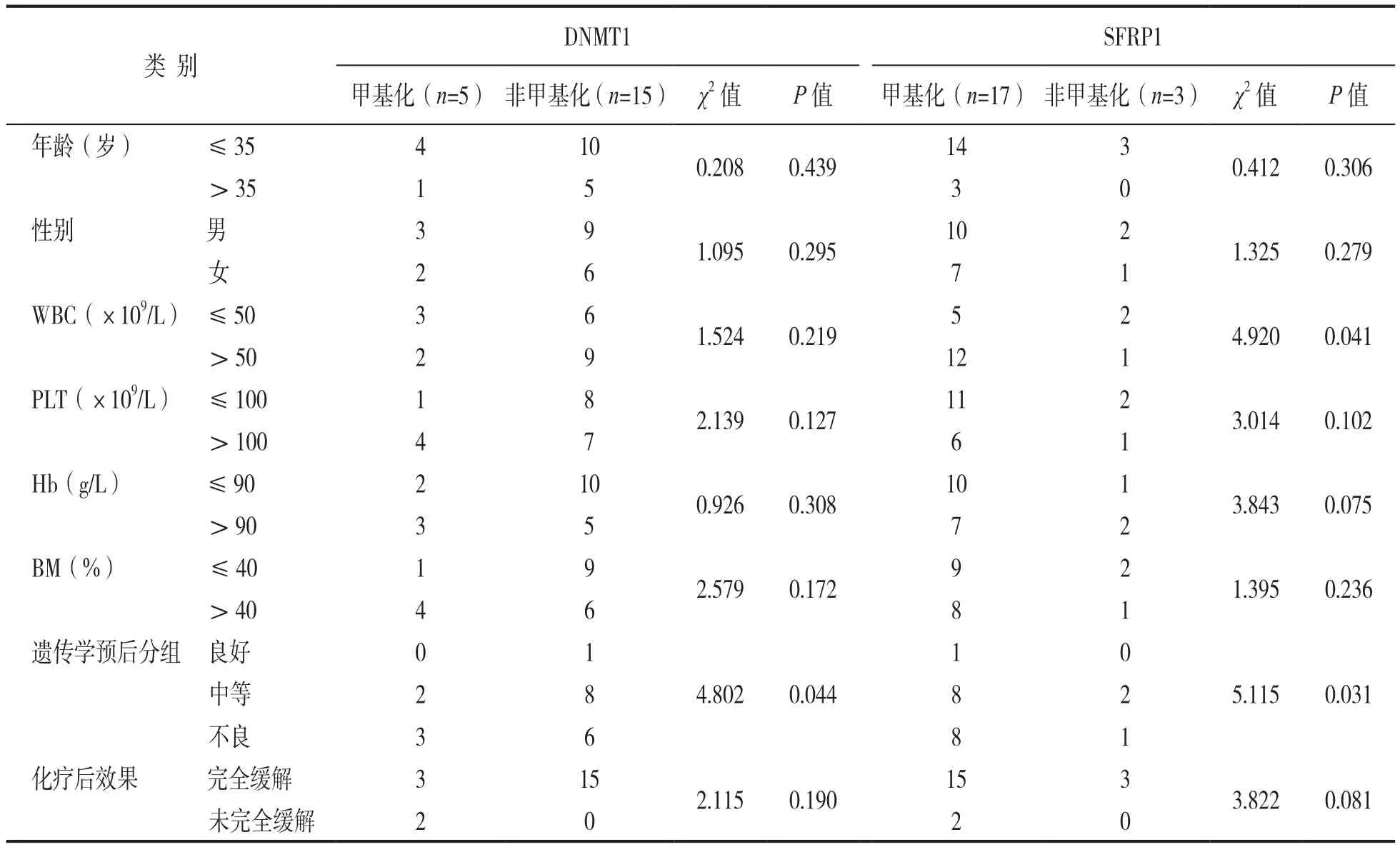
表5 ALL患者DNMT1和SFRP1基因甲基化与临床病理参数的关系
2.4 DNMT1,SFRP1和β-catenin mRNA表达水平的相关性分析 Pearson相关性分析显示,AML患者DNMT1与SFRP1表达呈明显负相关(r=-0.328,P<0.05),SFRP1与β-catenin表达呈明显 正 相 关(r=0.682,P< 0.05)。ALL患 者DNMT1与SFRP1表达呈明显负相关(r=-0.315,P<0.05),SFRP1与β-catenin表达呈明显正相关(r=0.728,P<0.05)。两组患者DNMT1与β-catenin表达均无明显相关性(P>0.05)。
2.5 DNMT1和SFRP1基因甲基化对患者预后的影响 见图1和图2。截止2021年11月,随访时间1~24个月,中位随访时间11个月。AML组和ALL组发生DNMT1基因甲基化患者生存率分别为61.15%和63.55%,均高于其未发生甲基化患者的生存率(43.24%,46.66%),差异有统计学意 义(χ2=3.862,3.679,P< 0.05)。AML组 和ALL组发生SFRP1基因甲基化的患者生存率分别为38.46%和43.50%,均低于其未发生甲基化患者的生存率(63.64%,66.67%),差异亦有统计学意义(χ2=2.927和3.155,P<0.05)。
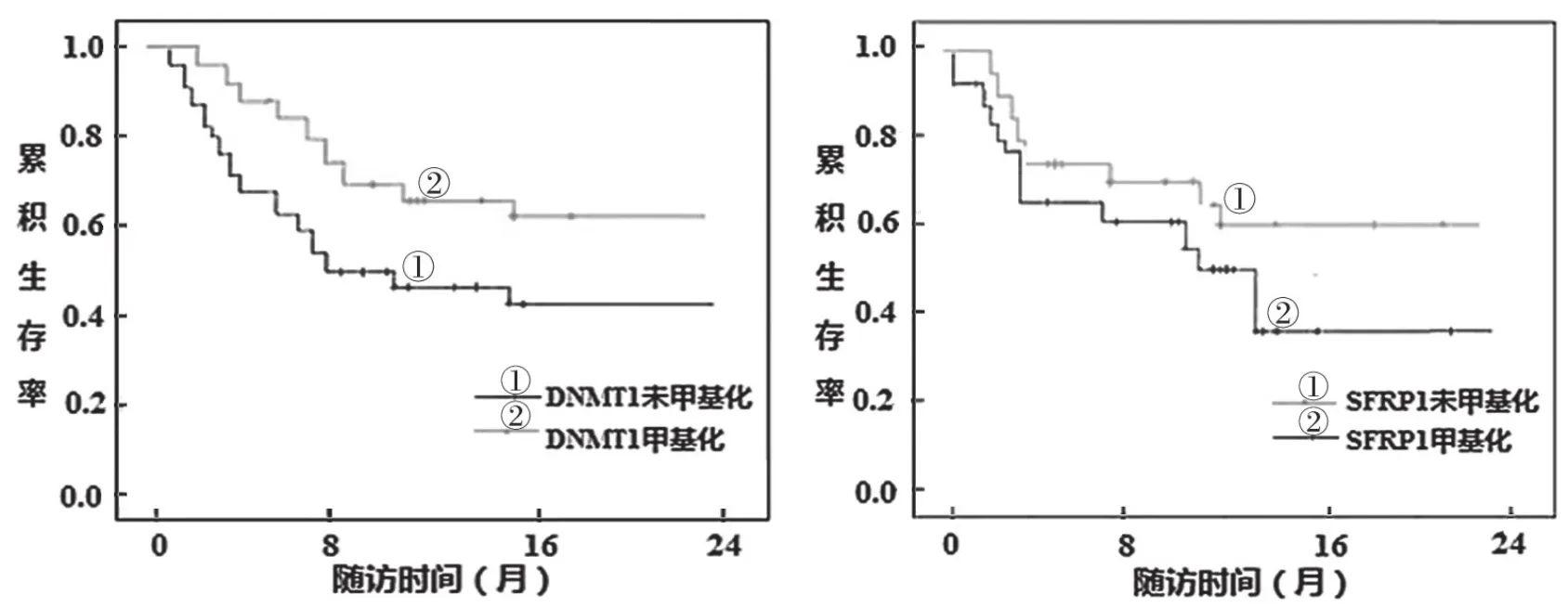
图1 AML患者DNMT1和SFRP1基因甲基化生存曲线
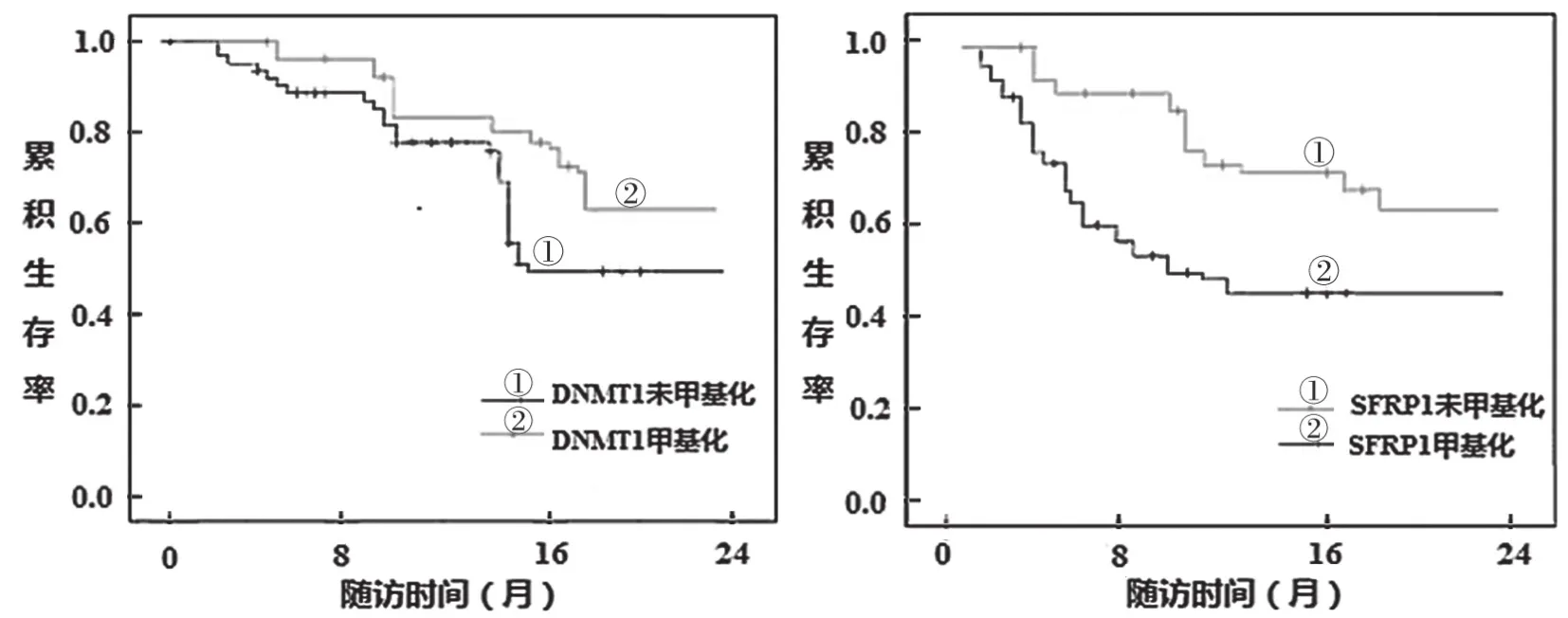
图2 ALL患者DNMT1和SFRP1基因甲基化生存曲线
3 讨论
由于恶性血液病起病缓急程度不一样,早期症状不易被重视,导致患者错失最佳治疗时机,且治疗效果不佳,很难彻底治愈,因此探究恶性血液病肿瘤发生发展的分子遗传学机制对早期诊断及预后具有指导性作用。表观遗传学包括组蛋白修饰、DNA甲基化和非编码RNA调控,近年研究表明,表观遗传学异常调控在恶性血液病发展进程中至关重要,以DNA甲基化为重要形式,是调控真核细胞发育过程中基因表达的关键信号,其失调在髓系肿瘤中普遍发生[9,2]。CpG局部甲基化的异常升高及基因整体甲基化的降低是诱发癌症的重要原因[10]。且有文献报道,DNA甲基化异常是AML发生的关键事件,对基因甲基化的鉴定可作为AML治疗及预后评估的依据[11]。抑癌基因启动子甲基化可造成基因沉默,是慢性髓系白血病发生的重要分子机制[12]。故进一步了解DNA甲基化可为恶性血液病的临床治疗提供依据和伦理基础。
DNMT1是DNA进行复制修复并维持其正常甲基化的关键酶,具有调节细胞周期和调控肿瘤抑制基因表达的能力,在肿瘤的形成、进展、转移及不良预后等方面发挥重要作用[4]。既往VAZ等[13]采用小鼠模型探究了表观遗传改变对体内形成腺鳞状细胞肺癌的影响,结果显示,在正常肺上皮细胞中上调DNMTl基因,可诱导正常细胞朝向肿瘤细胞甲基化模式发生变化,推测DNMT1诱导的表观遗传异常可能促使癌基因由衰老转变为参与肺癌起始的单个关键癌基因。吴圣豪等[14]研究表明,AML患者中DNMT1基因表达升高,与WBC计数、外周血幼稚细胞比例呈正相关,提示DNMT1能够促使白血病细胞从骨髓释放到外周血,迁移至髓外形成浸润病灶,并发现其高表达患者预后较差,可作为判断AML预后指标。另据研究报道,SFRPs家族可以与Fzd受体竞争性结合Wnt蛋白,导致Wnt信号通路受阻,抑制肿瘤细胞增殖,促进凋亡[15]。SFRP1基因缺失涉及表观遗传学改变及基因调控,DNA甲基化是SFRP1沉默的主要机制[16]。徐成波等[17]研究发现,SFRP1基因在ALL细胞株中呈完全甲基化状态,当SFRP1基因高甲基化状态逆转时,SFRP1基因表达恢复。LIU等[18]探索发现,SFRP1基因在结直肠肿瘤组织中经常被高甲基化,且SFRP1的启动子高甲基化可能被认为是结直肠癌患者术后生存优势的独立预后预测因子。
本研究通过MSP法检测发现,AML和ALL患者骨髓中DNMT1基因甲基化发生率较低,SFRP1基因甲基化发生率较高。与前期文献相比,虽然其甲基化检出率存在一定的差异,但多数研究指出,急性白血病患者至少有一种以上的Wnt信号通路拮抗因子发生甲基化[19],结合本研究结果,进一步证实了AML 和ALL患者中存在有SFRP1基因启动子甲基化,这一机制在急性白血病的发生过程中意义重大。此外,本研究还发现,AML和ALL患者化疗前DNMT1 相对表达显著升高,SFRP1相对表达显著下降,化疗缓解后其表达水平反之,推测基因启动子甲基化导致基因转录障碍,mRNA和蛋白表达水平则随之下降,与JEZIORSKA等[20]报道基因启动子区发生甲基化后,mRNA表达水平则降低,进而抑制肿瘤发生增殖和迁移相吻合。
β-catenin是经典Wnt通路的关键因子,它由胞浆向胞核的转移被认为是Wnt通路激活后行使功能的标志[21]。本研究中AML和ALL患者骨髓中β-catenin 表达显著升高,说明Wnt通路参与了血液系统恶性肿瘤的发生发展。相关分析显示,β-catenin与SFRP1表达呈正相关,而SFRP1表达受DNMT1的负向调控,进一步推断DNMTs家族的表达增高,可使SFRP1基因启动子甲基化程度降低,SFRP1表达升高,进而阻止Wnt通路的持续激活。这与LI等[22]报道的阻断Wnt/β-catenin信号途径可以抑制肿瘤细胞增殖和侵袭,促进凋亡相一致。另发现,AML和ALL发生DNMT1基因甲基化的患者生存率较高,SFRP1基因甲基化患者生存率较低,提示DNMT1和SFRP1基因甲基化状态可以作为判断急性白血病患者预后的分子标志物。但本研究还存在一定的局限性,纳入的样本数较少,后期可扩大样本量,通过更多的数据进一步研究论证;另Wnt通路参与血液系统恶性肿瘤发生发展的机制也仍需进一步探究阐明。
综上所述,DNMT1和SFRP1基因甲基化与恶性血液病患者临床病理及预后相关,究其原因可能与DNMT1和SFRP1基因甲基化异常激活Wnt/β-catenin信号通路有关。

