慢性盆腔炎模型大鼠中miR-29及炎症信号通路分子的表达水平及其作用机制研究
马慧敏,杨丽红,金瑞林,王娟娟(解放军陆军第81集团军医院妇产科,河北张家口 075000)
慢性盆腔炎是女性内生殖器及其周围结缔组织、盆腔腹膜的慢性炎症。常为急性盆腔炎未彻底治疗,或急性盆腔炎的病程迁延及反复发作,造成慢性盆腔炎[1-2]。微小核糖核酸(micro RNA,miR)在真核生物中表达具有组织特异性和时序性,决定组织和细胞的功能特异性,在细胞生长和机体发育过程的调节过程中起多种作用,并参与了炎症相关的多种疾病发生发展[3-4]。miR-29参与了胰岛素刺激的糖代谢并且是脂质氧化的重要调节因子,与人体生理和2型糖尿病有关,又可以作为一种肿瘤抑制因子抑制肿瘤的发生发展,在机体中发挥着多种重要生理调控功能,但miR-29在慢性盆腔炎中的作用研究较少并且机制尚有待解析[5-6]。本研究先用机械损伤及接种混合菌的方法构建大鼠慢性盆腔炎模型,并观察大鼠盆腔炎中miR-29表达的改变,再通过下调大鼠盆腔炎中miR-29表达,进一步观察慢性盆腔炎大鼠中炎症因子释放水平及Toll样受体4/核因子κB (TLR4/NF-κB)途径的变化,为miR-29在慢性盆腔炎的靶向治疗应用提供理论基础和分子机制。
1 材料与方法
1.1 动物来源 80只8~10周龄雌性SPF级SD大鼠,220±20g, 由北京科兴生物制品有限公司提供[SYXK(京)2019-0053]。大鼠饲养于SPF级鼠房,室温调节在25±2℃,相对湿度40%~65%,12/12h昼夜交替照明,自由摄取食物和饮用水。适应性饲养一周后,随机分为四组,每组20只。
1.2 仪器与试剂 混合菌液(无锡赛维科技公司);苏木精(H9627),伊红(861006)(美国sigma 公司);Rat IL-6(interleukin-6) ELISA kit(H007),Rat IL-8 (interleukin-8)ELISA kit(H008),Rat IL-1β(interleukin-1β)(H002)ELISA kit 检测试剂盒(南京建成生物工程研究所 );Rat TNF-α(tumor necrosis factor α)ELISA kit(RAB0479)(美国Sigma公司);逆转录试剂盒(6110A)(日本Takara公司);荧光定量PCR试剂盒(RT0411-01)(美国Biomiga公司);引物由上海生工合成;Anti-TLR4(Toll like receptor) antibody (ab22048),Anti-NF-kB(Nuclear factor activated B cells κ- Light chain reinforcement) p65 antibody (ab16502),Anti-IKB alpha(Inhibitory Subunit of NF Kappa B Alpha)antibody (ab32518),Anti-GAPDH antibody (ab9485)和二抗(ab150113)抗体(美国ABCAM公司)。MD pectraMax190酶标仪(美国);-80℃超低温保存箱(美国 Thermo 公司),4℃冰箱(合肥美菱股份有限公司),SC-3610 低速离心机(安徽中科中佳科学仪器有限公司),一次性使用微量采血管(泰州市宇杰医疗器械有限公司),DM-BA400-B显微镜(美国Motic 公司),Applied Biosystems 7500fastqPCR仪(美国Thermo公司),Western blot电泳仪(美国BIO-RAD公司),Multiskan SkyHigh全波长酶标仪(美国Thermo公司)。
1.3 方法
1.3.1 大鼠慢性盆腔炎模型的建立:大鼠称重采用5g/dl戊巴比妥钠腹腔注射麻醉。菌液配置:金黄色葡萄球菌、大肠埃希菌、乙型溶血型链球菌,按照1∶2∶1混合,用NaCl配制终浓度为2×109/ml菌液混合液。用水合氯醛麻醉大鼠后,将大鼠固定,无菌条件下腹部中央切1cm切口,固定并暴露大鼠双侧子宫,机械损伤子宫内膜组织,并分别向双侧子宫腔注入0.1ml混合菌液,建立慢性盆腔炎模型[7],试验组造模后尾静脉注射5nmol miR-29 antagomiR,NC组尾静脉注射5nmol NC antagomiR,模型组和对照组注射等体积生理盐水,每3天1次,连续注射4次。建模后14天各组大鼠眼眶取血后,处死大鼠,取子宫进行实验,HE染色见大鼠子宫组织中淋巴细胞浸润并可见腺体增生,纤维结缔组织增生,提示造模成功。
1.3.2 大鼠子宫组织HE染色:对各组大鼠子宫进行固定包埋后切片,脱蜡覆水,苏木精染色5 min,5g/dl乙酸1 min,伊红染色1min,脱水:70g/dl,80g/1dl,90g/dl,100g/dl酒精各10s,二甲苯1 min,通风橱自然晾干再封片,于显微镜100×下进行拍照[8]。
1.3.3 采血方式及ELISA检测:毛细管眼眶采血,每只大鼠1ml,4℃ 3 000r/min 10 min分离血清后,严格按照ELISA试剂盒说明,分别加入到标记抗体(IL-6,IL-8,IL-1β,TNF-α)的酶标板中,37 ℃,30 min,加入底物液,每孔100 μl,置37℃避光放置5 min,加入终止液显色,每孔加入反应终止液50μl终止反应,于20min内测定实验结果,酶联检测仪测定吸光度(A)值,每组实验设置3个复孔[9]。
1.3.4 qPCR检测大鼠子宫组织mRNA的表达:大鼠子宫组织总mRNA采用Trizol法提取,miRNA逆转录和扩增使用cDNA Synthesis Kit试剂盒和SYBR Green PCR Master Mix Kit,分别使用GAPDH和U6作为内参,所有操作在冰上进行并避免RNA酶污染。反转录进行qPCR,扩增条件:95 ℃ 预变性 10 min,95 ℃ 变性 10 s,60 ℃退火 30 s,72℃延伸 20 s,共40个循环。所有操作在冰上进行并避免RNA酶污染,以2-△△Ct计算miR-146a,TLR4,NF-κB和IκBα相对表达量,引物序列见表1[10]。

表1 引物序列
1.3.5 Western blot 检测大鼠子宫组织蛋白的表达:液氮研磨组织后提取子宫组织总蛋白后使用BCA法测定蛋白浓度。加入5×SDS的蛋白上样缓冲液煮沸后冻于-80℃备用。SDS-PAGE 电泳80v15min,120v 2h,PVDF膜转模120v 2.5h,TBST 漂洗3次,每次10min,使用5g/dl脱脂奶粉封闭,TBST漂洗3次,每次10min,加入TLR4,NF-κB,IκBα和GAPDH一抗、二抗室温孵育后,TBST漂洗3次,每次10min,ECL显色,发光仪曝光、拍照[11]。
1.4 统计学分析 采用 SPSS22.0软件进行统计学分析,实验独立重复三次,计量资料以均数±标准差(±s)表示,符合正态分布并且满足方差齐性数据采用双尾独立样本t检验,P<0.05为差异具有统计学意义。
2 结果
2.1 慢性盆腔炎大鼠子宫动物模型构建 见图1。对照组子宫组织细胞整齐排列,各层无充血血管,炎症细胞无浸润,模型组和NC组组织结构不清晰,各层分界不明显,细胞变形,可见大量炎性细胞浸润,出现典型的慢性盆腔炎表征。试验组细胞排列较阴性对照组和模型组整齐,无充血血管,有少量炎症细胞浸润,分界相对明显,慢性盆腔炎表征有显著缓解。

图1 各组大鼠子宫组织HE染色比较(100×)
2.2 各组大鼠外周血的炎症因子水平变化 见表2。与对照组相比,模型组、NC组外周血IL-1β,IL-6,IL-8和TNF-α水平均显著升高,试验组稍增高,但差异无统计学意义。试验组外周血炎症因子 IL-1β,IL-6,IL-8和 TNF-α 水平较模型组、NC降低,差异具有统计学意义(F=23.021~35.947,均P<0.01)。

表2 各组大鼠血浆炎症因子分析
2.3 各组大鼠子宫组织miR-29表达 对照组、模型组、NC组、试验组的大鼠子宫组织miR-29表达水平分别为0.76±0.026,1.68±0.031,1.72±0.024和0.41±0.014,与对照组相比,模型组和NC组子宫组织miR-29 水平上升,试验组子宫组织miR-29 表达稍有降低,差异无统计学意义。与模型组和NC组相比,试验组子宫组织miR-29 表达水平降低,差异具有统计学意义(t=5.015,7.678,均P<0.01)。
2.4 各组大鼠子宫组织TLR4/NF-κB炎症通路表达 见表3、表4。qPCR及Westernblot结果表明与对照组相比,模型组和NC组炎症相关分子TLR4,F-κB和IκB α mRNA及蛋白表达水平升高;与模型组和NC组相比,试验组mRNA及蛋白表达水平降低,差异具有统计学意义(F=18.045~27.081,均P<0.01)。

表3 各组大鼠子宫组织TLR4/NF-κB mRNA分析
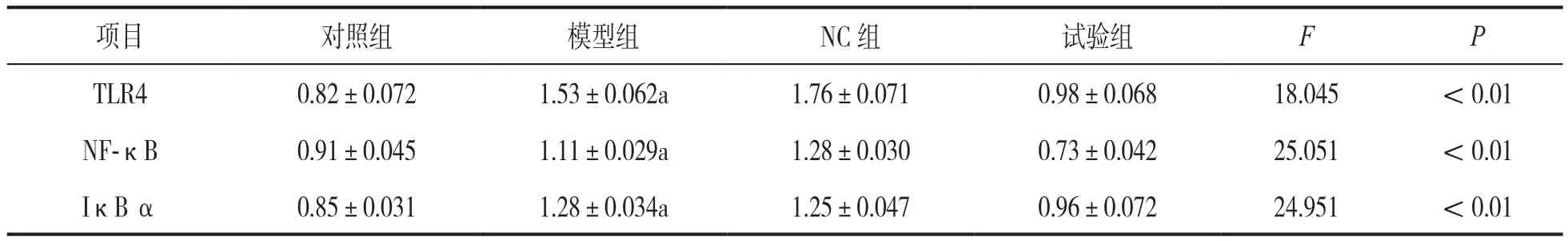
表4 各组大鼠子宫组织TLR4/NF-κB蛋白分析
3 讨论
慢性盆腔炎是一种上生殖道感染,沙眼衣原体和淋病奈瑟菌是常见的病原体,未经治疗的盆腔炎可导致慢性盆腔疼痛、不孕、异位妊娠和腹腔内感染[12]。慢性盆腔炎性疾病在初潮前、无性生活和绝经后妇女很少发生,即使发生也多为邻近器官炎症的扩散,而在性活跃期、有月经的妇女中盆腔炎性疾病高发,慢性盆腔炎性疾病若未能得到及时、彻底治疗,可导致输卵管妊娠,炎性反复发作,甚至不孕,严重影响妇女的生殖健康,西医、中医等多种临床诊断疗法在中国已被广泛应用于慢性盆腔炎[13]的治疗。因此本研究拟探究慢性盆腔炎过程中子宫组织的损伤及病理变化,探究炎症因子及炎性细胞在此过程中发挥的作用。本研究通过机械损伤及接种混合菌成功构建大鼠慢性盆腔炎模型,发现造模后大鼠子宫形态异常,质地变硬,输卵管出现充血、增粗、阻塞或积水,盆腔脏器与周围结缔组织出现增生、黏连,由此提示造模成功。同时本研究发现在大鼠慢性盆腔炎过程中,子宫组织出现出血、黏连等恶性病变,腺体明显减少,子宫平滑肌纤维组织增生、黏连,上皮细胞变性、脱落、坏死,宫内膜缺失等现象,并伴有炎性细胞浸润,出现典型组织损伤,提示炎症损伤是慢性盆腔炎进展的重要因素,炎性细胞浸润和炎症因子的表达可能是子宫组织损伤的重要原因。
非编码RNA(non-coding RNA)是指不编码蛋白质的RNA,文献表明miR-29参与多种生物学过程,miR-29b能通过正向调节缺氧诱导因子(hypoxia inducible factor-1,HIF-1)的相对表达量来提高超氧化物歧化酶(superoxide dismutase,SOD)的活性,降低丙二醛(malondialdehyde,MDA)含量,从而促进细胞自噬,发挥对缺血损伤心肌细胞的保护作用[14]。同时miR-29可通过下调YY1和TGF-β途径蛋白改善骨骼肌萎缩和减轻肾纤维化[15],也有研究发现HCC患者血浆中miR-29a含量和AFP浓度具有显著相关性,可能成为HCC诊断的参考指标[12],由此可见miR-29可以在多种疾病中发挥关键的诊断作用,但miR-29在盆腔炎中的作用少有描述。因此本研究探究了miR-29在慢性盆腔炎发病过程中是否发生表达水平的改变。结果表明大鼠慢性盆腔炎过程中伴随着miR-29的高表达,通过下调miR-29的表达,发现miR-29可参与IL-1β,IL-6,IL-8和TNF-α等炎症因子的调控,这与当前研究表明的慢性盆腔炎患者外周血IL-6等炎症因子会显著增加,组织损伤加剧相一致[16]。因此我们推测miR-29具有参与炎症反应发生发展的作用,可以抑制多种炎症因子释放、降低炎性细胞浸润。
TLR4/NF-κB信号通路是免疫应答和炎症的关键调节通路[17],研究表明TLR4/NF-κB信号传导改善LPS诱导的子宫内膜炎[18]。也有研究证实了盆腔炎患者TLR变异具有种族差异[19],由此可见TLR4/NF-κB在盆腔炎等女性疾病中发挥着重要调控作用。本研究通过qPCR和Western blot分别检测了TLR4信号通路关键分子的mRNA和蛋白表达水平,结果表明,miR-29参与了TLR4,NF-κB和IκB α通路的调控,下调miR-29可以显著抑制TLR4,NF-κB和IκB α的表达。由此推测miR-29在慢性盆腔炎中的作用是通过TLR4/NF-κB信号通路的调控来实现的。
综上,本研究表明慢性盆腔炎模型大鼠子宫组织中miR-29发生显著表达,下调miR-29可以发挥抗炎症的作用及子宫保护的作用,此过程的机制与TLR4/NF-κB引发的炎症信号通路相关,本研究也具有一定的局限性,仅通过大鼠实验进行了分析,本研究可以进一步从人类组织样本中分析miR-29的表达水平及TLR4信号通路的表达情况,或通过GEO等数据库组学数据筛选miR-29的靶基因,并通过体外细胞实验和分子学验证miR的精准靶向基因,为miR-29对慢性盆腔炎的作用机制提供准确的通路互作关系。

