系统性红斑狼疮患者血清EpCAM,sB7-H3表达水平及其与疾病活动性的相关性研究
惠保卫,何 娜,王 喆,刘芯汝,黄国强,赵小莹 (汉中市中心医院血液风湿科,陕西汉中 723000)
系统性红斑狼疮(systemic lupus erythematosus,SLE)是由于机体免疫系统错误地攻击自身多个部位健康组织的自身免疫病,严重者会对心、肺、大脑、肾脏等器官造成严重伤害甚至危及生命[1]。寻找相关的生物标志物有助于临床医师准确判断患者病情。上皮细胞黏附分子(epithelial cell adhesion molecule,EpCAM)参与细胞黏附、信号传导等一系列生物学过程[2]。研究表明,EpCAM在自身免疫病中表达增加[3]。可溶性共刺激分子B7-H3(soluble costimulatory molecule B7-H3,sB7-H3)是B7共刺激分子家族的一员,已被证实在SLE患者外周血中表达下调[4]。但两者在SLE中的共同作用尚不明确。本研究通过检测SLE患者血清EpCAM和sB7-H3水平,旨在探讨两者与患者疾病活动性的相关性。
1 材料与方法
1.1 研究对象 选取2020年6月~2022年5月汉中市中心医院血液风湿科收治的SLE患者135例作为SLE组,其中男性36例,女性99例,年龄34~55(41.80±5.69)岁,平均体质量指数(BMI)22.20±1.87kg/m2。纳入标准:①符合《2020中国系统性红斑狼疮诊疗指南》中SLE的诊断标准[5];②初次发病;③参与本研究前三个月内未接受治疗;④配合度高;⑤对照组无免疫系统疾病。排除标准:①并发其他自身免疫病患者;②妊娠期或哺乳期患者;③并发糖尿病或代谢综合征患者;④伴有严重器官功能障碍患者;⑤认知异常患者。依据SLE疾病活动指数(systemiclupus erythematosus disease activity index,SLEDAI)[6]对SLE组患者进行评分:7项中枢神经系统症状及血管炎记8分,2项肌肉骨骼系统受累症状及4项肾脏受累症状记4分,3项脱发或皮肤黏膜受累症状、2项浆膜受累症状及2项免疫异常症状记2分,2项血液系统异常症状及发热记1分,各项评分相加,分值越高说明疾病活动性越强。一般认为0~4分无任何活动,5~9分为轻度活动,10~14分为中度活动,≥15分为重度活动。本研究依据SLEDAI评分将SLE组患者分为活动期组(SLEDAI≥10分,75例)和缓解期组(SLEDAI≤9分,60例)。另选取同期在本院体检中心接受体检的健康志愿者120例作为对照组,其中男性44例,女性76例,年龄35~55(42.25±5.71)岁,BMI 21.95±1.84kg/m2。两组一般资料比较差异无统计学意义(P>0.05)。所有受试者对本研究内容知情并签署同意书。本研究经本院伦理委员会批准。
1.2 仪器与试剂 库贝尔MC-600血细胞分析仪,意大利Vital公司Monitor-100全自动血沉仪,国赛Omlipo特定蛋白分析仪。抗双链DNA(抗dsDNA)抗体试剂盒(北京安必奇生物科技有限公司);EpCAM,sB7-H3试剂盒(上海羽哚生物科技有限公司)。
1.3 方法 SLE组于入院次日清晨采取10ml空腹静脉血,对照组于体检当日清晨采取10ml空腹静脉血,其中5ml置于有抗凝剂的试管内,采用血细胞分析仪检测白细胞计数(whiteblood cell count,WBC)、淋巴细胞计数(lymphocyte count,LYM)、血小板计数(platelet count,PLT);全自动血沉仪检测红细胞沉降率(erythrocyte sedimentation rate,ESR);另外5ml室温下静置60min,置离心机以3 000r/min离心10min,分离血清,转移至-80℃冰箱中保存待测。速率散射免疫比浊法测定补体C3,C4水平;酶联免疫吸附(ELISA)法测定抗双链DNA(抗dsDNA)抗体和EpCAM,sB7-H3的表达水平,具体操作规范严格遵循试剂说明书进行。
1.4 统计学分析 采用SPSS25.0 软件对本研究数据进行统计分析。EpCAM,sB7-H3等符合正态分布的计量资料以均数±标准差(±s)表示,成组设计资料比较采用t检验;SLEDAI评分不符合正态分布,以中位数(四分位区间)[M(Q1,Q3)]表示,两个样本比较行Mann-Whitney检验;计数资料以例数(%)[n(%)]表示,两组间比较采用χ2检验。Pearson相关性分析SLE组血清EpCAM与sB7-H3水平的相关性及两者与患者生化指标的相关性,Spearman相关性分析SLE组血清EpCAM,sB7-H3水平与SLEDAI评分的相关性;受试者工作特征(ROC)曲线评价血清EpCAM和sB7-H3区分SLE患者缓解期及活动期的价值,EpCAM,sB7-H3联合区分与两者单独区分ROC曲线下面积(AUC)的比较采用Z检验;P<0.05为差异有统计学意义。
2 结果
2.1 SLE组与对照组生化指标及血清EpCAM,sB7-H3表达水平比较 见表1。SLE组的WBC,LYM,PLT,补体C3,C4和sB7-H3水平均明显低于对照组,而ESR,24h UTP,抗dsDNA抗体和EpCAM水平均明显高于对照组,差异具有统计学意义(均P<0.05)。
表1 SLE组与对照组生化指标及血清EpCAM,sB7-H3表达水平比较(±s)

表1 SLE组与对照组生化指标及血清EpCAM,sB7-H3表达水平比较(±s)
项目 SLE组(n=135)对照组(n=120) t P WBC(×109/L) 3.49±0.53 7.12±1.05 35.418 0.000 LYM(×109/L) 0.84±0.19 1.92±0.41 27.472 0.000 PLT(×109/L) 113.82±20.21 216.36±40.58 25.964 0.000 ESR(mm/h) 55.39±8.70 5.65±1.26 62.040 0.000 24h UTP(g) 0.54±0.10 0.10±0.02 47.355 0.000抗dsDNA抗体(U/L) 1.63±0.51 0.40±0.09 26.056 0.000补体 C3(g/L) 0.69±0.17 1.18±0.22 20.016 0.000补体 C4(g/L) 0.26±0.05 0.51±0.13 20.693 0.000 EpCAM(ng/ml) 11.38±3.32 3.54±1.15 24.586 0.000 sB7-H3(ng/ml) 12.18±3.54 20.15±5.26 14.330 0.000
2.2 活动期组与缓解期组一般资料、生化指标、血清EpCAM,sB7-H3表达水平及SLEDAI评分比较 见表2。活动期组的WBC,LYM,PLT,补体C3,C4和sB7-H3表达水平均明显低于缓解期组,而ESR,24h UTP,抗dsDNA抗体、EpCAM水平和SLEDAI评分均明显高于缓解期组,差异具有统计学意义(均P<0.05)。两组年龄、性别、BMI比较差异无统计学意义(均P>0.05)。
表2 活动期组与缓解期组一般资料、生化指标、血清EpCAM,sB7-H3表达水平及SLEDAI评分比较[±s,n,M(Q1,Q3)]
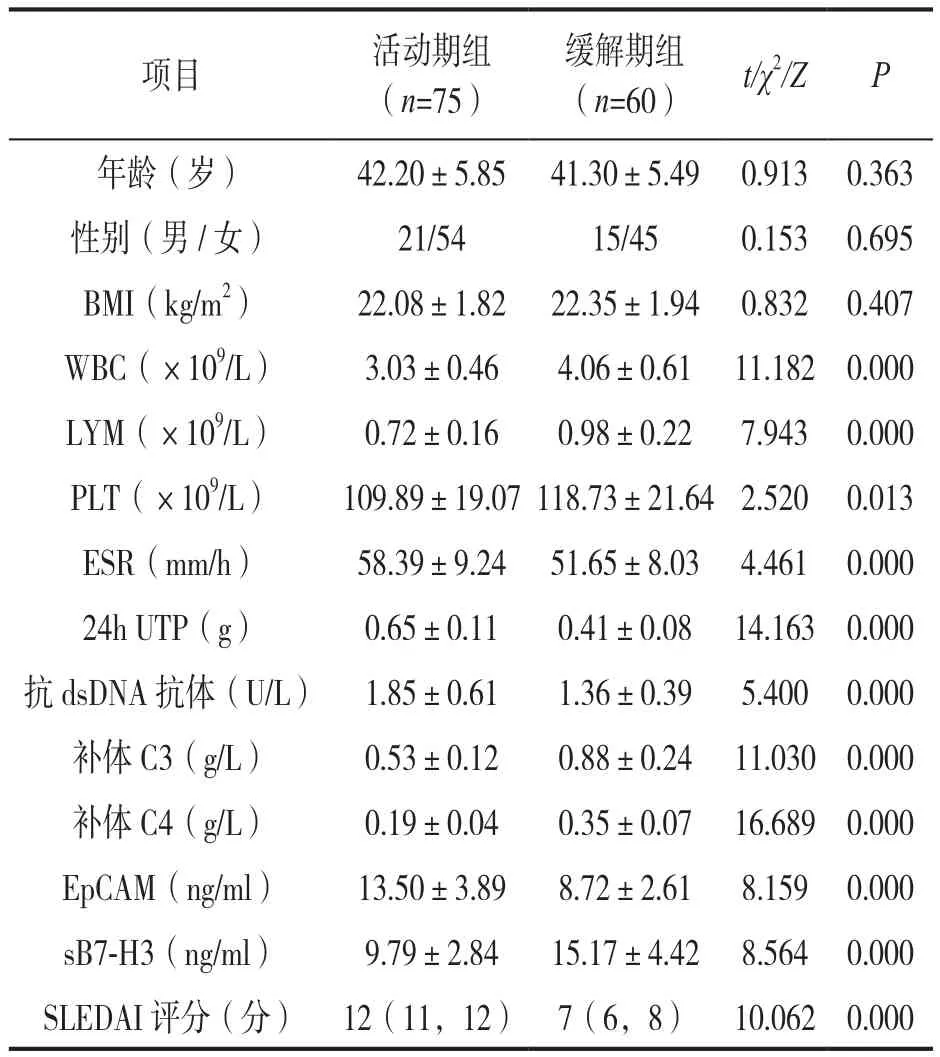
表2 活动期组与缓解期组一般资料、生化指标、血清EpCAM,sB7-H3表达水平及SLEDAI评分比较[±s,n,M(Q1,Q3)]
项目 活动期组(n=75)缓解期组(n=60) t/χ2/Z P年龄(岁) 42.20±5.85 41.30±5.49 0.913 0.363性别(男/女) 21/54 15/45 0.153 0.695 BMI(kg/m2) 22.08±1.82 22.35±1.94 0.832 0.407 WBC(×109/L) 3.03±0.46 4.06±0.61 11.182 0.000 LYM(×109/L) 0.72±0.16 0.98±0.22 7.943 0.000 PLT(×109/L) 109.89±19.07 118.73±21.64 2.520 0.013 ESR(mm/h) 58.39±9.24 51.65±8.03 4.461 0.000 24h UTP(g) 0.65±0.11 0.41±0.08 14.163 0.000抗dsDNA抗体(U/L) 1.85±0.61 1.36±0.39 5.400 0.000补体 C3(g/L) 0.53±0.12 0.88±0.24 11.030 0.000补体 C4(g/L) 0.19±0.04 0.35±0.07 16.689 0.000 EpCAM(ng/ml) 13.50±3.89 8.72±2.61 8.159 0.000 sB7-H3(ng/ml) 9.79±2.84 15.17±4.42 8.564 0.000 SLEDAI评分(分) 12(11,12) 7(6,8) 10.062 0.000
2.3 SLE组血清EpCAM与sB7-H3表达水平的相关性及两者表达水平与SLEDAI评分的相关性 Pearson相关性分析显示,SLE组血清EpCAM与sB7-H3表达水平呈负相关(r=-0.607,P=0.000);Spearman相关性分析显示,SLE组血清EpCAM水平与SLEDAI评分呈正相关(r=0.475,P=0.000),sB7-H3水平与SLEDAI评分呈负相关(r=-0.664,P=0.000)。
2.4 SLE组血清EpCAM,sB7-H3与患者生化指标的相关性 见表3。SLE组血清EpCAM与WBC,LYM,PLT,补体C3,C4水平均呈负相关,与ESR,24h UTP,抗dsDNA抗体水平均呈正相关,差异有统计学意义(均P<0.05);SLE组血清sB7-H3与WBC,LYM,PLT,补体C3,C4水平均呈正相关,与ESR,24h UTP,抗dsDNA抗体水平均呈负相关,差异有统计学意义(均P<0.05)。
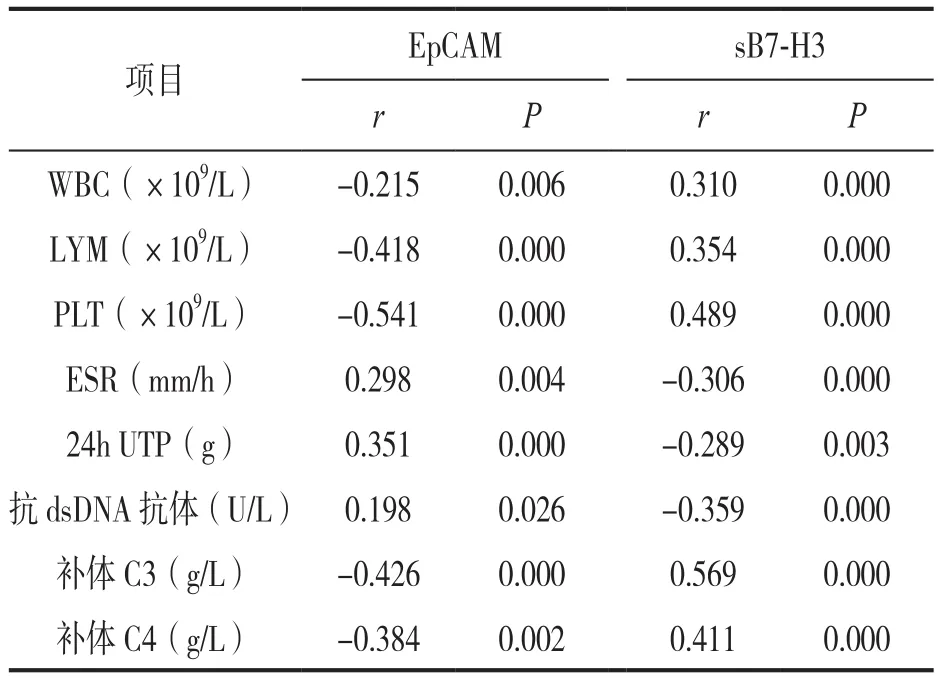
表3 SLE组血清EpCAM,sB7-H3与患者生化指标的相关性
2.5 血清EpCAM,sB7-H3区分SLE患者缓解期及活动期的价值 见图1。血清EpCAM区分SLE患者缓解期及活动期的AUC为0.816(95%CI:0.745~0.887),敏感度、特异度分别为70.7%,83.3%,截断值为11.23ng/ml;sB7-H3区分SLE患者缓解期及活动期的AUC为0.797(95%CI:0.720~0.875),敏感度、特异度分别为74.7%,75.0%,截断值为11.70ng/ml;两者联合区分的AUC为0.905(95%CI:0.853~0.958),敏感度、特异度分别为89.3%,71.7%,两者联合区分的AUC显著大于EpCAM单独区分的AUC(Z=1.978,P=0.048)和sB7-H3单独区分的AUC(Z=2.277,P=0.023)。

图1 血清EpCAM,sB7-H3区分SLE患者缓解期及活动期ROC曲线
3 讨论
SLE属于一类复杂的自身免疫性结缔组织病,患者体内产生大量的致病性免疫复合物,累积机体多个器官,主要表现为皮肤、关节、肾脏受累[7]。SLE病理机制与遗传、环境因素、内分泌等多种因素相关[8]。SLE早期诊断和分类非常困难,在确诊时往往已经发生了不可逆的器官损伤[9]。目前临床上主要采用针对免疫系统的药物如激素、免疫抑制剂等进行治疗,虽然取得一定效果,但效果并不十分理想[10]。当患者处于病情活动期时,其发热、乏力等症状容易与细菌感染混淆[11],增加了临床治疗的难度。医学界目前尚无能够区分SLE病情活动期与缓解期的金标准,因此寻求能够判断患者病情及疾病活动性的新的生物标志物,能够为临床准确判断患者病情、延缓疾病进展提供一定的理论参考依据。
SLE患者存在着免疫功能异常情况,本研究发现,SLE组补体C3,C4水平降低,这与王结珍等[12]学者的研究结果一致。SLE患者病情活动时产生的免疫复合物沉积在组织器官中,补体系统被激活,补体C3,C4参与清除免疫复合物被大量消耗[13],造成体内免疫功能异常。
EpCAM是一种分子量为40kD的同源性Ca2+非依赖性细胞-细胞黏附分子,定位于上皮细胞的基底外侧膜和浆细胞,在上皮肿瘤组织中高度表达[2,14-15],是上皮性卵巢癌的生物标志物之一[16]。本研究结果表明SLE患者血清EpCAM表达上调,在另一自身免疫病-原发性舍格伦综合征患者中,EpCAM具有类似的表现[3],可能是受到干扰素信号传导所致[17]。SLE患者免疫功能异常,体内多种与免疫相关的信号通路如核因子-κB 通路、炎性体和干扰素信号传导通路处于失调状态,EpCAM可能受这些通路调控,在SLE患者中呈现异常表达。B7-H3参与多项疾病进展,B7-H3的缺乏会导致肥胖及脂肪组织炎症[18]。本研究结果发现,SLE患者血清sB7-H3表达下调,与SUN等[4]结果一致。与SLE相关的动物实验证实,B7-H3激动剂能够改善SLE小鼠模型中的炎症症状,表明B7-H3对SLE发生和发展具有抑制作用,可能用于早期治疗SLE[19]。SLE患者sB7-H3水平降低可能是由于机体外周血中游离的sB7-H3与T细胞表面的相关B7-H3受体结合所导致[4]。当患者处于病情活动期时,机体对自身的免疫反应加剧,皮肤受累加剧,EpCAM表达增加,同时免疫细胞被大量激活,机体外周血中sB7-H3被大量消耗,因而SLE病情活动期患者血清EpCAM,sB7-H3变化更明显。SLE组血清EpCAM与sB7-H3水平呈负相关,且两者与SLE患者疾病活动性关系密切,表明EpCAM,sB7-H3在SLE病情进展过程发挥着相反作用,但两者具体的作用机制尚不清楚,需要进一步研究。采用EpCAM,sB7-H3联合区分SLE患者缓解期及活动期的敏感度更高,弥补了SLEDAI评分的局限性,在患者体内分子水平已随病情变化发生相应改变而外观表象尚未发生变化时对患者病情做出及时准确的判断。
综上所述,SLE患者血清EpCAM表达上调,sB7-H3表达下调,与疾病活动性密切相关,两者联合对于区分患者病情处于活动期还是缓解期具有一定的预测价值,为临床对SLE的诊断及病情判断提供了一定的理论依据。但本研究样本量较小,所得试验数据可能存在一定的偏颇,这与患者个体差异有关,同时由于条件限制,未探讨EpCAM,sB7-H3在SLE中的具体作用机制,后续的研究可从与免疫细胞、炎性反应相关的信号传导通路进行探讨。

