甘草对5种病毒的抑制作用及抗RSV活性部位的筛选
李忠原, 李保宏, 刘苗苗, 杨 颖, 田景振,2 *, 崔清华
(1.山东中医药大学药学院,山东 济南 250355;2.山东中医药大学青岛中医药科学院,山东 青岛 266041;3.山东中医药大学中医药创新研究院,山东 济南 250355)
甘草为豆科植物甘草GlycyrrhizauralensisFisch.、胀果甘草GlycyrrhizainflataBat.或光果甘草GlycyrrhizaglabraL.的干燥根和根茎,相关产品在国内外均占有重要份额[1],其化学成分以三萜皂苷类和黄酮类为主[2],具有抗溃疡、抑菌、抗炎、解痉、降血脂、镇痛、抗心律失常、抗肿瘤、抗病毒等作用[3-4]。目前,国内外大量报道显示甘草具有广谱抗病毒的潜力,如甘草水提物可抑制H3N2型流感病毒[5],甘草水提物与水提醇沉后的沉淀可抑制呼吸道合胞病毒(RSV)[6-7],甘草皂苷类成分可抑制H1N1型流感病毒[8-9],甘草酸可作用于新型冠状病毒(SARS-CoV-2)刺突蛋白发挥抗病毒作用[10]并抑制肠道病毒71型(EV71)[11-12]、乙型肝炎病毒(HBV)[13]、丙型肝炎病毒(HCV)[14]。本实验研究甘草对RSV、1型单纯疱疹病毒(HSV-1)、肠道病毒71型(EV71)、柯萨奇病毒B3(CV-B3)、柯萨奇病毒B5(CV-B5)的体外抗病毒效果,丰富了该药材抗病毒谱。另外,甘草可归肺经,而RSV可经呼吸道感染人体造成病毒性肺炎,并且甘草对其作用效果最强,故本实验又筛选了相关活性部位,并通过体内外实验初步探讨其作用机制。
1 材料
1.1 试剂与药物 甘草购自亳州中强中药饮片有限公司(产地新疆和田,批号191101),经山东中医药大学徐凌川教授鉴定为豆科植物甘草GlycyrrhizauralensisFisch.的干燥根和根茎。利巴韦林(批号807A021)、阿昔洛韦(批号1023A021)(北京索莱宝科技有限公司)。胎牛血清(批号42A0378K)、DMEM细胞培养液(批号8120010)、磷酸盐缓冲液(批号8120150)、0.25% EDTA胰酶(批号1951208)(美国Gibco公司);青链霉素混合液(北京白鲨易科技有限公司,批号70011000);二甲亚砜(DMSO,美国Amresco公司,批号821D035);噻唑蓝染液(美国VWR公司,批号1636C097);Nrf2试剂盒(批号B06011498)、NF-κB p105试剂盒(批号B07011499)、Keap1试剂盒(批号A16019408)(武汉华美生物工程有限公司);TLR4试剂盒(批号12/2020)、TNF-α试剂盒(批号12/2020)、IFN-β试剂盒(批号12/2020)(上海酶联生物科技有限公司)。
1.2 宿主细胞及病毒毒种 非洲绿猴肾细胞(Vero细胞)、人喉癌上皮细胞(Hep2细胞)购自上海生博生物医药科技有限公司;RSV、HSV-1、EV-71、CV-B3、CV-B5由山东省医学科学院基础医学研究所提供,保存于山东中医药大学药学院实验室。
1.3 动物 4周龄BALB/c雌性小鼠40只,体质量12~14 g,购自北京维通利华实验动物技术有限公司,实验动物生产许可证号SCXK(京)2016-0006,实验动物使用许可证号SYXK(鲁)2017-0022。
1.4 仪器 Spectra Max M5型酶标仪(美国Molecular Device公司);HFsafe-1200TE型生物安全柜、HF90型CO2细胞恒温培养箱(上海力申科学仪器有限公司);TDD5M型台式平衡离心机(长沙平凡仪器仪表有限公司);DZF-6050型真空干燥箱(上海博讯实业有限公司);ALPHA 1-4 LD plus型冷冻干燥机(德国Christ公司);CKX-31型倒置显微镜(日本Olympus公司)。
2 方法
2.1 供试品制备
2.1.1 甘草水提物 取200 g药材洗净,加12倍量水浸泡30 min,加热回流提取90 min,共2次,药液离心过滤,浓缩至原药材1 g/mL,冷冻干燥,即得。体外实验所用水提物粉末以含2% FBS的DMEM培养液配制成10 mg/mL溶液,0.22 μm微孔滤膜过滤,4 ℃下冷藏备用。
2.1.2 不同溶剂萃取部位 取药材200 g洗净,按“2.1.1”项下方法提取浓缩,依次用石油醚、二氯甲烷、乙酸乙酯、正丁醇萃取3~5次至有机层几乎无色,将各部分萃取液分别浓缩、减压干燥至干粉状,并以含2% FBS的DMEM培养液配制成6 mg/mL(正丁醇、水部位)、0.6 mg/mL(石油醚、二氯甲烷、乙酸乙酯部位)溶液(辅以1% DMSO助溶),0.22 μm微孔滤膜过滤,即得,4 ℃下冷藏备用。
2.2 体外抗病毒作用研究
2.2.1 细胞培养与复苏 液氮罐中取出保存的细胞,在37 ℃下迅速融化,于生物安全柜中将其悬液转移至无菌离心管中,1 000 r/min离心3 min,弃去上清液,加入新的细胞培养液,吹打细胞,将混悬液转移至细胞培养皿中,于CO2细胞培养箱(温度37 ℃、5% CO2、相对湿度75%)中培养,6 h后换液,继续培养待单层细胞80%汇合时,以1∶3比例传代培养。
2.2.2 病毒扩增 待细胞汇合至70%左右时,弃去原培养液,PBS清洗去除细胞碎片,加入0.2 mL病毒液(RSV、HSV-1、EV71、CV-B3、CV-B5),轻摇培养皿使病毒与细胞充分接触,于CO2细胞培养箱中培养,每15 min轻摇培养皿,2 h后弃去培养液,清洗后加入10 mL含2% FBS的DMEM培养液,每天镜检观察病变,48 h后停止培养,病毒组培养皿密封反复冻融3~4次,将病毒液转移至无菌离心管中,3 000 r/min离心3 min,取上清液分装,在-80 ℃下保存备用。
2.2.3 病毒毒力测定 将细胞以每孔1×104个的密度接种于96孔板中,在37 ℃、5% CO2下培养12 h。取“2.2.2”项下病毒液按10倍比稀释8个浓度,加于单层细胞中培养48 h,每个病毒稀释度重复6个孔,细胞病变效应法(CPE)观察感染情况,按照Reed-Muench公式计算各病毒滴度TCID50。
2.2.4 药物细胞毒性测定 将细胞以每孔1×104个的密度接种于96孔板中,在37 ℃、5% CO2下培养12 h,将“2.1”项下供试液按2倍比稀释8个质量浓度后加入到细胞中,设置3个复孔,并设细胞对照组、空白对照组,于培养箱中培养48 h,CPE法观察感染情况,用MTT法检测细胞活性,采用酶标仪于490 nm处检测光密度(OD)值,通过GraphPad Prism 5软件拟合药物CC50。
2.2.5 药物抗病毒活性测定 细胞按“2.2.4”项下方法培养,并以100 TCID50/孔的病毒感染细胞,设置3个复孔,并设细胞对照组、病毒对照组、空白对照组,于培养箱中培养48 h,CPE法观察感染情况,MTT法检测细胞活性,采用酶标仪于490 nm处检测OD值,通过GraphPad Prism 5软件拟合药物EC50。
2.3 加时实验 为了研究甘草活性部位作用在RSV复制周期的具体阶段,故又进行了加时实验[15]。实验前24 h,将Hep2细胞以每孔8×104个的密度接种于24孔板,设置空白对照组、药物干预组,每种药物[甘草正丁醇部位萃取物(0.3 mg/mL)、甘草水部位(3 mg/mL)、利巴韦林(100 μmol/L)]分为8份,分别在-2、0、2、4、6、8、12、16 h时加入,每个时间点重复3孔,在0 h时弃去原培养液,加入新的冷培养液,以感染复数(MOI)为3的病毒量在4 ℃下感染细胞2 h,随后用冷PBS洗涤细胞3次,加入新培养液,于细胞培养箱中培养,于20 h时收集上清液,按“2.2.3”项下方法检测上清液病毒毒力。
2.4 甘草体内抗RSV作用研究
2.4.1 造模及给药 将小鼠随机分为4组,每组10只,分别为空白组、模型组、利巴韦林(阳性药,36 mg/kg)组、甘草正丁醇部位(30 mg/kg)组,适应性饲养3 d后每天灌胃相应药物(0.1 mL/只),空白组、模型组灌胃等体积生理盐水。在给药第1天用乙醚麻醉小鼠,滴鼻给予病毒(100 μL/只,滴度为3.4×107TCID50/mL),连续2 d,空白组滴鼻给予等体积对照培养液。
2.4.2 样品处理与指标检测 按照预定方案给药4 d,在第5天给药1 h后,小鼠眼球取血,脱颈处死,解剖取肺组织,称定质量,计算肺指数,再用4%甲醛固定,经脱水、组织透明、浸蜡、包埋、切片、烘干后,HE染色以观察肺部病变。将小鼠全血于4 ℃下过夜,在4 ℃、3 000 r/min下离心20 min,取上清,ELISA法检测血清TLR4、NF-κB、TNF-α、IFN-β、Keap1、Nrf2水平。

3 结果
3.1 病毒毒力 如表1所示,HSV-1、EV71以Vero细胞为宿主细胞,RSV、CV-B3、CV-B5以Hep2细胞为宿主细胞。
3.2 抗病毒谱 如表2所示,甘草水提物对5种病毒均有较好的抑制作用,其中对RSV效果最强。
3.3 甘草抗RSV活性部位筛选 如图1所示,甘草正丁醇部位活性最强,TI值为36.22;其次是水部位,TI值>15.71。

图1 活性部位的筛选
3.4 加时实验 如图2A所示,阳性药利巴韦林在6~10 h时对RSV具有一定的抑制作用,主要是在复制阶段,而在-2~6 h时作用较差。如图2B所示,甘草正丁醇部位在-2~4、6~12 h时对RSV具有一定的抑制作用,12 h后逐渐减弱,主要是在吸附、复制阶段,而在穿入阶段不明显,呈现出药物预防效果。如图2C所示,甘草水部位在-2~8 h时对RSV具有一定抑制作用,8 h后逐渐减弱,主要是在吸附、复制阶段,呈现出药物预防、抑制病毒穿入效果。

注:-2 h处的点表示药物作用在-2~0 h,0 h处的点表示药物作用在0~2 h,2 h及2 h以后的点均表示药物作用在该点至20 h。若2 h之后某两点的滴度相同,则表示在这段时间内药物对病毒没有抑制作用。
3.5 甘草正丁醇部位抗RSV作用及其机制
3.5.1 对病理形态的影响 如图3所示,模型组小鼠肺泡壁增厚,多数肺泡腔变小或几乎看不见,肺泡腔内及肺间质有明显出血,伴有炎性细胞浸润;空白组小鼠肺泡结构清晰,肺泡腔内未见渗出物,未见炎性细胞浸润;甘草正丁醇部位组小鼠肺泡壁增生情况得到改善,肺泡形态趋于正常肺泡腔出血情况减轻,炎性细胞浸润情况减轻;利巴韦林组小鼠肺泡壁较模型组得到改善,肺泡腔及肺间质出血情况得到改善,炎性细胞浸润情况减轻。

图3 甘草正丁醇部位对小鼠肺组织病理变化的影响(HE,×200)
3.5.2 对肺指数的影响 如图4所示,与空白组比较,模型组小鼠肺指数升高(P<0.01),提示造模成功;与模型组比较,甘草正丁醇部位组和利巴韦林组小鼠肺指数均降低(P<0.05)。
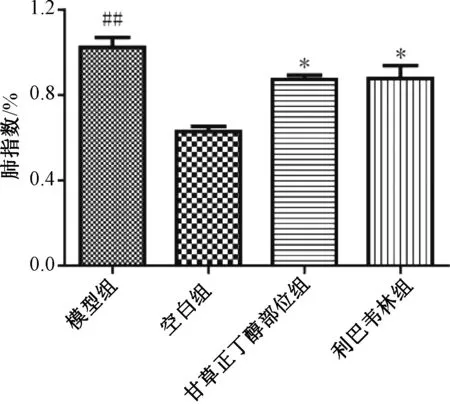
注:与空白组比较,##P<0.01;与模型组比较,*P<0.05。
3.5.3 对炎症及免疫反应相关因子的影响 如图5所示,与模型组比较,甘草正丁醇部位可降低小鼠血清TLR4水平(P<0.05);甘草正丁醇部位和利巴韦林可降低小鼠血清NF-κB及TNF-α水平(P<0.05),升高IFN-β水平(P<0.05)。

注:与空白组比较,#P<0.05,##P<0.01;与模型组比较,*P<0.05。
3.5.4 对氧化应激通路的影响 如图6所示,与模型组比较,甘草正丁醇部位可降低小鼠血清Keap1水平(P<0.05),甘草正丁醇部位和利巴韦林均可升高血清Nrf2水平(P<0.01)。

注:与空白组比较,##P<0.01;与模型组比较,*P<0.05,**P<0.01。
4 讨论
本实验首先考察了甘草水提物对RSV、HSV-1、EV71、CV-B3、CV-B5的体外抗病毒作用,结果显示其对以上5种病毒均有一定程度的体外抗病毒作用,其中抗RSV的效果最好。然后对甘草抗RSV的活性部位进行研究,发现甘草抗RSV的有效部位是正丁醇与水部位,结果提示甘草抗RSV的活性成分可能是极性相对较大的成分,如多糖、皂苷、黄酮类等成分。进一步研究了甘草正丁醇部位和水部位抗RSV的初步机制,阳性药利巴韦林主要作用在病毒的复制阶段,甘草正丁醇部位、水部位在RSV复制周期针对多个阶段(吸附、穿入、复制)具有抑制RSV的作用,后续需针对不同的作用阶段寻找其抑制RSV的作用通路进行深入研究。
病毒入侵机体后可造成组织的氧化应激损伤以及一系列的炎症损伤。TLR4是连接固有免疫与炎症的桥梁,宿主的TLR4可识别RSV的F蛋白,在TLR4信号传导中进一步激活NF-κB通路,进而诱导炎症因子(如TNF-α、IL-1β、IL-6、IL-8)的表达,促进炎症反应[16]。干扰素(IFN)是机体所产生的具有广谱抗病毒作用的一种细胞因子,RSV的G蛋白可抑制IFN-β的表达进而促进RSV的免疫逃逸[17]。Cuadrado等[18]提出Nrf2可作为呼吸道病毒疾病治疗的潜在靶点,在生理条件下,Nrf2与Keap1偶联于细胞质中,应激状态下Nrf2从胞浆解离至细胞核内并促进抗氧化基因的表达,Nrf2和NF-κB存在功能性的相互作用,Nrf2的降低会加剧NF-κB的活性,Nrf2的激活可促进炎症的缓解。甘草体内抗RSV实验结果提示,甘草正丁醇部位可以提高感染RSV小鼠血清IFN-β水平,抑制RSV的免疫逃逸;通过抑制TLR4/NF-κB通路并降低TNF-α水平,抑制RSV所引起的肺部炎症反应;并且可以通过Keap1/Nrf2通路降低小鼠的氧化应激水平从而改善RSV引起的小鼠肺组织损伤。
中药抗病毒的特点是多成分、多靶点的协同作用,关于中药的抗病毒作用可从抑制病毒、炎症反应、免疫调节等方面进行综合评价[19]。本实验通过抑制病毒、炎症反应、免疫调节、氧化应激方面,对甘草体内外抗病毒作用进行了初步研究,为后续深入的机制研究及活性物质基础的寻找奠定一定基础。

