miR-155/PTEN 轴在高糖诱导HRCEC 凋亡中的作用及机制
蔡文丽,谢红波
糖尿病视网膜病变(diabetic retinopathy,DR)是糖尿病患者常见的微血管并发症,也是导致成人失明的常见病因之一,不仅影响患者的健康及生活质量,也增加了家庭和社会的经济负担。DR 的发病机制复杂,其中人视网膜微血管内皮细胞(human retinal capillary endothelial cells,HRCEC)在高糖环境下发生损伤与该病发生的关系最为密切,也有越来越多的学者开始关注高糖引起HRCEC 损伤的机制及防治手段[1-2]。微小RNA(microRNA,miR)是在转录后水平调控基因表达的一类非编码小分子RNA,具有广泛的生物学作用,多种miR与糖尿病微血管并发症的发生有关[3-5]。POLINA ER 等[6]的临床研究表明,DR 患者血浆中miR-155 的表达明显减少;郑华峰等[7]的细胞研究发现,高糖能够诱导脐静脉内皮细胞凋亡并下调细胞中miR-155 的表达,过表达miR-155 能够抑制高糖诱导的脐静脉内皮细胞凋亡。本课题组前期通过生物信息学分析证实促凋亡基因磷脂酶和张力蛋白同源物(phosphatase and tensin homolog,PTEN)是受到miR-155 调控的靶基因,miR-155 可能靶向PTEN 并起到抑制凋亡的作用。目前,miR-155/PTEN 轴在高糖诱导HRCEC凋亡中的作用及机制尚不清楚。因此,本研究将以HRCEC 为实验对象,通过细胞实验分析miR-155/PTEN 轴在高糖诱导HRCEC 凋亡中的作用及机制。
1 材料与方法
1.1 细胞、试剂与仪器
HRCEC 细胞株MZ-M044(宁波明舟生物公司),miR-155 模拟物及阴性对照(negative control,NC)序列(上海吉玛公司),四唑氮盐[3-(4,5-dimethylthiazol-2-yl)-5(3-carboxymethoxyphenyl)-2-(4-sulfopheny)-2H-tetrazolium,MTS]细胞活力检测试剂盒(武汉艾美捷公司,K300),原位末端转移酶标记技术(TdT-mediated dUTP Nick-End Labeling,TUNEL)细胞凋亡检测试剂盒(北京全式金公司,FA201-01),细胞裂解液、蛋白定量试剂盒(北京奥维亚公司,RL1020、RTP7102),双荧光素酶报告基因及检测试剂盒(美国Promega 公司,E1910),PTEN、蛋白激酶B(protein kinase B,AKT)、磷酸化AKT(phosphorylation-AKT,p-AKT)、内皮型一氧化氮合酶(endothelial nitric oxide synthase,eNOS)抗体(美国Abcam 公司,ab267787、ab8805、ab38449、ab252439)。
细胞培养箱(美国Thermo 公司,HERAcell 240i),显微镜(日本Nikon 公司,E100),荧光定量PCR 仪(美国Bio-rad 公司,CFX96),凝胶电泳系统及成像系统(上海天能公司,Tanon3500)。
1.2 细胞培养及分组
HRCEC 在含有10%胎牛血清的培养基中进行贴壁培养,待细胞铺满培养瓶底面80%~90%时进行胰酶消化,按照1∶3的比例传代培养,传代后的细胞进行分组干预。
为验证miR-155 的生物学功能,细胞分为3 组,分别为:miR-NC 组、miR-NC+高糖组、miR-155+高糖组。miR-NC 组在普通培养基中转染NC 序列,miR-NC+高糖组在含有33 mmol/L 葡萄糖的培养基中转染NC 序列,miR-155+高糖组在含有33 mmol/L葡萄糖的培养基中转染miR-155 模拟物。NC 序列或miR-155 模拟物的终浓度为20 nmol/L,每组均连续转染24 h。
为验证PTEN 在miR-155 生物学功能中的作用,细胞分为4 组,分别为:miR-NC+空白质粒组、miR-NC+空白质粒+高糖组、miR-155+空白质粒组+高糖组、miR-155+PTEN 质粒组+高糖组。miR-NC+空白质粒组在普通培养基中共转染NC 序列及空白质粒,miR-NC+空白质粒+高糖组在含有33 mmol/L葡萄糖的培养基中共转染NC 序列及空白质粒,miR-155+空白质粒组+高糖组在含有33 mmol/L 葡萄糖的培养基中共转染空白质粒及miR-155 模拟物,miR-155+PTEN质粒组+高糖组在含有33 mmol/L葡萄糖的培养基中转染PTEN 质粒及miR-155 模拟物。NC 序列或miR-155 模拟物的终浓度为20 nmol/L,质粒的终浓度为1 μg/mL,每组均连续转染24 h。
1.3 miR-155表达水平的qRT-PCR检测
将密度为106个/mL 的细胞悬液按照1.0 mL/孔接种在12孔板内,分组转染24 h后收集细胞进行实验。首先采用miR 提取分离试剂盒提取细胞中的miR,而后采用cDNA 第1 链合成试剂盒进行反转录、以miR 为模板合成cDNA,最后采用miR 实时荧光定量PCR(qRT-PCR)试剂盒检测,反应程序为95℃预变性3 min,而后94℃变性15 s、60℃变性34 s、重复40 次。分别使用目的基因miR-155 及内参基因U6的特异性引物,得到循环曲线、以U6为内参计算miR-155的表达水平。
1.4 细胞活力的MTS检测
将密度为106个/mL 的细胞悬液按照0.2 mL/孔接种在96孔板内,分组转染24 h后收集细胞进行实验。采用MTS 试剂盒检测细胞活力,按照试剂盒说明书进行操作并在酶标仪上检测490 nm 波长处的吸光值(optical density,OD)。
1.5 细胞凋亡的TUNEL检测
将密度为106个/mL 的细胞悬液按照0.5 mL/孔接种在24孔板内,分组转染24 h后收集细胞进行实验。采用TUNEL试剂盒检测细胞凋亡,按照试剂盒说明书进行操作并在显微镜下观察TUNEL 阳性染色的细胞数、计算细胞凋亡率。
1.6 Western Blot检测相关蛋白表达
将密度为106个/mL 的细胞悬液按照0.5 mL/孔接种在24孔板内,分组转染24 h后收集细胞进行实验。采用细胞裂解液提取细胞中的蛋白,进行蛋白定量、电泳、转膜和封闭,然后放入1∶1,000 稀释的PTEN、AKT、p-AKT、eNOS 抗体中,4℃孵育过夜;第2 d在1∶2,000稀释的二抗中室温孵育1 h,最后在凝胶成像系统中显影得到蛋白条带,根据条带灰度值计算蛋白表达水平。
1.7 miR-155靶向PTEN基因mRNA 3’UTR的验证
合成野生型PTEN 基因mRNA 3’UTR 双荧光素酶报告基因,将3’UTR 第329-335 碱基、第5018-5024 碱基分别进行突变后成为突变型PTEN 基因mRNA 3’UTR 双荧光素酶报告基因-1、突变型PTEN 基因mRNA 3’UTR 双荧光素酶报告基因-2,将双荧光素酶报告基因转染进入细胞,而后分别转染NC 模拟物或miR-155 模拟物,转染24 h 后用胰蛋白酶消化收集细胞,采用双荧光素酶报告基因检测试剂盒在测定萤火虫荧光值和海肾荧光值,以萤火虫荧光值/海肾荧光值计算荧光素酶报告基因的荧光活性。
1.8 统计学方法
采用SPSS20.0 统计软件对数据进行分析,计量资料数据采用均数±标准差()表示,符合正态分布且方差齐的计量资料,方差分析(ANOVA)进行多组变量间的相互比较,两两比较采用LSD-t检验,当P<0.05时被认为差异有统计学意义。
2 结果
2.1 高糖环境下HRCEC中miR-155的表达水平
3 组间HRCEC 中miR-155 表达比较,差异有统计学意义(F=8.924,P=0.004)。两两比较,与miRNC 组比较,miR-NC+高糖组HRCEC 中miR-155 表达降低(t=3.010,P=0.017);与miR-NC+高糖组比较,miR-155+高糖组HRCEC 中miR-155 表达升高(t=4.069,P=0.004),差异均有统计学意义(表1)。
表1 高糖环境下HRCEC中miR-155的表达水平(,n=5)

表1 高糖环境下HRCEC中miR-155的表达水平(,n=5)
注:*与miR-NC 组比较,P<0.05;#与miR-NC+高糖组比较,P<0.05;miR-155 微小RNA-155;NC 阴性对照
2.2 过表达miR-155 对高糖环境下HRCEC 细胞活力及凋亡、PTEN、p-AKT、eNOS表达水平的影响
3组间HRCEC的OD490值及细胞凋亡率比较,差异均有统计学意义(FOD490=4.342,P=0.038;F凋亡率=40.466,P=0.000)。两两比较,(1)细胞活力(OD490值):与miR-NC 组比较,miR-NC+高糖组的OD490值降低(t=2.801,P=0.023);与miR-NC+高糖组比较,miR-155+高糖组的OD490值增加(t=2.907,P=0.020),差异均有统计学意义。(2)细胞凋亡率:与miR-NC 组比较,miR-NC+高糖组的细胞凋亡率增加(t=6.769,P=0.000);与miR-NC+高糖组比较,miR-155+高糖组的细胞凋亡率降低(t=5.957,P=0.000),差异均有统计学意义(图1、表2)。
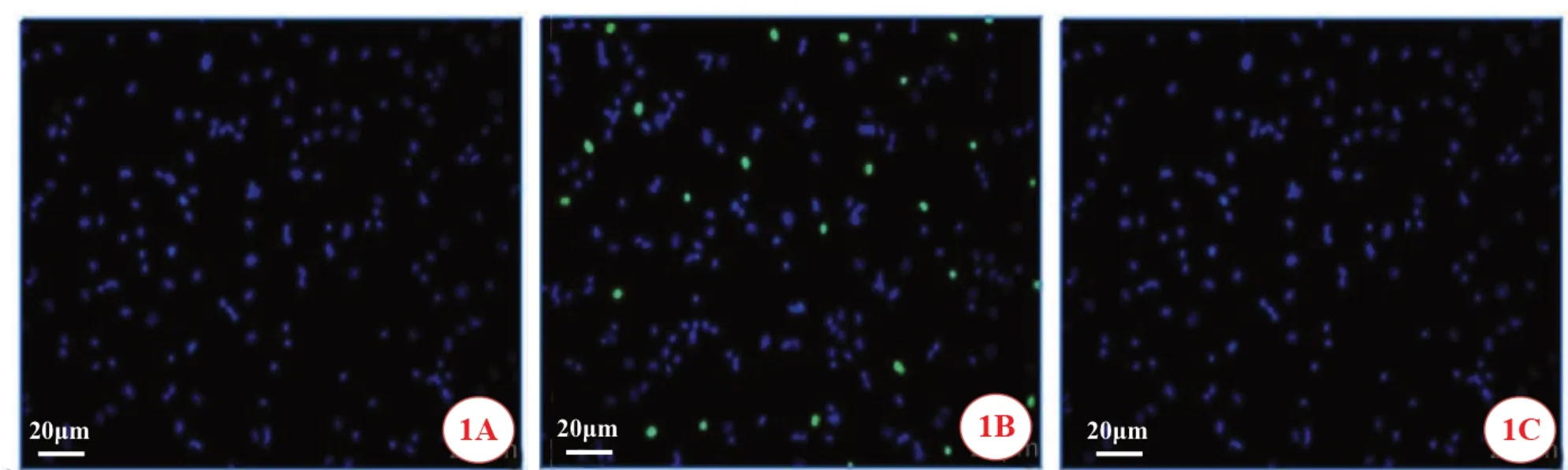
图1 过表达miR-155对高糖环境下HRCEC细胞活力及凋亡的影响(TUNEL染色,×400)
3 组间HRCEC 中PTEN、p-AKT、eNOS 表达比较,差异均有统计学意义(FPTEN=15.872,Fp-AKT=26.758,FeNOS=17.174,均P=0.000)。两两比较,(1)PTEN:与miR-NC 组比较,miR-NC+高糖组HRCEC 中PTEN 表达增加(t=4.882,P=0.001);与miR-NC+高糖组比较,miR-155+高糖组HRCEC 中PTEN 表达降低(t=3.855,P=0.005),差异均有统计学意义。(2)p-AKT:与miR-NC 组比较,miR-NC+高糖组的HRCEC 中p-AKT 表达降低(t=6.699,P=0.000);与miR-NC+高糖组比较,miR-155+高糖组HRCEC 中p-AKT 表达增加(t=6.450,P=0.000),差异均有统计学意义。(3)eNOS:与miR-NC 组比较,miR-NC+高 糖组HRCEC 中eNOS 表达降低(t=5.813,P=0.000);与miR-NC+高糖组比较,miR-155+高糖组HRCEC 中eNOS 表达增加(t=4.875,P=0.001),差异均有统计学意义(图2、表2)。
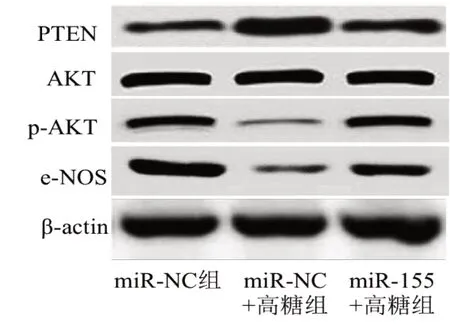
图2 过表达miR-155 对高糖环境下HRCEC 中PTEN 及p-AKT、e-NOS表达水平的影响
表2 过表达miR-155对高糖环境下HRCEC细胞活力及凋亡、PTEN、p-AKT和eNOS表达的影响(,n=5)
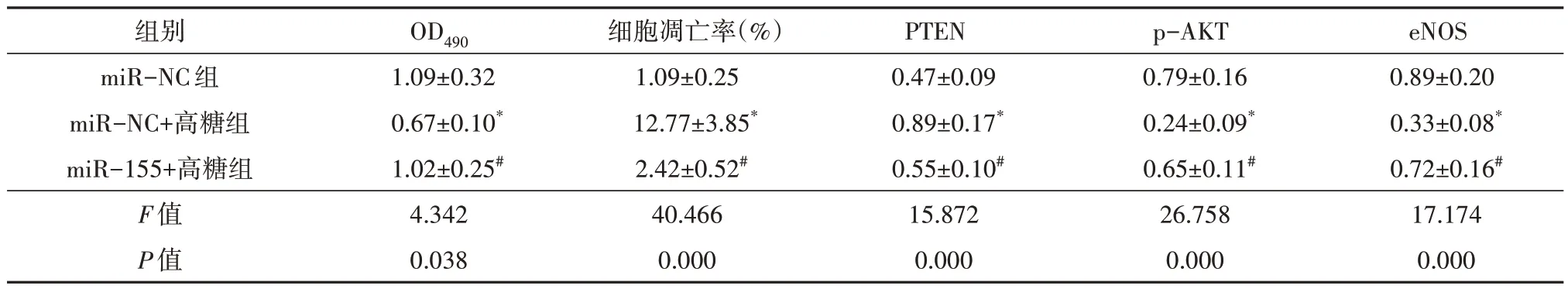
表2 过表达miR-155对高糖环境下HRCEC细胞活力及凋亡、PTEN、p-AKT和eNOS表达的影响(,n=5)
注:*与miR-NC 组比较,P<0.05;#与miR-NC+高糖组比较,P<0.05;miR-155 微小RNA-155;NC 阴性对照;PTEN 磷脂酶和张力蛋白同源物;p-AKT 磷酸化AKT;eNOS 内皮型一氧化氮合酶;HRCEC 视网膜微血管内皮细胞
2.3 miR-155 在HRCEC 中靶向PTEN 3’UTR 的验证
经Targetscan分析,miR-155靶向PTEN基因mRNA 的3’UTR 第329-335 碱基、第5018-5024 碱基(图3);与miR-NC 组比较,miR-155 组HRCEC 中野生型PTEN 基因mRNA 3’UTR 双荧光素酶报告基因的荧光活力显著降低(t=6.358,P=0.000),差异具有统计学意义;突变型PTEN 基因mRNA 3’UTR 双荧光素酶报告基因的荧光活力无明显变化(t突变型基因-1=0.327,P=0.752;t突变型基因-2=0.353,P=0.733)。

图3 miR-155靶向PTEN基因mRNA 3’UTR的Targetscan分析
2.5 过表达PTEN 对miR-155 调控高糖环境下HRCEC细胞活力、凋亡及PTEN表达水平的影响
4 组间HRCEC 的OD490值、凋亡率、PTEN 表达比较,差异均有统计学意义(FOD490=14.260,F凋亡率=30.720,FPTEN=12.988,均P=0.000)。两两比较,(1)细胞活力(OD490值):与miR-NC+空白质粒组比较,miR-NC+空白质粒+高糖组的OD490值降低(t=5.404,P=0.001);与miR-NC+空白质粒+高糖组比较,miR-155+空白质粒组+高糖组的OD490值增加(t=4.139,P=0.003);与miR-155+空白质粒组+高糖组比较,miR-NC+PTEN质粒+高糖组的OD490值降低(t=3.777,P=0.005),差异均有统计学意义。(2)细胞凋亡率:与miR-NC+空白质粒组比较,miR-NC+空白质粒+高糖组的细胞凋亡率升高(t=6.642,P=0.000);与miR-NC+空白质粒+高糖组比较,miR-155+空白质粒组+高糖组的细胞凋亡率降低(t=5.318,P=0.001);与miR-155+空白质粒组+高糖组比较,miR-NC+PTEN 质粒+高糖组的细胞凋亡率升高(t=6.406,P=0.000),差异均有统计学意义。(3)PTEN:与miR-NC+空白质粒组比较,miR-NC+空白质粒+高糖组PTEN 表达升高(t=4.486,P=0.002);与miR-NC+空白质粒+高糖组比较,miR-155+空白质粒组+高糖组PTEN 表达降低(t=3.944,P=0.004);与miR-155+空白质粒组+高糖组比较,miR-NC+PTEN 质粒+高糖组PTEN 表达升高(t=4.243,P=0.003),差异均有统计学意义(图4、图5、表3)。
表3 过表达PTEN对miR-155调控高糖环境下HRCEC细胞活力及凋亡的影响(,n=5)
注:*与miR-NC+空白质粒组比较,P<0.05;#与miR-NC+空白质粒+高糖组比较,P<0.05;&与miR-155+空白质粒组+高糖组比较,P<0.05;HRCEC 视网膜微血管内皮细胞;PTEN 磷脂酶和张力蛋白同源物

图4 过表达PTEN对miR-155调控高糖环境下HRCEC细胞活力、凋亡的影响(TUNEL染色,×400)
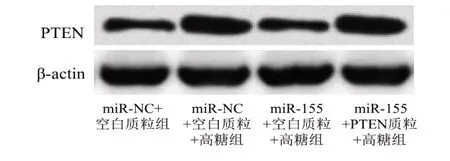
图5 过表达PTEN后高糖环境下HRCEC中PTEN的影响
3 讨论
高糖引起内皮细胞损伤是与多种糖尿病血管并发症发生发展密切相关的病理环节[8-10],但具体的机制尚不十分明确。新近多项关于糖尿病血管并发症的临床研究[11-12]证实,DR、糖尿病肾病、糖尿病合并冠心病患者血清中miR-155 的表达明显降低;另有细胞实验证实[7],高糖抑制脐静脉内皮细胞中miR-155的表达降低且miR-155具有抑制内皮细胞凋亡的作用。
在DR 的发病过程中,高糖诱导HRCEC 损伤发挥了至关重要的作用,多项研究[7-9,13-14]报道,HRCEC在高糖环境中的细胞活力降低、凋亡率升高。本实验的分析结果与既往研究一致,即高糖组HRCEC的细胞活力低于对照组、凋亡率高于对照组,表明高糖能够促进HRCEC 发生凋亡。DR 相关的临床研究[7]已经证实DR 患者血浆中miR-155 的表达减少[6],脐静脉内皮细胞中miR-155 能够发挥抗凋亡作用,本研究证实高糖使HRCEC 中miR-155 的表达明显降低;在高糖环境下过表达miR-155 后,HRCEC 的细胞活力增加、凋亡率降低,表明miR-155能够抑制高糖诱导的HRCEC凋亡。
PTEN 是目前已知的miR-155 靶基因[15-17],该基因对下游AKT 的磷酸化具有抑制作用,内皮细胞功能中AKT 的磷酸化能够增加eNOS 的表达并起到内皮保护作用[18-19];高糖、过氧化氢等通过PTEN/AKT/eNOS 轴造成内皮损伤[20-21]。本实验用高糖培养基处理HRCEC 后观察到细胞中PTEN 的表达增加,p-AKT、eNOS 的表达减少;而在转染miR-155 模拟物后,细胞中PTEN 的表达减少,p-AKT、eNOS 的表达增加,表明miR-155 能够在抑制HRCEC 中PTEN的表达、促进下游AKT/eNOS 通路的活化,靶向PTEN 可能是miR-155 在高糖环境下抑制HRCEC凋亡的分子机制。
为了验证miR-155 对PTEN 的靶向作用,本研究通过生物信息学分析证实PTEN 基因mRNA 的3’UTR 含有miR-155 的结合位点;经双荧光素酶报告基因实验,miR-155 能够直接靶向PTEN 基因mRNA 的3’UTR 且靶向结合位点与生物信息学预测一致。最后,本研究还验证了PTEN 在miR-155抑制高糖诱导HRCEC 凋亡中的作用,通过转染PTEN 质粒增加细胞中PTEN 的表达,过表达PTEN后、miR-155 在高糖环境下增加细胞活力及抑制细胞凋亡的作用发生了逆转,证实miR-155 通过靶向抑制PTEN的表达来抑制高糖诱导的HRCEC凋亡。
综上所述,高糖环境下HRCEC 凋亡激活且miR-155表达减少、PTEN表达增加,过表达miR-155能够靶向抑制PTEN 并抑制高糖诱导的HRCEC 凋亡,miR-155/PTEN 轴可能在DR 的发生中起到重要作用,过表达miR-155、靶向抑制PTEN 可能成为未来治疗DR的新靶点。
——一道江苏高考题的奥秘解读和拓展

