137 例不同类型结直肠侧向发育型肿瘤病理表现及内镜治疗分析
郭利华 丁 勇 胡柯峰 张新军 杨齐华 叶国良
结直肠侧向发育型肿瘤(lateral spreading tumor,LST)是一类大小10 mm 以上,沿肠壁黏膜匍匐生长而非垂直生长为特点的结肠黏膜病变[1]。LST具有恶变潜能,与单纯息肉或结直肠腺瘤比较,LST更容易发生高级别上皮内瘤变或癌变黏膜下浸润[2]。目前,应用内镜下微创治疗可以取得较好的临床疗效。为了解LST 内镜下表现与肿瘤病理特点以及内镜下治疗情况,本研究对采用内镜治疗的不同类型LST 进行比较分析,现报道如下。
1 资料与方法
1.1 一般资料 回顾性分析2017 年1 月至2020 年1 月宁波大学医学院附属医院消化内科中心经内镜下治疗的137 例LST 患者。术前停用抗血小板药、抗血凝药1 周。所有患者治疗前均签署知情同意书。本研究经宁波大学医学院附属医院医学伦理委员会审查通过(审批号:KS20221013)。
1.2 纳入与排除标准 纳入标准:(1)最大直径≥10 mm,内镜下表现为侧向生长的病变,包括颗粒型与非颗粒型;(2)符合内镜治疗适应证,术前化验及心电图等相关检查无明显异常。排除标准:(1)患者不配合;(2)心肺功能障碍不能耐受内镜治疗;(3)抗凝治疗、凝血功能障碍未纠正者。
1.3 LST 内镜分型 结直肠LST 根据形态学分成两类,分别为颗粒型(LST-G)和非颗粒型(LST-NG),颗粒型根据病灶有无大的结节,分为颗粒均一型[LSTG(H)]和结节混合型[LST-G(M)],非颗粒型根据病症有无凹陷病变,分为扁平隆起型[LST-NG(F)]和假凹陷型[LST-NG(PD)][3]。见图1。

图1 结直肠侧向发育型肿瘤4 种内镜亚型
1.4 内镜治疗 采用日本Olympus CF-260、CF290电子结肠镜进行检查及治疗,所有治疗均由主任医师完成,结直肠LST 根据病灶大小等特点采用内镜下黏膜切除术(EMR)、内镜下分片黏膜切除术(EPMR)和内镜下黏膜剥离术(ESD),见图2。

图2 结肠侧向发育型肿瘤内镜下剥离术操作过程
1.5 标本处理及病理特点分析 将切除后标本取出浸泡于固定液后,移送至病理中心。根据病理结果了解LST 术后病理类型、水平切缘、垂直切缘以及癌变浸润深度等情况。根据内镜下治疗术后标本情况及术后病理结果可评估LST 是否达到整块切除、完全切除和治愈性切除,其中黏膜下癌不纳入治愈切除标准[4]。
1.6 术后处理及随访 术后应禁食24 h,创面较大者可适当酌情延长术后禁食时间;根据内镜治疗情况酌情给予肛管排气,以降低肠腔内压力减少结肠穿孔风险;术后给予止血及补液营养支持治疗。术中一旦发现小穿孔,立即予钛夹夹闭创面,术后宜适当延长禁食时间,并继续给予适当的抗生素治疗;术后观察患者有无剧烈腹痛腹胀、便血、发热等症状,必要时行腹部CT 或腹部立位片检查排除有无迟发性穿孔等情况。术后病理提示,病灶侵犯黏膜下层>1000 μm 或脉管浸润者均强烈建议追加外科手术。嘱患者术后3、6、12 个月定期复查肠镜。
1.7 统计学方法 应用SPSS 16.0 统计软件对数据进行处理,符合正态分布计量资料以均数±标准差()表示,组间比较采用t 检验;计数资料以例(百分率)表示,组间比较采用χ2检验或Fisher 精确检验。P<0.05 表示差异有统计学意义。
2 结果
2.1 一般资料比较 137 例LST 患者,其中男71例,女66 例;年龄35~84(63.72±9.50)岁。LST-G 组与LST-NG 组男女发病比例及年龄比较,差异均无统计学意义(P>0.05)。见表1。
2.2 LST 内镜表现比较 内镜形态LST-G 95 例[包括LST-G(H)36 例,LST-G(M)59 例],发病率69.34%(95/137);LST-NG 42 例[包括LST-NG(F)36例,LST-NG(PD)6 例],发病率30.66%(42/137);其中以LST-G(M)发病率最高(43.06%)。病变直径10~20 mm 58 例(42.34%),≥20~30 mm 61 例(44.52%),≥30 mm 18 例(13.14%)。LST-NG 组以病变直径10~20 mm 为主,组间比较差异有统计学意义(P=0.020)。病变部位从直肠至盲肠各部位均可见,其中以升结肠比率最高(25.55%,35/137),病变部位组间比较差异无统计学意义(P>0.05)。见表1。
2.3 不同形态LST 病理特点 病理结果提示LST以管状腺瘤为主(69.34%,95/137),其中LST-G 管状腺瘤67 例,LST-NG 管状腺瘤28 例;LST-G 绒毛状腺瘤1 例,LST-NG 绒毛状腺瘤0 例;LST-G 管状绒毛状腺瘤15 例,LST-NG 管状绒毛状腺瘤2 例;LST-G 早期癌8 例,LST-NG 早期癌1 例。LST-G 低级别上皮内瘤变59 例,LST-NG 低级别上皮内瘤变27 例;LST-G 高级别上皮内瘤变26 例,LST-NG 高级别上皮内瘤变7 例;LST-G 黏膜内癌1 例,LSTNG 黏膜内癌0 例;LST-G 黏膜下癌7 例,LST-NG黏膜内癌1 例,以上组间比较差异无统计学意义(P>0.05)。LST-G 锯齿状腺瘤4 例,LST-NG 锯齿状腺瘤11 例,LST-NG 锯齿状腺瘤发病率(26.19%,11/42)明显高于LST-G(4.21%,4/95)(P=0.001);其中8 例锯齿状腺瘤为无蒂锯齿状腺瘤。见表1。
2.4 LST 治疗情况 101 例LST 采用ESD 治疗术,其中LST-G 组76.84%(73/95)、LST-NG 组66.67%(28/42)采用ESD 治疗术,27 例病灶大小10~20 mm采用EMR 治疗术,9 例病灶大小20~30 mm 采用EPMR 治疗术,组间比较差异无统计学意义(P>0.05)。LST-G 整块切除率91.58%(87/95),LST-NG整块切除率95.23%(40/42);LST-G 完全切除率86.32%(82/95),LST-NG 完全切除率88.09%(37/42);LST-G 治愈性切除率82.21%(78/95),LST-NG 治愈性切除率85.71%(36/42),以上组间比较差异无统计学意义(P>0.05)。见表1。
2.5 术后相关并发症 1 例病灶大小7 cm×5 cm 乙状结肠巨大侧向发育型肿瘤,术中有小穿孔,予钛夹夹闭创面,术后24 h 内出现发热、腹痛、腹膜刺激征等临床表现,腹部CT 检查发现腹腔积气明显,予行急诊腹腔镜手术,穿孔率为0.73%(1/137),术后未出现迟发性出血。术后有15 例患者出现发热,多为低热,LST-G 组11.58%(11/95)、LST-NG 组9.52%(4/42),予抗感染治疗2~3 d 体温恢复正常;术后有16 例患者诉有腹痛不适,LST-G 组16.84%(16/95)、LST-NG 组14.29%(6/42),予止痛针对症处理均可缓解;术后并发症发生率组间比较差异均无统计学意义(P>0.05)。见表1。

表1 结直肠侧向发育型肿瘤内镜分型、大小、部位及病理学分类
2.6 术后浸润癌临床干预措施 术后病理提示早期癌9 例,1 例黏膜内癌,8 例黏膜下癌。黏膜下癌中,5例为pT1b1,3 例为pT1b2。5 例pT1b1(SM1),其中有2 例高分化腺癌浸润深度为黏膜下层100 μm,1 例累及黏膜下层600 μm,1 例累及黏膜下层700 μm,术后定期随访复查无复发;其中有1 例中分化腺癌浸润深度黏膜下层500 μm,见脉管癌栓,追加手术,术后未见癌组织残留,肠周淋巴结18 颗,1 颗见癌转移(1/18)。3 例pT1b2(SM2),其中有1 例中分化腺癌,浸润深度1600 μm,追加手术,术后病理提示未见肿瘤残留,肠周淋巴结未见癌转移(0/22);1 例中低分化腺癌,浸润深度5000 μm,追加手术,术后病理未见肿瘤组织残留,两端切缘及环切缘均阴性,肠周淋巴结12 颗,2 颗见腺癌转移(2/12);1 例患者ESD 术中见病变浸润至肌层,术中易出血,电凝止血后转外科腹腔镜手术,术后病理中分化腺癌,浸润黏膜下层,紧贴固有肌层,淋巴结见癌转移:肠周淋巴结(1/15),见表2。
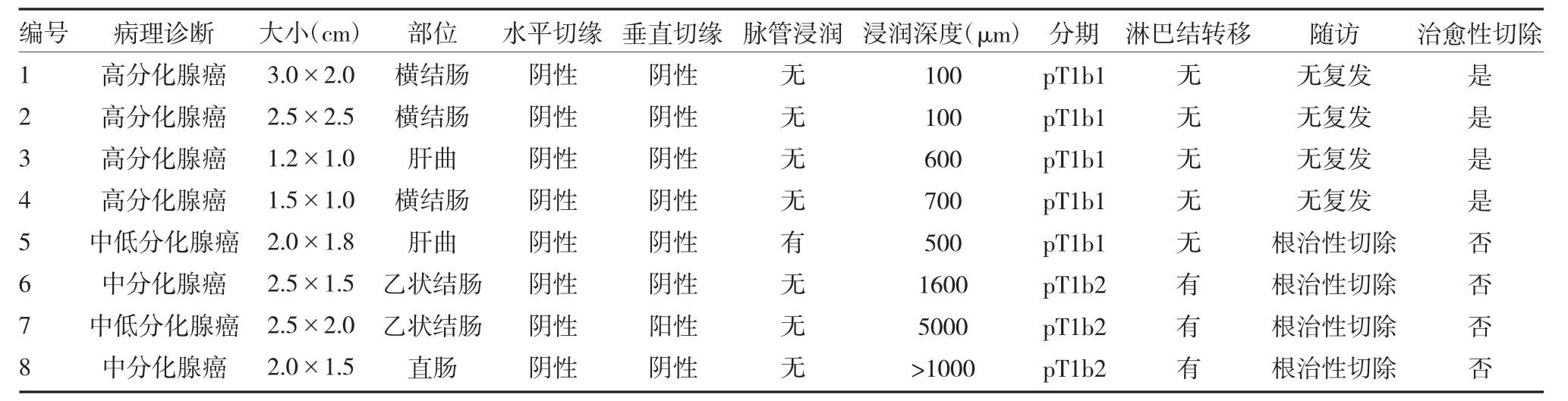
表2 浸润性结直肠侧向发育型肿瘤病理评估及随访情况
2.7 预后与随访 患者术后3、6、12 个月复查,9 例早期结直肠癌和1 例迟发性穿孔随访成功,未见复发。其他纳入随访110 例,失访17 例,术后复查肠镜显示未见复发。
3 讨论
本研究中LST 以颗粒型(LST-G)为主要内镜表现(69.34%),与既往研究比较一致[5]。在分布部位方面,LST 在结直肠各个部位均有分布,国内研究显示62.6% LST 位于右半结肠[3],本研究中以升结肠比例最高(25.55%),其次为横结肠(22.63%),与既往研究结果较一致。病灶大小方面以直径<30 mm 的病变占大多数(86.86%)。病理学上以管状腺瘤占比最高(69.34%),其次为管状绒毛状腺瘤(12.41%)、锯齿状腺瘤(10.95%),早期癌(6.57%)等,非颗粒型锯齿状腺瘤占比高于颗粒型,低级别上皮内瘤变发病率(62.77%)高于高级别上皮内瘤变(24.09%)。LST 与结直肠癌发生密切相关,研究表明,LST 的癌变率高,且动态观察病变发现平坦型病变较隆起型病变具有更高恶变潜能[6-7]。本研究癌变率低于既往研究结果,可能与研究样本量偏少,且多数病灶直径小于30 mm 有关,也可能与目前患者健康意识较强,内镜检查早诊早治的认知提高,早期病变检出率升高有关。
LST 与结直肠癌密切相关,因此一旦发现必须尽早治疗[8]。黏膜下肿瘤有淋巴结转移风险,日本一项研究报道结肠癌淋巴结、脉管转移风险与其黏膜下浸润深度密切相关[9]。黏膜下浸润结肠癌有6%~12%淋巴结转移风险,而对无蒂肿瘤浸润深度<1000 μm 以及有蒂肿瘤仅头部或茎部浸润且深度<3000 μm 者,则无明显淋巴结转移[10]。本研究结果显示,有9 例腺癌,1 例黏膜内癌,8 例黏膜下癌。5 例(55.56%)pT1b1 浸润深度100~700 μm,未超过1000 μm,其中4 例pT1b1 临床病理结果提示脉管、水平切缘和基底切缘均干净,未追加外科手术,密切随访肠镜复查未见肿瘤复发;1 例pT1b1 因病理提示脉管癌栓而追加手术;3 例(33.33%)为pT1b2,ESD 术后病理提示黏膜下浸润深度1600~5000 μm,追加外科手术,术后病理均未见明确癌组织残留,脉管内未见癌栓,肠系膜淋巴结见癌转移,淋巴结转移率为18.75%(3/16)。术后6 个月复查肠镜未见复发。LST内镜治疗术后病理浸润深度、切缘评估对患者的临床治疗及预后至关重要。从本研究8 例黏膜下浸润癌资料分析来看,术后病理仍然是判断浸润深度、有无脉管浸润、切缘是否干净的重要唯一标准[11-12]。
对于直径>20 mm 的LST,内镜下EMR 和EPMR术式容易增加病灶局部残留或复发的风险[13]。因此对于较大的LST 病变优先选择ESD 术,相较于EMR及EPMR,ESD 具有整块切除率高,局部残留及复发率低的特点[14-15]。通常病变的大小决定手术方式的选择,手术方式的选择与术者的操作水平及熟练程度有关,国内大中心开展的结直肠ESD 整块切除率为85.5%~98.3%,治愈性切除率为83.3%~97.6%[4]。本研究中,71.97%患者采用ESD 术,20.45%采用EMR术,7.58%采用EPMR 术,LST 病灶整块切除率达到93.18%,完整切除率为87.88%,治愈性切除率为85.61%。上述结果与国内文献报道基本一致[4]。本研究对LST 癌变黏膜下浸润(包括1 例pT1b1 脉管癌栓及3 例pT1b2)追加手术,术后6 个月复查肠镜未见复发。由此可见病灶完整切除,水平、垂直切缘均干净是防止复发的关键[13]。
本研究中穿孔率0.73%(1/137),术后迟发性出血率为0.00%,相对文献资料报道本研究迟发性出血发生率较低[16]。术后穿孔发生率国内外研究报道0.7%~4.9%,迟发性出血率2.3%~11.9%[17],术后出血、穿孔风险与病灶的大小、病变类型、操作者经验水平密切相关。内镜下治疗术后创面越大,消化道出血和穿孔等并发症发生率越高,而且创面修复愈合速度越慢。由此可见积极有效处理术后创面是预防并发症发生的关键[18]。研究显示术中早期发现小穿孔,同时内镜下能有效夹闭创面可以明显减少腹腔感染等并发症的发生,减少外科手术率[19]。对于怀疑穿孔的患者,应尽早影像学确诊并给予广谱抗生素治疗,内镜修补困难或失败,出现肠内容物渗漏所致的腹膜刺激征,应尽早外科手术。
随着内镜治疗技术日趋成熟,对于符合LST 内镜下治疗适应证患者首选ESD 等内镜治疗术,虽然在临床应用上有病灶残留、迟发性出血和穿孔等内镜治疗风险,但与外科手术相比仍具有安全有效、创伤范围小、并发症发生率低和创面恢复相对快等优点。整块切除病灶是获得准确术后病理的前提,病理结果判断病灶性质、有无脉管浸润、水平及垂直切除是否干净为术后患者预后评估及进一步治疗措施提供依据。

