虫草素对脂多糖诱导的急性肺损伤模型大鼠的保护作用及TLR4/NF-κB 通路的影响
李君明 盛 燚 洪志星 詹玉飞
急性肺损伤(ALI)是由直接和间接致伤因素引起的肺泡上皮细胞及毛细血管内皮细胞损伤,造成弥漫性肺间质及肺泡水肿,导致的急性低氧性呼吸功能不全,严重者可发展为急性呼吸窘迫综合征,具有较高死亡率[1]。ALI 的致病因素较多,临床上主要采用呼吸支持、糖皮质激素等手段治疗[2]。目前尚缺乏治疗ALI 的有效药物。Toll 样受体4(TLR4)是一种跨膜蛋白,是Toll 样受体家族的成员之一,TLR4激活会导致细胞内核因子-κB(NF-κB)信号转导并产生炎性细胞因子[3]。研究表明,TLR4/NF-κB 信号通路参与脓毒症ALI 大鼠的生理进程,抑制其表达能够减轻脓毒症大鼠肺组织炎症反应[4]。虫草素又称冬虫夏草素,具有抗肿瘤、抗炎、抗氧化和免疫调节等生物活性[5]。有研究显示,虫草素对创伤性脑损伤大鼠神经元具有保护作用[6]。而有关虫草素对ALI 的影响和机制的研究鲜有报道。本研究拟探讨虫草素对大鼠ALI 的作用及TLR4/NF-κB 通路的影响,为ALI 的治疗提供药物研究基础。
1 材料与方法
1.1 实验动物 SPF 级成年SD 大鼠60 只(雌雄各半,体质量200~250 g)从浙江大学实验动物中心[许可证号:SCXK(浙)2020-0018]获得,将大鼠饲养在标准条件下的笼子中,温度为22~25 ℃,相对湿度为50%~60%,进行12 h 的明暗循环,并可以自由获取水和食物。本研究经医院伦理委员会审核通过。
1.2 主要试剂与仪器 虫草素(成都嘉叶生物科技有限公司,原料药,纯度99.9%,批号73-07-2,用生理盐水配制成浓度分别为0.5、1、2 mg/mL 的虫草素溶液);脂多糖(LPS)、肿瘤坏死因子-α(TNF-α)、白细胞介素-6(IL-6)、白细胞介素-1β(IL-1β)酶联免疫吸附检测试剂盒、苏木素伊红(HE)染液(武汉伊莱瑞特生物科技股份有限公司,批号BC-K1078-S、BC-K119-S、BC-K135-S、BC-L172-S、BC-L192-S);TRIzol 试剂、逆转录试剂盒、蛋白提取液(北京全式金生物技术有限公司,批号AE308-04、AT101-07、AL208-09);PCR 试剂盒、BCA 蛋白质测定试剂盒、TLR4、NF-κB、GAPDH 单克隆抗体、兔抗鼠二抗(北京百迈客生物科技有限公司,批号RK07002、RK01069、RK02004、RK09005、RK10004、RK08011);血气分析仪(上海雷度米特医疗设备有限公司,型号IDEXX);显微镜、PCR 仪、凝胶成像系统(南京伊若达仪器设备有限公司,型号E260、MA6000、G15T8E)。
1.3 造模、分组和给药 参照文献[7]的方法,48 只大鼠尾静脉注射5 mg/kg 的LPS 0.5 mL 建立ALI 模型。随机分成模型组、虫草素低(5mg/kg)、中(10 mg/kg)、高(20 mg/kg)剂量组[8],每组12 只。另外取12 只大鼠尾静脉注射0.5 mL 生理盐水设为对照组。造模成功后,虫草素低、中、高剂量组分别腹腔注射5、10、20 mg/kg 的虫草素溶液(浓度分别为0.5、1、2 mg/mL,注射体积10 mL/kg);模型组和对照组大鼠腹腔注射10 mL/kg 生理盐水;每天1 次,连续给药1 周。
1.4 动脉血氧分压(PaO2)和二氧化碳分压(PaCO2)水平检测 3%戊巴比妥钠麻醉大鼠,取大鼠股动脉血,采用血气分析仪检测PaO2和PaCO2的水平。
1.5 肺组织炎性因子水平检测 颈脱臼处死大鼠,获取右肺下叶组织,生理盐水冲洗,匀浆化,4 ℃下8000 rpm 离心10 min,收取上清,采用试剂盒检测TNF-α、IL-6、IL-1β 水平。
1.6 肺组织形态学观察及肺损伤评分 获取右肺上叶组织,甲醛固定,将样品包埋在石蜡中,然后切成4 μm 切片,并用HE 染液染色,光学显微镜观察肺组织形态学。根据以下四个项目对大鼠肺损伤进行评分:水肿、炎症细胞浸润、肺泡壁红细胞渗漏、肺泡壁厚度;每个项目根据严重程度(由轻到重)依次为0~4分,得分越高表示肺损伤越严重[9]。
1.7 肺组织TLR4、NF-κB 信使核糖核酸(mRNA)水平检测 使用TRIzol 试剂从上述匀浆化的右肺下叶组织中提取总RNA,逆转录试剂盒将获得的RNA 反转录为cDNA,根据PCR 试剂盒说明书配制反应体系,通过PCR 仪进行相关反应。引物由北京三博远志生物技术有限责任公司合成。序列如下:TLR4(正向:5′-AGTTGCCTTCTTGGGACTGA-3′;反向:5′-TCCACGATTTCCCAGAGAAC-3′);NF-κB(正向:5′-CGTCAGCCGATTTGCTATCT-3′;反向:5′-CGGACTCCGCAAAGTCTAAG-3′);GAPDH(正向:5′-GCCTCGTCTCATAGACAAGATG-3′;反向:5′-CAGTAGACTCCACGACATAC-3′)。PCR 扩增条件如下:95 ℃持续2 min,然后进行40 个循环(95 ℃持续15 s,60 ℃持续20 s,73 ℃持续10 s)。使用2-ΔΔCt相对定量方法计算TLR4、NF-κB mRNA 水平。
1.8 肺组织TLR4、NF-κB 蛋白水平检测 使用蛋白提取液从上述匀浆化的右肺下叶组织中提取总蛋白,并在4 ℃下以12000 rpm 离心10 min,通过BCA蛋白质测定试剂盒评估总蛋白质浓度,将每孔等量的总蛋白上样到12%十二烷基硫酸钠-聚丙烯酰胺凝胶上进行电泳反应,并转移到聚偏二氟乙烯膜上,在室温下用5%牛血清白蛋白封闭2 h。将膜与1∶800稀释的TLR4、NF-κB、GAPDH 一抗在4 ℃孵育12 h,添加二抗继续孵育2 h。通过增强的化学发光试剂盒检测蛋白条带,用光密度法评估信号并将其标准化为GAPDH 蛋白。
1.9 统计学方法 应用SPSS 24.0 软件进行统计分析,符合正态分布计量资料采用均数±标准差()表示,多组间比较采用单因素方差分析,两两比较采用SNK-q 检验,P<0.05 表示差异有统计学意义。
2 结果
2.1 各组大鼠PaO2和PaCO2水平比较 与对照组比较,模型组大鼠PaO2水平降低,PaCO2水平升高(P<0.05);与模型组比较,虫草素低、中、高剂量组大鼠PaO2水平依次升高,PaCO2水平依次降低(P<0.05)。见表1。
表1 各组大鼠PaO2 和PaCO2 水平比较(mmHg,)
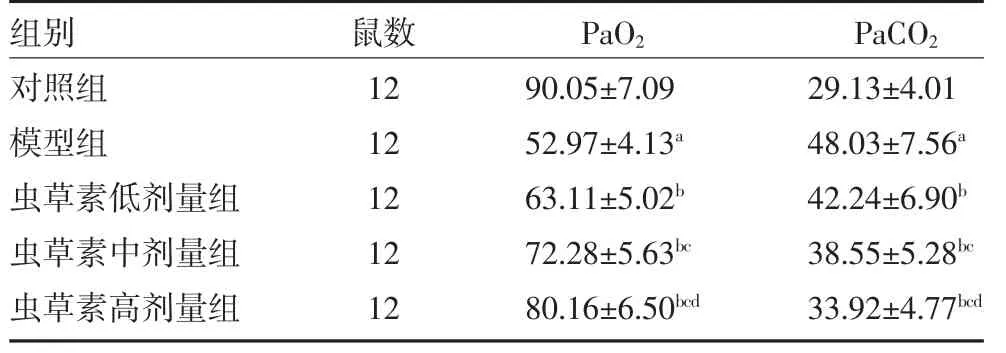
表1 各组大鼠PaO2 和PaCO2 水平比较(mmHg,)
注:对照组、模型组腹腔注射10 mL/kg 生理盐水;虫草素低、中、高剂量组分别腹腔注射5、10、20 mg/kg 的虫草素;PaO2 为动脉血氧分压;PaCO2 为动脉二氧化碳分压;1 mmHg=0.133 kPa 与对照组比较,aP<0.05;与模型组比较,bP<0.05;与虫草素低剂量组比较,cP<0.05;与虫草素中剂量组比较,dP<0.05
2.2 各组大鼠肺组织TNF-α、IL-6 和IL-1β水平比较 与对照组比较,模型组大鼠肺组织TNF-α、IL-6、IL-1β 水平升高(P<0.05);与模型组比较,虫草素低、中、高剂量组大鼠肺组织TNF-α、IL-6、IL-1β 水平依次降低(P<0.05)。见表2。
表2 各组大鼠肺组织TNF-α、IL-6 和IL-1β 水平比较(pg/mg,)
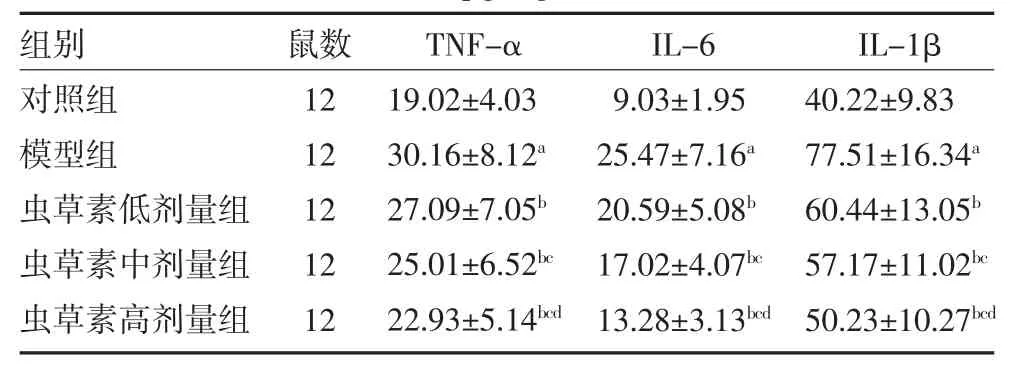
表2 各组大鼠肺组织TNF-α、IL-6 和IL-1β 水平比较(pg/mg,)
注:对照组、模型组腹腔注射10 mL/kg 生理盐水;虫草素低、中、高剂量组分别腹腔注射5、10、20 mg/kg 的虫草素;TNF-α 为肿瘤坏死因子-α;IL-6 为白细胞介素-6;IL-1β 为白细胞介素-1β;与对照组比较,aP<0.05;与模型组比较,bP<0.05;与虫草素低剂量组比较,cP<0.05;与虫草素中剂量组比较,dP<0.05
2.3 各组大鼠肺组织形态学及肺损伤评分比较 对照组大鼠肺泡组织结构正常;模型组肺泡组织受损,毛细血管扩张,红细胞渗漏和肺组织液分泌,可见炎症细胞浸润;虫草素干预后,肺泡组织趋于正常,肺泡壁变薄,红细胞、分泌液减少,炎症细胞浸润减少。见图1。

图1 各组大鼠肺组织形态学病理图(HE 染色,×200)
对照组、模型组、虫草素低、中、高剂量组大鼠肺损伤评分分别为(0.00±0.00)分、(9.58±1.03)分、(6.92±0.87)分、(4.03±0.61)分、(2.19±0.33)分。与对照组比较,模型组大鼠肺损伤评分升高(P<0.05);与模型组比较,虫草素低、中、高剂量组大鼠肺损伤评分依次降低(P<0.05)。
2.4 各组大鼠肺组织TLR4、NF-κB mRNA 水平比较 与对照组比较,模型组大鼠肺组织TLR4、NFκB mRNA 水平升高(P<0.05);与模型组比较,虫草素低、中、高剂量组大鼠肺组织TLR4、NF-κB mRNA水平依次降低(P<0.05)。见表3。
表3 各组大鼠肺组织TLR4、NF-κB mRNA 水平比较()

表3 各组大鼠肺组织TLR4、NF-κB mRNA 水平比较()
注:对照组、模型组腹腔注射10 mL/kg 生理盐水;虫草素低、中、高剂量组分别腹腔注射5、10、20 mg/kg 的虫草素;TLR4 mRNA 为Toll 样受体4 信使核糖核酸;NF-κB mRNA 为核因子-κB 信使核糖核酸;与对照组比较,aP<0.05;与模型组比较,bP<0.05;与虫草素低剂量组比较,cP<0.05;与虫草素中剂量组比较,dP<0.05
2.5 各组大鼠肺组织TLR4、NF-κB 蛋白水平比较与对照组比较,模型组大鼠肺组织TLR4、NF-κB 蛋白水平升高(P<0.05);与模型组比较,虫草素低、中、高剂量组大鼠肺组织TLR4、NF-κB 蛋白水平依次降低(P<0.05)。见表4 和图2。
表4 各组大鼠肺组织TLR4、NF-κB 蛋白水平比较()

表4 各组大鼠肺组织TLR4、NF-κB 蛋白水平比较()
注:对照组、模型组腹腔注射10 mL/kg 生理盐水;虫草素低、中、高剂量组分别腹腔注射5、10、20 mg/kg 的虫草素;TLR4 为Toll 样受体4;NF-κB 为核因子-κB;GAPDH 为甘油醛-3-磷酸脱氢酶;与对照组比较,aP<0.05;与模型组比较,bP<0.05;与虫草素低剂量组比较,cP<0.05;与虫草素中剂量组比较,dP<0.05
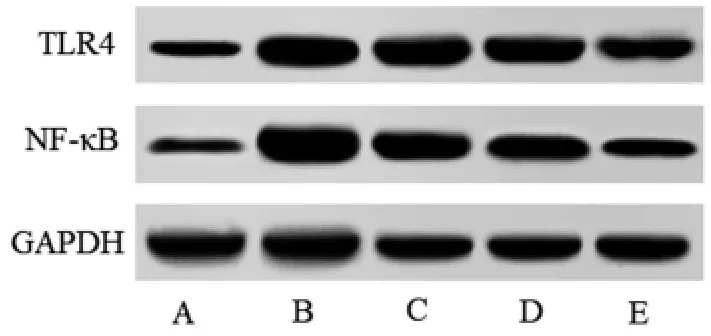
图2 各组大鼠肺组织TLR4、NF-κB 蛋白印迹图
3 讨论
虫草素是从蛹虫草中分离的活性成分,具有抗菌抗病毒、降糖降脂等多种药理作用[10]。中医认为,蛹虫草入肺肾二经,既能补肺阴,又能补肾阳,是一种能同时平衡、调节阴阳的中药[11]。Wei 等[12]研究显示,虫草素可保护创伤性脑损伤小鼠神经功能和血脑屏障的完整性,抑制炎症反应。Zhang 等[13]研究表明,虫草素可通过抑制NLRP3 炎症小体表达来发挥对帕金森病模型大鼠的神经保护作用。PaO2和PaCO2水平可反映肺功能和肺泡通气状态,余丹等[14]研究显示,缺血再灌注肺损伤大鼠较正常大鼠PaO2水平降低,PaCO2水平升高;右美托咪定可改善大鼠肺功能和肺组织炎症损伤,并且使大鼠PaO2水平升高,Pa-CO2水平降低。本研究结果显示,与对照组比较,模型组大鼠PaO2水平降低,PaCO2水平、肺损伤评分升高,肺泡组织受损,毛细血管扩张,红细胞渗漏和肺组织液分泌,可见炎症细胞浸润;经虫草素治疗后,ALI 大鼠PaO2水平呈剂量依赖性升高,PaCO2水平、肺损伤评分呈剂量依赖性降低,肺泡组织趋于正常,肺泡壁变薄,红细胞、分泌液减少,炎症细胞浸润减少。与余丹等[14]研究结果一致,说明虫草素可改善ALI 大鼠肺功能和肺损伤。
炎症在ALI 的发生和发展中起关键作用,ALI能刺激炎性因子(TNF-α、IL-6、IL-1β)的释放,而这些炎性因子进一步增强了炎症反应并加重了肺损伤[15]。张永红等[16]研究发现,ALI 小鼠支气管肺泡灌洗液中TNF-α、IL-1β、IL-6 水平较健康小鼠明显升高,沙丁氨醇可抑制TNF-α、IL-1β、IL-6 表达来改善小鼠的肺损伤。王莹等[17]研究显示,肝素可抑制ALI 大鼠血清TNF-α、IL-1β、IL-6 水平并对ALI 大鼠具有保护作用。本研究结果发现,模型组大鼠肺组织TNF-α、IL-6、IL-1β 水平高于对照组,经过虫草素治疗后,ALI 大鼠肺组织TNF-α、IL-6、IL-1β 水平明显降低,与上述研究结果一致,表明虫草素可有效抑制ALI 大鼠的炎症反应。
TLR4 是免疫反应的关键调节因子,而NF-κB在炎症细胞因子的产生中起关键作用[18]。Peng 等[19]研究发现,积雪草苷能够抑制TLR4/NF-κB 通路的激活来降低ALI 小鼠肺泡上皮通透性和炎症反应。Pan等[20]研究表明,白细胞介素-35(IL-35)可抑制TLR4和NF-κB 蛋白表达来减轻ALI 小鼠肺部炎症,而发挥保护作用。本研究结果显示,模型组大鼠肺组织TLR4、NF-κB mRNA 和蛋白水平高于对照组,经虫草素治疗后,ALI 大鼠肺组织TLR4、NF-κB mRNA和蛋白水平呈剂量依赖性降低,与Peng 等[19]和Pan等[20]研究结果一致。这说明虫草素可通过抑制ALI大鼠肺组织TLR4、NF-κB mRNA 和蛋白表达进而抑制TLR4/NF-κB 通路的激活,从而减轻大鼠肺部炎症。
综上所述,虫草素可改善ALI 大鼠肺功能和肺损伤,降低肺部炎症反应,其机制可能与虫草素抑制ALI 大鼠肺组织TLR4、NF-κB mRNA 和蛋白表达进而抑制TLR4/NF-κB 通路的激活有关。

