食管扩张预测结缔组织疾病相关肺动脉高压患者远期预后的价值
杜梦迪,张春芳,顾镭,叶黄戍,祝因苏,王嫱,孙晓萱*
1南京医科大学第一附属医院风湿免疫科,2放射科,江苏 南京 210029
肺动脉高压(pulmonary arterial hypertension,PAH)是一种以肺血管重塑及负荷进行性升高为特征的综合征,进而出现右心室肥大,最终可导致右心衰竭,是结缔组织病(connective tissue disease,CTD)的严重并发症[1-3]。因起病隐匿、临床表现缺乏特异性、早期诊断困难、治疗效果不佳,PAH已成为CTD患者死亡的重要因素之一[4]。早期诊断和治疗、及时筛查PAH潜在的预后不良危险因素并及时干预,有助于改善患者的临床结局。
食管扩张是CTD 患者发生PAH 的危险因素[5]。此外,研究证实系统性硬化症(systemic sclerosis,SSc)伴食管扩张的患者在胸部CT 上可表现为更严重的间质性肺炎(interstitial lung disease,ILD)、肺血管疾病及肺动脉高压,说明食管扩张可能与CTD⁃PAH严重程度相关,但尚未得到重视。为研究食管扩张对CTD⁃PAH 患者预后的预测价值,本研究对170例CTD⁃PAH患者进行了回顾性分析,评估食管扩张对CTD⁃PAH患者远期预后的影响。
1 对象和方法
1.1 对象
回顾性分析2010 年5 月—2022 年4 月南京医科大学第一附属医院风湿免疫科收治的所有经二维超声心动图确诊的CTD⁃PAH 患者。纳入标准:①确诊CTD;②二维超声心动图确诊PAH;③年龄≥18 岁。排除标准:①严重的肺间质病变或慢性阻塞性肺疾病[6];②慢性血栓栓塞性肺高压;③有导致PAH 的药物使用史;④人类免疫缺陷病毒感染;⑤肝硬化门静脉高压;⑥左心疾病或先天性心脏病导致的肺高压;⑦合并甲状腺功能亢进疾病。
PAH 诊断标准:二维超声心动图测的肺动脉收缩压(pulmonary artery systolic pressure,PASP)>36 mmHg。CTD 诊断标准:系统性红斑狼疮(sys⁃temic lupus erythematosus,SLE)的诊断符合2019 年ACR/EULAR 分类标准;原发性干燥综合征(primary Sjogren’s syndrome,pSS)的诊断符合2016 年ACR/EULAR分类标准;SSc诊断沿用2013年ACR/EULAR分类标准;混合性结缔组织病(mixed connective tis⁃sue disease,MCTD)诊断沿用Sharp 标准;类风湿关节炎(rheumatoid arthritis,RA)的诊断符合2010 年ACR/EULAR 分类标准;未分化结缔组织病(undif⁃ferentiated connective tissue disease,UCTD)诊断符合1999年Mosca提出的分类诊断标准。患者同时满足2个或2个以上CTD 的诊断标准则定义为重叠综合征(orerlap syndrome,OS)。若患者有系统性自身免疫疾病的临床和血清学表现,但不能满足任何一个已知的结缔组织病分类标准的则定义为未分化结缔组织病。
本研究获得南京医科大学第一附属医院伦理委员会批准(2018⁃SR⁃333),所有入组患者均知情同意。
1.2 方法
1.2.1 临床资料收集
回顾性记录患者就诊时人口学信息、临床特征、WHO心功能分级、实验室检查指标、二维超声心动图参数和胸部CT参数。
随访资料收集:随访间隔时间为3~6个月,通过门诊、住院系统查询患者相关资料,电话询问患者或家属,确认患者生存状态。
1.2.2 研究终点
研究终点为5 年内全因死亡,通过电话随访患者本人或其直系亲属获得患者生存状态。生存期计算是从超声心动图确诊PAH 到本研究随访截止日期(2022 年4 月1 日)的时间间隔;若患者在研究截止期之前已经死亡,则计算确诊至患者死亡的时间间隔。
1.3 统计学方法
统计分析使用SPSS23.0 软件,绘图使用R Stu⁃dio软件。连续变量的分布以均值±标准差()或中位数(四分位数)[M(P25,P75)]表示,分类变量以例数(百分比)[n(%)]表示。不同组间的连续变量采用t检验或Wilcoxon 秩和检验,分类变量采用卡方检验或Fisher 精确检验。通过Kaplan⁃Meier 方法计算患者5 年生存率,对数秩和检验比较组间差异;使用单因素和多因素Cox比例风险模型分析不良预后的独立危险因素,危险因素以风险比(hazard ra⁃tio,HR)及95%CI 表示。P<0.05 为差异有统计学意义。
2 结果
2.1 CTD⁃PAH患者基线资料
本研究共纳入170例由二维超声心动图诊断的CTD⁃PAH患者(图1)。本研究将主动脉弓下食管直径>9 mm定义为食管扩张[7],170例CTD⁃PAH 患者亚组临床特征见表1。伴有食管扩张的CTD⁃PAH患者年龄更大,N 末端B 型利钠肽前体(N⁃terminal B⁃type natriuretic peptide precursor,NT⁃proBNP)数值更高,5年全因死亡率显著升高(表1)。

表1 CTD⁃PAH患者临床基线资料Table 1 Clinical baseline characteristics of CTD⁃PAH patients
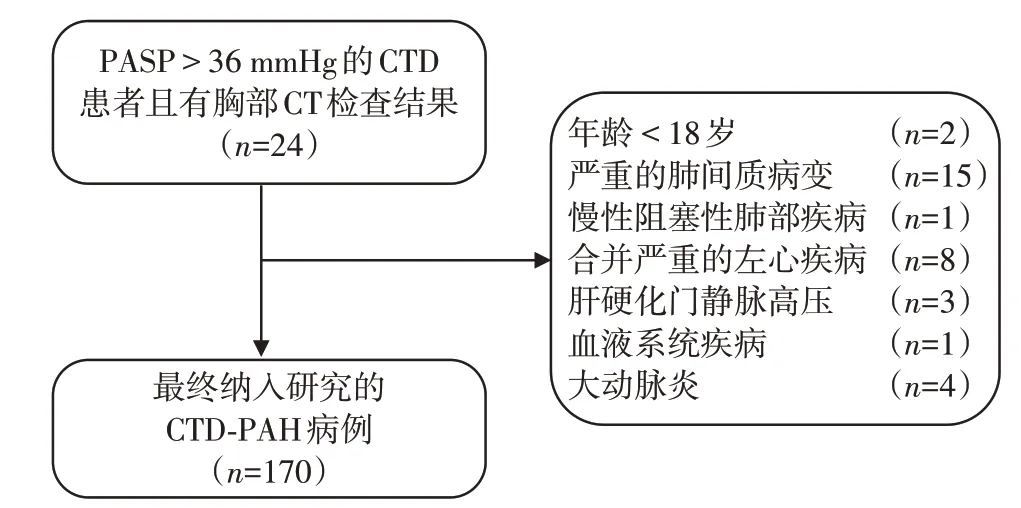
图1 二维超声心动图诊断的CTD⁃PAH患者入组流程图Figure 1 Flow chart of CTD⁃PAH patients diagnosed by echocardiography
2.2 CTD⁃PAH患者总体生存率
在到达本研究终点时间时169 例患者完成随访,其中1 例在随访58 个月后失访,平均随访时间(49.16±1.36)个月,其中38例患者死亡。本研究人群平均生存时间为(52.47±1.24)个月,总体1年、3年、5年累积生存率分别为96.4%、82.7%、72.0%(图2)。

图2 CTD⁃PAH患者整体生存曲线Figure 2 Survival curve of CTD⁃PAH patients
2.3 食管扩张对CTD⁃PAH患者预后的影响
基线时食管无扩张的患者CTD⁃PAH 患者5 年生存率明显高于食管扩张的患者(P=0.001)。基线时食管无扩张的患者有75例,其中8例发生终点事件,患者1 年、3 年、5 年累积生存率分别为100.0%、95.2%、84.8%。食管扩张患者95例,其中30例发生终点事件,患者1 年、3 年、5 年累积生存率分别为93.6%,73.0%、62.3%(图3)。

图3 食管有无扩张的CTD⁃PAH患者的生存曲线Figure 3 Survival curves of CTD⁃PAH patients with or without esophageal dilatation
对CTD⁃PAH患者进行5年全因死亡的Cox比例风险回归分析,结果如下:Cox单因素分析结果显示年龄(HR:1.037,95%CI:1.017~1.057,P<0.001),男性(HR:3.085,95%CI:1.092~8.712,P=0.033),PAH病程(HR:1.011,95%CI:1.001~1.021,P=0.035),NT⁃proBNP>1 400 ng/L(HR:8.204,95%CI:3.083~21.830,P<0.001)、食管扩张(HR:3.382,95%CI:1.550~7.380,P=0.002)是CTD⁃PAH患者5年全因死亡的危险因素(表2)。将单因素Cox 回归结果P<0.05 的指标纳入多因素Cox 回归分析中,结果显示PAH 病程(HR:1.012,95%CI:1.000~1.024,P=0.042)、NT⁃proBNP>1 400 ng/L(HR:8.360,95% CI:3.047~22.391,P<0.001)和食管扩张(HR:3.003,95%CI:1.124~8.022,P=0.028)是CTD⁃PAH患者全因死亡风险增加的独立危险因素(表2)。
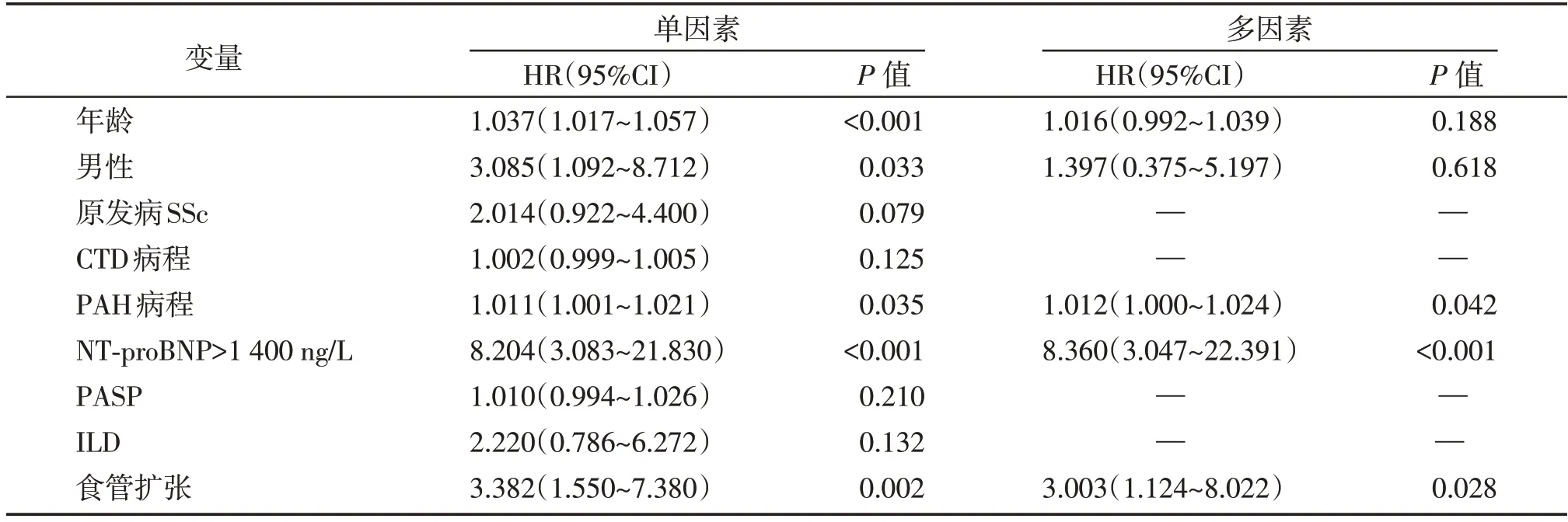
表2 Cox风险模型分析CTD⁃PAH患者5年全因死亡危险因素Table 2 The 5⁃year all⁃cause mortality risk factors in CTD⁃PAH patients analyzed by Cox risk regression model
3 讨论
本研究发现,基线时存在食管扩张的CTD⁃PAH患者病死率较高;Kaplan⁃Meier 曲线提示基线时主动脉弓下食管直径>9 mm的患者5年生存率显著低于食管直径≤9 mm 的患者。校正年龄、性别、PAH病程、NT⁃proBNP后,Cox 回归分析显示基线时食管扩张是CTD⁃PAH预后的独立危险因素,它可能是预测CTD⁃PAH患者远期不良预后的一个潜在指标。
PAH是一类常见的肺血管疾病,主要病理生理学特征为静息状态下肺动脉压力升高,同时合并不同程度的右心功能衰竭[1]。目前PAH病情严重程度及预后评估的主要根据是2018年简易版危险分层,达到并维持低危是PAH 的治疗目标[5]。近年来,PAH研究的迅速进展以及临床靶向治疗的应用,促使患者的临床症状和生活质量得到明显改善,生存时间延长[1]。然而,这些治疗并没有能够真正逆转PAH 的肺血管重塑。虽患者在随访期间已经达到且维持在低危,仍有部分患者预后欠佳,因此需要探索影响PAH预后的新指标。
胸部CT是临床上广泛应用的检查方法,对肺实质、肺间质及肺血管病变均有良好的分辨能力,在诊断、评估PAH 患者预后中均发挥重要作用[8-16]。在对所有CTD⁃PAH 患者行常规胸部CT 检查时发现,超过50%的CTD⁃PAH患者出现食管扩张。在我国CTD 患者中,最常见继发PAH 的CTD 包括SLE、pSS 及SSc。上述3 种疾病均可出现食管蠕动功能异常,但机制略有不同:①SLE 患者出现食管运动功能异常,与肌肉萎缩、食管肌肉炎症有关;②pSS患者可出现食管蠕动障碍,主要是因为食管酸的清除障碍导致食管内层暴露于过量酸,从而导致形态学变化和继发性运动障碍;③SSc 患者因组织纤维化而导致食管蠕动异常。上述改变最终可导致食管扩张。
食管扩张不仅是CTD 患者发生PAH 的危险因素,本研究同时发现基线时主动脉弓下食管直径>9 mm 的患者5 年生存率显著降低,说明食管扩张还与CTD⁃PAH 患者预后密切相关,可能原因如下:①Ishikawa等[6]发现,在伴有食管扩张的SSc 患者中,超声心动图测得PASP更高,PASP等同于右心室收缩压,并见于肺血管阻力(pulmonary vascular re⁃sistance,PVR)增加的患者,可间接反映肺血管重构的情况,影响PAH患者的预后。②与特发性肺动脉高 压(idiopathic pulmonary arterial hypertension,IPAH)不同,CTD⁃PAH 被认为是一种“有病因”的PAH,是原发病累及肺血管的一种表现。原发病的控制,不仅可以防止PAH 的继续进展,甚至有可能“逆转”PAH。CTD⁃PAH患者出现食管扩张,可能是CTD患者出现更严重内脏受累的表现。然而,在实际工作中,部分医生仅仅关注PAH的缓解,而忽视了对CTD病情的评估,原发病控制欠佳亦是CTD⁃PAH患者预后不良的原因之一。针对原发病的治疗,不仅可以防止PAH的继续进展,甚至有可能“逆转”PAH[5]。因此,针对食管扩张的原发病治疗可能改善PAH患者预后,但仍需大样本前瞻性研究进一步证实。
本研究存在一定局限性:①为回顾性单中心研究,研究样本量较少,可能存在部分研究偏倚,仍需多中心、大样本的前瞻性研究进一步验证。②本研究通过二维超声心动图来诊断PAH,不能准确评估患者血流动力学紊乱的程度。
综上所述,食管扩张可能是预测CTD⁃PAH患者远期不良预后的指标之一。本研究数据显示基线时主动脉弓下食管直径>9 mm的患者远期生存率显著降低。未来还需更多大样本、高质量的研究加以证实,从而为改善CTD⁃PAH患者的预后提供理论依据。

