TUBA1C在乳腺癌中的表达及其生物学功能探讨
梅杰,许隽颖,王惠宇,顾丁一,刘超英
南京医科大学附属无锡人民医院肿瘤科,江苏 无锡 214023
乳腺癌是一种常见的恶性肿瘤,在全球女性恶性肿瘤中发病率最高[1]。作为一种复杂的异质性疾病,乳腺癌在分子特征和恶性程度上显示出很大的差异性[2]。尽管近年来针对乳腺癌的治疗手段不断发展,包括外科手术、内分泌治疗、化疗、放疗和靶向疗法在内的综合手段已在很大程度上提高了疗效,但对晚期患者仍缺乏有效治疗手段[3-6]。因此,应进一步探究与乳腺癌发生、发展相关的功能基因,探索新的发病机制和治疗靶点。
细胞骨架,包括微管、微丝和中间丝,与增殖、迁移、侵袭等多种细胞生物学行为密切相关[7]。微管是真核细胞中普遍存在的纤维结构,在多种肿瘤的发生和发展中起着至关重要的作用。细胞中微管的形成与重塑在很大程度上由微管基因超家族介导[8-9]。此外,包括紫杉醇在内的多种微管靶向化疗药物已广泛用于乳腺癌等常见肿瘤的临床治疗[10]。鉴于微管基因超家族在乳腺癌中的重要作用,本研究对微管基因超家族成员的表达差异和预后价值进行系统分析,从而选定微管蛋白α家族1c蛋白(tubulin,alpha 1c,TUBA1C)作为研究对象。进一步通过免疫组化(immunochemistry,IHC)染色和细胞学实验,明确TUBA1C 在乳腺癌中表达的临床意义及其生物学功能。
1 对象和方法
1.1 对象
1.1.1 癌症基因组图谱数据获取
从UCSC Xena(https://xenabrowser.net/datapages/)下载癌症基因组图谱(the Cancer Genome Atlas,TCGA)乳腺癌RNA 测序数据。基因表达采用log2(x+1)标准化形式表示。共保留含有微管基因超家族表达数据的1 104 个乳腺癌和114 个正常样本。通过参考Nami等[8]的研究确定微管基因超家族的成员。
1.1.2 Kaplan⁃Meier plotter数据库
采用Kaplan⁃Meier plotter 数据库(http://kmplot.com)分析微管基因超家族的预后价值[11]。选择每个基因的JetSet最佳探针表达量代表微管基因超家族的表达量(表1)。乳腺癌样本的基因表达中位水平作为生存分析的分组截点。在线计算风险比(hazard ratio,HR)、95%置信区间(confidence inter⁃val,CI)和P值。
1.1.3 Oncomine数据库
从Oncomine数据库(https://www.oncomine.org/)中获取各种恶性肿瘤中TUBA1C 的mRNA 表达数据[12]。判断TUBA1C 在癌与癌旁组织中是否显著差异表达的标准如下:P值为1×10-4,倍数变化为2,基因排名位于前10%。
1.1.4 组织芯片获取
两张乳腺癌组织芯片(tissue microarray,TMA)(HBreD140Su03和HBreD077Su01)购自上海芯超生物科技有限公司。HBreD140Su03 芯片包含140 个乳腺癌组织位点,HBreD077Su01芯片包含其中配对的77 个癌旁组织位点。组织芯片的使用由上海芯超生物科技有限公司临床研究伦理委员会审批通过(审批编号:YBM⁃05⁃02)。
1.2 方法
1.2.1 免疫组化
在两张TMA上进行IHC染色。过程如下:按常规方法进行脱蜡,水合,将切片用二甲苯浸泡5 min,更换二甲苯后再浸泡5 min。分别用无水乙醇浸泡5 min,95%乙醇浸泡5 min,85%乙醇浸泡5 min,70%乙醇中浸泡5 min,PBS 浸洗3 min×3 次。柠檬酸钠缓冲液抗原修复,滴3%H2O2⁃甲醇溶液灭活内源性过氧化物酶,1%BSA 工作液封闭,滴加TUBA1C 一抗(1∶100 稀释,Abcam 公司,美国)。4 ℃孵育过夜,PBS 缓冲液冲洗3次,滴加二抗,37 ℃孵育30 min,PBS缓冲液冲洗3次。DAB反应染色,冲洗后苏木精复染,干燥封片检测。在免疫组化染色过程中,有6例癌组织芯点和5例癌旁组织芯点脱片。使用显微镜(Olympus BX43)对免疫染色的切片进行拍照。由两位高年资病理科医师采用12分制独立对每个组织位点进行半定量分析,将染色阳性细胞百分比评为0~4 分:0 分(<5%)、1 分(6%~25%)、2 分(>25%~50%)、3分(>50%~75%)和4分(>75%),将染色强度评为0~3 分:0 分(阴性)、1 分(弱)、2 分(中)、3 分(强)。免疫反应性评分(immunoreactivity score,IRS)为阳性细胞的百分比评分和染色强度评分的乘积。
1.2.2 细胞培养和siRNA转染
MCF7 和MDA⁃MB⁃231 细胞购自江苏凯基生物技术股份有限公司。MCF7 细胞培养条件为90%RMPI⁃1640 培养基+10%FBS,MDA⁃MB⁃231 细胞培养条件为90%L15培养基+10%FBS,37 ℃、5%CO2、饱和湿度培养箱中培养。使用Lipofectamine 3000(Invitrogen公司,美国)进行转染操作,过程如下:转染前1天,接种适当数量的细胞至6孔板中,使转染时的细胞密度为50%~60%;用125 μL不含血清的培养基Opti⁃MEM稀释5 μL 20 μmol/L TUBA1C siRNA及对照siRNA(NC),轻轻混匀,室温孵育5 min;用125 μL 不含血清的培养基Opti⁃MEM稀释5 μL Lipofectamine 3000,轻轻混匀并室温孵育5min;将siRNA 稀释液和Lipofectamine 3000 稀释液轻轻混匀,室温孵育20 min;将混合液加入含有细胞的750 μL 完全培养基的培养孔中,轻轻混匀,置于37 ℃的5%CO2培养箱中继续培养24 h 用于后续操作。委托江苏凯基生物技术股份有限公司构建了3 条靶向TUBA1C的siRNA(表2)。

表2 针对TUBA1C设计的siRNA序列Table 2 Sequences of siRNA designed for TUBA1C
1.2.3 实时定量PCR检测基因表达
使用TRIzol 试剂(Invitrogen 公司,美国)提取各组乳腺癌细胞的总RNA。mRNA 逆转录引物通过Primer 6软件设计,用于基因扩增的引物GAPDH:5′⁃CAAATTCCATGGCACCGTCA⁃3′(正向),5′⁃AG⁃CATCGCCCCACTTGATTT⁃3′(反向);TUBA1C:5′⁃GGGATGAGTGCTTTGTGTGC⁃3′(正向),5′⁃GTGT⁃TAAAAGGCGCAGGGAG⁃3′(反向)。使用SYBR Green(One Step TB GreenTMPrimeScriptTMRT⁃PCR KitⅡ,TaKaRa 公司,日本)对扩增的基因进行标记,反应40个循环。2-ΔΔCt方法用于GAPDH 和TUBA1C表达量分析。
1.2.4 Western blot检测蛋白表达
使用全蛋白抽提试剂盒提取各组乳腺癌细胞总蛋白,BCA 法测定蛋白浓度。取20 μg 蛋白加入SDS⁃PAGE上样孔,电泳分离后电转移至NC膜;采用10%BSA溶液封闭后用一抗(1∶2 000稀释,Abcam 公司,美国)4 ℃孵育过夜,TBST清洗后加入HRP标记的二抗4 ℃孵育4 h;ECL法显色后曝光并采集图片,使用Gel⁃Pro32软件对结果进行灰度分析。
1.2.5 细胞增殖CCK⁃8检测
转染前将乳腺癌细胞消化、计数、配制成浓度为6×104个/mL的细胞悬液,在96孔细胞培养板中每孔加入100 μL 细胞悬液;将96 孔细胞培养板置于37 ℃、5% CO2培养箱中培养24 h,根据组别进行转染,同时设立阴性对照组,每组设置3个复孔;转染后置于37 ℃、5%CO2培养箱中继续培养24 h。之后以24 h、48 h、72 h作为时间节点每孔加入10 μL CCK⁃8溶液进行CCK8分析,测定450 nm时的吸光度值。
1.2.6 流式细胞仪分析细胞凋亡
将对数生长期的细胞消化接种到6 孔板中,待细胞贴壁后,根据组别进行转染,同时设立阴性对照组,每组设置3 个复孔;转染24 h后,0.25%胰酶(不含EDTA)消化收集细胞;PBS洗涤细胞2次并离心(1 000 r/min,5 min)收集约5×105个细胞;500 μL的Binding Buffer 悬浮细胞,加入5 μL Annexin V⁃APC 并混匀,再加入5 μL 7⁃AAD 并混匀;室温避光反应10 min;流式细胞仪检测细胞凋亡的情况。
1.3 统计学方法
数据分析均采用SPSS 26.0 软件。部分生物信息学分析和图像可视化采用R语言进行。计量资料在统计图中以均数±标准差()表示。计量资料的两两比较采用独立样本t检验,TUBA1C表达高低与临床病理参数的关系采用χ2检验,生存分析采用Kaplan⁃Meier 检验,单、多因素Cox 回归分析。P<0.05为差异有统计学意义。
2 结果
2.1 乳腺癌中微管基因超家族的表达和预后分析
基于TCGA和Kaplan⁃Meier plotter数据库的生物信息学分析表明,部分微管基因超家族成员在乳腺癌中表达明显失调,其中TUBB3、TUBA3D、TUBA1C为上调最明显的3个成员,TUBB3B、TUBB6、TUBG2为下调最明显的3 个成员(图1A、B)。微管基因超家族中,共9 个成员和乳腺癌的预后密切相关,其中TUBB3、TUBBB4B、TUBB2A、TUBB、TUBG1、TUBA1C和TUBB6 是预后危险因素,TUBGCP2 和TUBGCP6是预后保护因素(图1C)。
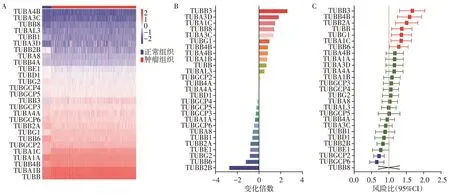
图1 乳腺癌中微管基因超家族的表达和预后分析Figure 1 Expression level and prognostic value of microtubule gene superfamily in breast cancer
2.2 微管蛋白TUBA1C在乳腺癌中的表达
选取同时满足表达丰度位于前10位、差异倍数≥1.5 倍且预后价值显著的微管基因作为后续研究对象,其中TUBB6和TUBA1C满足条件(图2A)。进一步选取在乳腺癌中缺乏研究的TUBA1C作为研究对象,在Oncomine数据库中进行检索,结果表明,在大部分研究中TUBA1C在乳腺癌及其他恶性肿瘤组织中均呈表达上调趋势(表3)。IHC 结果表明,TU⁃BA1C 在乳腺癌组织中的阳性率为68.66%,癌旁组织中阳性率为50.00%,两者相比差异有统计学意义(χ2=6.929,P=0.008,图2B,表4)。
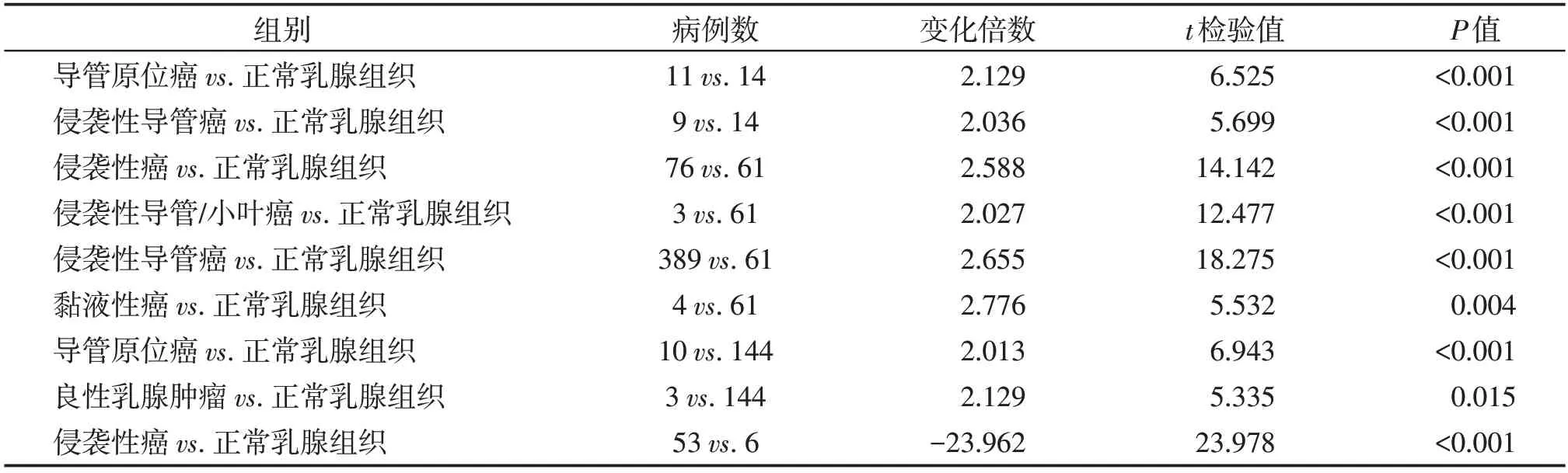
表3 Oncomine数据库中乳腺癌与正常乳腺组织中TUBA1C mRNA的表达水平Table 3 TUBA1C expression in mRNA level between breast cancer tissues and normal tissues in Oncomine database
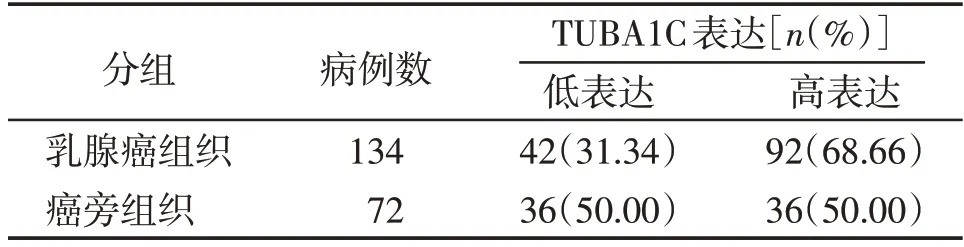
表4 乳腺癌组织和癌旁组织中TUBA1C表达比较Table 4 Comparison of TUBA1C expression in breast cancer and paracancerous tissue

图2 关键微管基因选取及TUBA1C表达验证Figure 2 Selection of key microtubule genes and validation of TUBA1C expression
2.3 微管蛋白TUBA1C 表达与病理参数和预后的关系
χ2检验结果表明,TUBA1C表达状态与年龄(χ2=1.004,P=0.316)、T分期(χ2=0.329,P=0.848)、N分期(χ2=1.712,P=0.634)、分化程度(χ2=0.048,P=0.827)、雌激素受体状态(χ2=0.114,P=0.735)、孕激素受体状态(χ2=0.667,P=0.414)及HER2 状态(χ2=2.551,P=0.110)均无显著相关性,但与TNM分期(χ2=6.357,P=0.042)和生存状态(χ2=6.432,P=0.011)存在显著相关性(表5)。

表5 TUBA1C表达水平和乳腺癌病理参数的关系Table 5 Association between TUBA1C expression and clinical features in breast cancer[n(%)]
Kaplan⁃Meier法分析表明,TUBA1C高表达与乳腺癌患者较短的总生存期(overall survival,OS)显著相关(P=0.021),即乳腺癌组织中TUBA1C高表达的患者预后较低表达的患者更差(图3)。在总生存预后因素的单、多因素Cox回归模型中,年龄(单因素:P=0.001,多因素:P<0.001)和TUBA1C 表达状态(单因素:P=0.032,多因素:P=0.040)均是乳腺癌患者的独立预后因素(表6)。
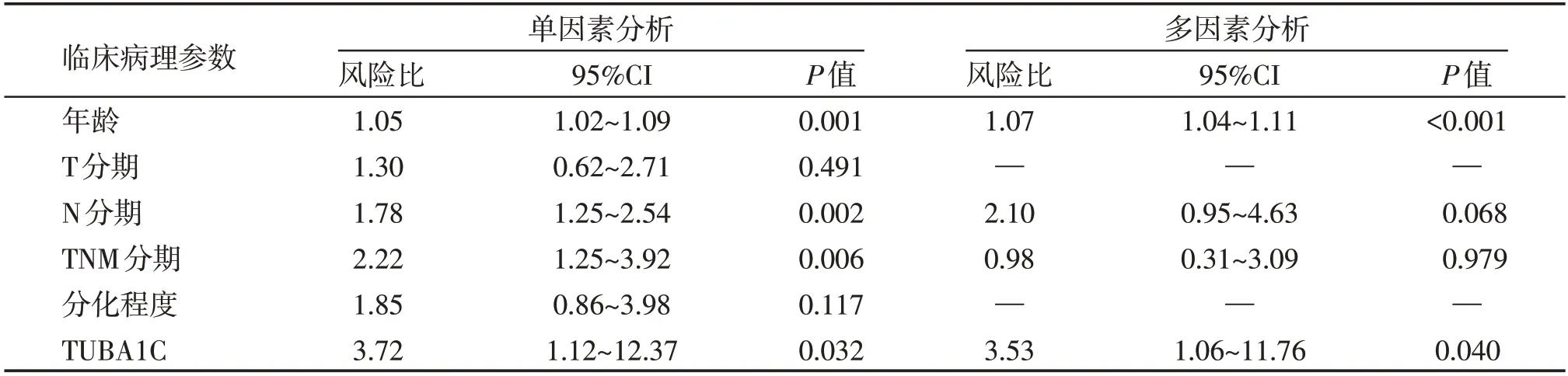
表6 乳腺癌患者生存因素的单、多因素分析Table 6 Univariate and multivariate analysis of survival factors in patients with breast cancer

图3 乳腺癌组织TUBA1C表达与预后的关系Figure 3 Association between TUBA1C expression and prognosis
2.4 针对TUBA1C的siRNA筛选和沉默效率验证
选取MDA⁃MB⁃231和MCF⁃7乳腺癌细胞作为细胞实验载体,qPCR 和Western blot 结果表明,转染siRNA⁃2的细胞中,TUBA1C mRNA和蛋白呈现最大幅度下调(图4)。
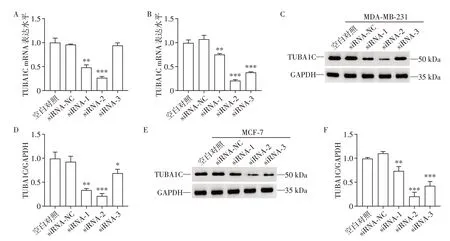
图4 siRNA沉默TUBA1C基因的效率验证Figure 4 Validation of siRNA silencing efficiency of TUBA1C gene
2.5 敲低TUBA1C对乳腺癌细胞增殖、凋亡的影响
采用CCK⁃8 法检测细胞增殖能力。转染24 h、48 h、72 h后两株乳腺癌细胞增殖变化结果如图5所示。转染操作本身在一定程度上影响了细胞增殖,但相对转染siRNA⁃NC组的细胞,转染siRNA⁃2的乳腺癌细胞增殖能力受到显著抑制。进一步采用流式细胞分析比较敲低TUBA1C 对细胞凋亡的影响。类似的,转染操作本身在一定程度上诱导了细胞凋亡,但相对于转染siRNA⁃NC组的细胞,转染siRNA⁃2的乳腺癌细胞凋亡率显著增加(MDA⁃MB⁃231:P=0.001,MCF⁃7:P<0.001,图6)。
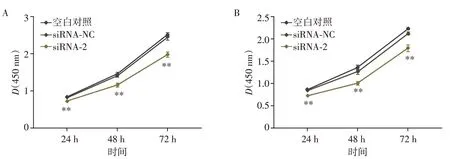
图5 转染siRNA后乳腺癌细胞增殖能力比较Figure 5 Comparison of proliferation of breast cancer cells transfected with siRNA

图6 转染siRNA后乳腺癌细胞凋亡水平比较Figure 6 Comparison of apoptosis of breast cancer cells transfected with siRNA
3 讨论
微管基因超家族是一个成员数量众多的基因家族,共有6 个亚家族。除了构成微管蛋白二聚体的α⁃微管蛋白和β⁃微管蛋白家族外,微管基因超χ2=6.929,P=0.008。免疫组化评分≤4 分为低表达,>4 分为高表达。家族还包括γ、δ、ε、η家族[8]。γ⁃微管蛋白在中心体微管装配的成核过程中起关键作用[13]。微管家族其他成员的作用仍有待进一步阐明。因此,本研究使用TCGA 和Kaplan⁃Meier plotter 数据系统分析乳腺癌中微管基因超家族表达水平和预后价值。结果发现部分微管基因表达水平失调,且具有明显的预测预后的价值,通过设定的标准进一步选取TUBA1C作为候选对象进行深入研究。
TUBA1C 是α⁃微管蛋白的一种亚型,是一种多功能的细胞骨架蛋白,与微管结构的组织有关,参与调控诸多关键的细胞行为,对细胞分裂过程至关重要[14-15]。既往研究表明,TUBA1C在胰腺癌、肝癌等多种恶性肿瘤中均上调,而敲低TUBA1C 表达可显著抑制肿瘤的生长和进展[15-17]。此外,最近研究表明,敲除β⁃微管蛋白可增强长春碱抑制有丝分裂和诱导细胞凋亡的能力[18]。但是目前尚无TUBA1C在乳腺癌中表达及作用的相关研究报道。
基于以上内容,本研究推测TUBA1C 可能同样在乳腺癌中起到癌基因的作用。首先,Oncomine数据库和IHC 分析证实,乳腺癌组织中TUBA1C 表达量显著高于癌旁正常乳腺组织。TUBA1C高表达与较高的临床分期和较差的预后显著相关。此外,单因素和多因素回归分析表明,TUBA1C 上调是乳腺癌患者预后的独立危险因素。此前,Wang等[19]通过生物信息学分析发现TUBA1C是乳腺癌的预后相关基因,这与本研究结论一致。
本研究进一步通过细胞学实验研究TUBA1C在乳腺癌细胞中的功能。对两株常用的乳腺癌细胞MDA⁃MB⁃231 和MCF⁃7 进行转染,结果发现转染靶向TUBA1C 的siRNA后,两株乳腺癌细胞的增殖能力受到了明显抑制,同时凋亡率明显上升。本研究的发现与先前在肝癌和胰腺癌中的研究结果一致,即敲低TUBA1C 抑制肿瘤细胞增殖并诱导凋亡,从而抑制肿瘤的进展[15-16]。机制方面,生物信息学分析提示TUBA1C对细胞周期、孕酮介导的卵母细胞成熟、卵母细胞减数分裂、蛋白酶体、DNA复制、p53信号转导等多条通路有潜在调控关系[15]。此外,最新研究表明,TUBA1C 是长链非编码RNA RP11⁃480I12.5 的亲本基因,而后者通过上调AKT3和CDK6促进乳腺癌的恶性进展[20]。
综上所述,通过对微管基因超家族进行系统分析和验证,本研究发现乳腺癌组织中TUBA1C 的水平明显上调,且与乳腺癌的进展和不良预后密切相关。此外,敲低TUBA1C 表达可以抑制乳腺癌细胞增殖并诱导其凋亡。因此TUBA1C可作为乳腺癌中潜在的诊断和预后标志物及治疗靶点。
——水芹主要害虫识别与为害症状

