球形脂联素对间歇低氧所致H9C2细胞损伤的保护作用及机制
丁文筱,张蔷,丁宁,张希龙,董艳彬
1东南大学附属中大医院呼吸与危重症医学科,江苏 南京 210009;2南京医科大学第一附属医院呼吸与危重症医学科,3急诊科,江苏 南京 210029
阻塞性睡眠呼吸暂停低通气综合征(obstruc⁃tive sleep apnea hypopnea syndrome,OSAHS)是由于睡眠期间反复出现上气道的完全或部分坍陷,引起间歇低氧(intermittent hypoxia,IH)、交感神经兴奋、睡眠片段化、胸腔负压增加等病理生理特征的睡眠呼吸疾患。OSAHS的发病率近年来逐渐升高,据统计,20 世纪末期OSAHS 发病率在男性中高达34%,女性中高达17%[1]。OSAHS 与许多心血管疾病相关,如高血压、心律失常、冠心病、心衰等[2]。OSAHS不仅增加心血管疾病的发生率,还增加其死亡率[3]。Mazzotti等[4]报道约26.3%的OSAHS 患者患有心血管疾病,约17.6%的OSAHS 患者会发生严重心血管事件。IH 是OSAHS 致病的主要病理特征。但目前OSAHS致心血管疾病的具体机制仍未研究清楚。
线粒体自噬是选择性自噬的一种,对维持细胞稳态具有重要作用。线粒体自噬是一把双刃剑,一方面可通过降解损伤的线粒体维持线粒体稳定,促进细胞存活;另一方面过度的线粒体自噬也可导致细胞死亡[5-6]。但目前为止,线粒体自噬在IH 所致心肌损伤中起到保护或是损伤作用并不清楚。
脂联素是由脂肪组织分泌的细胞因子,具有抗炎、减轻胰岛素抵抗、抗动脉粥样硬化等机体保护作用。脂联素在血浆中含量丰富,其活性形式主要有2 种:全长脂联素和球形脂联素(globular adipo⁃nectin,gAPN)[7]。研究显示OSAHS患者血浆脂联素水平较健康对照人群下降,且下降程度与OSAHS严重程度呈正比[8]。前期动物研究发现补充gAPN 可减轻IH 所致心肌损伤[9]。因此推测脂联素水平的下降参与了OSAHS所致心血管系统损伤,然而脂联素心肌保护机制并未完全阐明。
本研究通过建立OSAHS 细胞模型,旨在探索gAPN减轻IH所致心肌损伤的机制及线粒体自噬在其中的作用,为将来开发治疗OSAHS新药奠定理论基础。
1 材料和方法
1.1 材料
gAPN(Biovision 公司,美国);帕金蛋白抗体(Parkin)、B 淋巴细胞瘤/白血病⁃2(B⁃cell lymphoma/leukemia⁃2,Bcl⁃2)蛋白抗体(Abcam公司,美国);Bcl⁃2相关X蛋白质(BCL2⁃associated X protein,Bax)、β肌动蛋白(β⁃actin)抗体(Cell Signaling Technology 公司,美国);细胞培养板(Zellkontakt 公司,德国);小干扰RNA(siRNA)(上海吉玛制药技术有限公司);绿色荧光蛋白⁃微管相关蛋白轻链3(green fluores⁃cent protein⁃microtubule⁃associated protein light chain 3,GFP⁃LC3)腺病毒(上海汉恒生物科技有限公司);线粒体红色荧光探针、Lipofectamin2000(Thermofisher公司,美国);线粒体膜电位检测(JC⁃1)试剂盒(上海碧云天生物技术有限公司);蛋白提取试剂盒(江苏凯基生物技术有限公司)。
1.2 方法
1.2.1 实验细胞培养及分组
大鼠心肌细胞H9C2(中国医学科学院细胞库)采用含10%胎牛血清的高糖达尔伯克改良伊格尔培养基,培养于37℃、5%CO2恒温箱中。实验分组:①对照组、gAPN 组、IH 组、IH+gAPN 组;②对照siR⁃NA 组、Parkin siRNA 组、IH+对照siRNA 组、IH+gAPN+对照siRNA 组、IH+Parkin siRNA 组、IH+gAPN+Parkin siRNA组。
1.2.2 细胞IH模型建立
参照已发表文献建立细胞IH 模型[10]。IH 模型采用三气培养箱,通过调节N2、O2的浓度实现。将细胞接种于含透气膜的6 孔板上。使用含1 μg/mL gAPN 的培养基培养H9C2 细胞,将细胞置于37 ℃、5%CO2恒温箱中孵育24 h。接着将细胞置于三气培养箱进行IH 暴露,IH 循环:95%N2/5%CO2混合气体培养10 min,21% O2/5% CO2/74% N2混合气体培养10 min,共循环48 h。对照组细胞置于21% O2/5%CO2/74%N2混合气体中培养48 h。收集细胞进行后续实验。
1.2.3 细胞凋亡检测
使用流式细胞仪检测H9C2心肌细胞凋亡。培养细胞,分别进行实验干预后,消化、离心收集H9C2心肌细胞。预冷PBS洗涤2遍,使用500 μL缓冲液重悬细胞。接着加入5 μL 膜黏连蛋白⁃5(An⁃nexin V)和5 μL 碘化丙啶(propidiumiodide,PI),37 ℃避光孵育15 min。使用流式细胞仪检测细胞凋亡。
1.2.4 线粒体自噬检测
采用线粒体红色荧光探针与GFP⁃LC3 腺病毒荧光共定位的方法进行线粒体自噬的检测。采用GFP⁃LC3 腺病毒转染H9C2 细胞。转染后,进行实验干预。接着,采用线粒体红色荧光探针避光孵育30 min。使用激光共聚焦显微镜检测线粒体自噬。红色荧光、绿色荧光及黄色荧光分别代表线粒体、LC3、线粒体自噬小体。
1.2.5 线粒体膜电位(mitochondrial membrane potential,MMP)检测
使用JC⁃1试剂盒进行MMP检测。培养细胞,进行实验干预后,消化、离心收集H9C2 细胞。0.5 mL培养液重悬细胞,加入0.5 mL JC⁃1染色工作液37 ℃孵育20 min,600g离心4 min。采用JC⁃1缓冲液洗涤2次后,重悬细胞,荧光分光光度计检测MMP。
1.2.6 蛋白表达检测
按照蛋白提取试剂盒说明书提取H9C2 心肌细胞蛋白,使用蛋白定量试剂盒检测蛋白浓度。取30 μg 蛋白进行电泳,后将蛋白电转移至聚偏氟乙烯膜上。采用封闭液室温封闭蛋白膜1 h后置于一抗中4 ℃孵育过夜,置于二抗中37 ℃孵育1 h。使用化学发光液检测Bax、Bcl⁃2、Parkin、β⁃actin蛋白表达水平。
1.2.7 Parkin siRNA转染
Parkin siRNA 用于抑制Parkin 基因表达。按照Lipofectamin2000 说明书,使用Parkin siRNA、对照siRNA 转染H9C2 心肌细胞。转染后,进行后续实验。Parkin siRNA 序列为5′⁃CCAACUCCCUGAU⁃UAAAGATT⁃3′和5′⁃UCUUUAAUCAGGGAGUUG⁃GTT⁃3′;对照siRNA 序列为5′⁃UUCUCCGAACGU⁃GUCACGUTT⁃3′和5′⁃ACGUGACACGUUCGGAGA⁃ATT⁃3′。
1.3 统计学方法
采用Graphpad 7.0 统计软件进行分析,符合正态分布的计量资料采用均数±标准差()表示。符合正态分布、方差齐性,多组间比较采用单因素方差分析,事后检验采用图基检验。P<0.05 为差异有统计学意义。
2 结果
2.1 gAPN减轻IH所致H9C2细胞凋亡
与对照组(5.07±0.25)%和gAPN 组(4.60±0.76)%相比,IH 组H9C2 细胞凋亡率[(27.90±1.90)%]明显升高;与IH 组相比,IH+gAPN 组细胞凋亡率[(17.77±1.85)%]下降(图1);差异有统计学意义(P<0.05,n=3)。对照组和gAPN 组上述指标差异无统计学意义(P>0.05,n=3)。
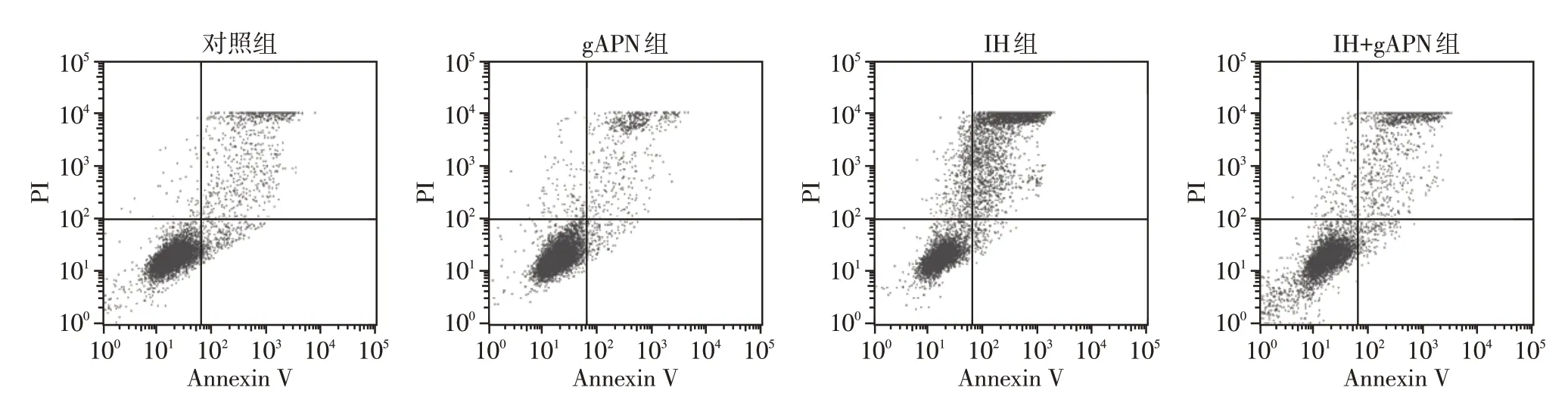
图1 各组H9C2细胞凋亡Figure 1 H9C2 cell apoptosis in each group
2.2 gAPN减轻IH所致H9C2细胞线粒体损伤
与对照组和gAPN 组相比,IH 组MMP 及Bcl⁃2蛋白表达水平均下降;与IH 组相比,IH+gAPN 组MMP及Bcl⁃2蛋白表达水平升高(图2);差异均具有统计学意义(P<0.05,n=3)。与对照组和gAPN 组相比,IH 组Bax 蛋白表达水平升高;与IH 组相比,IH+gAPN组Bax蛋白表达水平下降(图2),差异有统计学意义(P<0.05,n=3)。对照组和gAPN 组上述指标差异无统计学意义(P>0.05,n=3)。
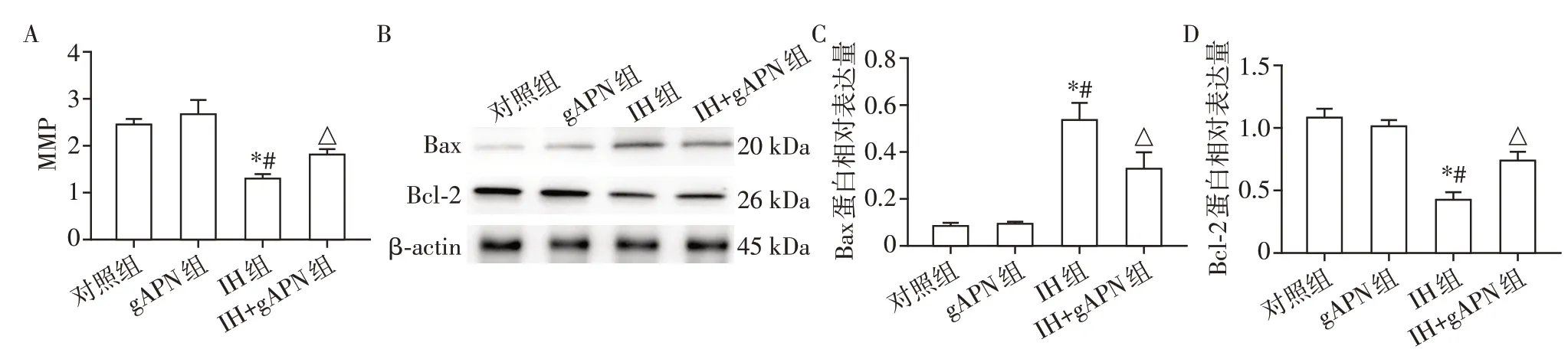
图2 各组H9C2细胞线粒体损伤Figure 2 Mitochondrial injury of H9C2 cells in each group
2.3 gAPN上调Parkin介导的线粒体自噬
与对照组和gAPN 组相比,IH 组线粒体自噬小体、Parkin 蛋白表达水平升高(图3);与IH 组相比,IH+gAPN 组线粒体自噬小体、Parkin 蛋白表达水平明显升高;差异均具有统计学意义(P<0.05,n=3)。对照组和gAPN组上述指标差异无统计学意义(P>0.05,n=3)。
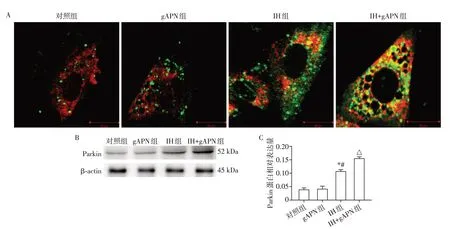
图3 各组H9C2细胞线粒体自噬及Parkin蛋白表达Figure 3 Mitophagy and Parkin protein expression of H9C2 cells in each group
2.4 Parkin siRNA 转染抑制Parkin 表达后,线粒体自噬被下调
与对照siRNA组相比,Parkin siRNA组Parkin蛋白表达水平明显下降(图4)。与对照siRNA 组及Parkin siRNA组相比,IH+对照siRNA组线粒体自噬小体、Parkin 蛋白表达水平升高;与IH+对照siRNA组相比,IH+gAPN+对照siRNA 组线粒体自噬小体、Parkin 蛋白表达水平升高;与IH+对照siRNA 组相比,IH+Parkin siRNA 组线粒体自噬小体、Parkin 蛋白表达水平明显下降;与IH+gAPN+对照siRNA 组相比,IH+gAPN+Parkin siRNA 组线粒体自噬小体、Parkin 蛋白表达水平明显下降;差异均具有统计学意义(P<0.05,n=3)。对照siRNA 组和Parkin siRNA 组线粒体自噬小体差异无统计学意义(P>0.05,n=3)。
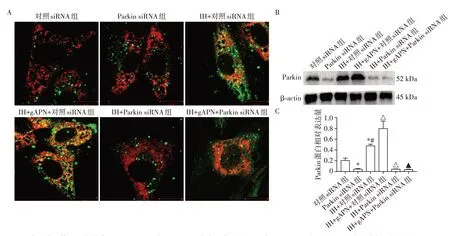
图4 抑制Parkin表达后各组H9C2细胞线粒体自噬及Parkin蛋白表达Figure 4 Mitophagy and Parkin protein expression of H9C2 cells in each group after inhibiting Parkin gene expression
2.5 Parkin siRNA 转染抑制Parkin 表达增加H9C2细胞凋亡
如图5 所示,与对照siRNA 组(5.23±0.61)%及Parkin siRNA 组(5.03±0.15)%相比,IH+对照siRNA组细胞凋亡率[(27.47±0.91)%]升高;与IH+对照siRNA组相比,IH+gAPN+对照siRNA组细胞凋亡率[(17.00±1.67)%]下降;与IH+对照siRNA组(27.47±0.91)%相比,IH+Parkin siRNA 组细胞凋亡率[(39.83±2.15)%]升高;与IH+gAPN+对照siRNA 组相比,IH+gAPN+Parkin siRNA 组细胞凋亡率[(28.63±1.70)%]升高;差异均具有统计学意义(P<0.05,n=3)。对照siRNA 组和Parkin siRNA 组上述指标差异无统计学意义(P>0.05,n=3)。
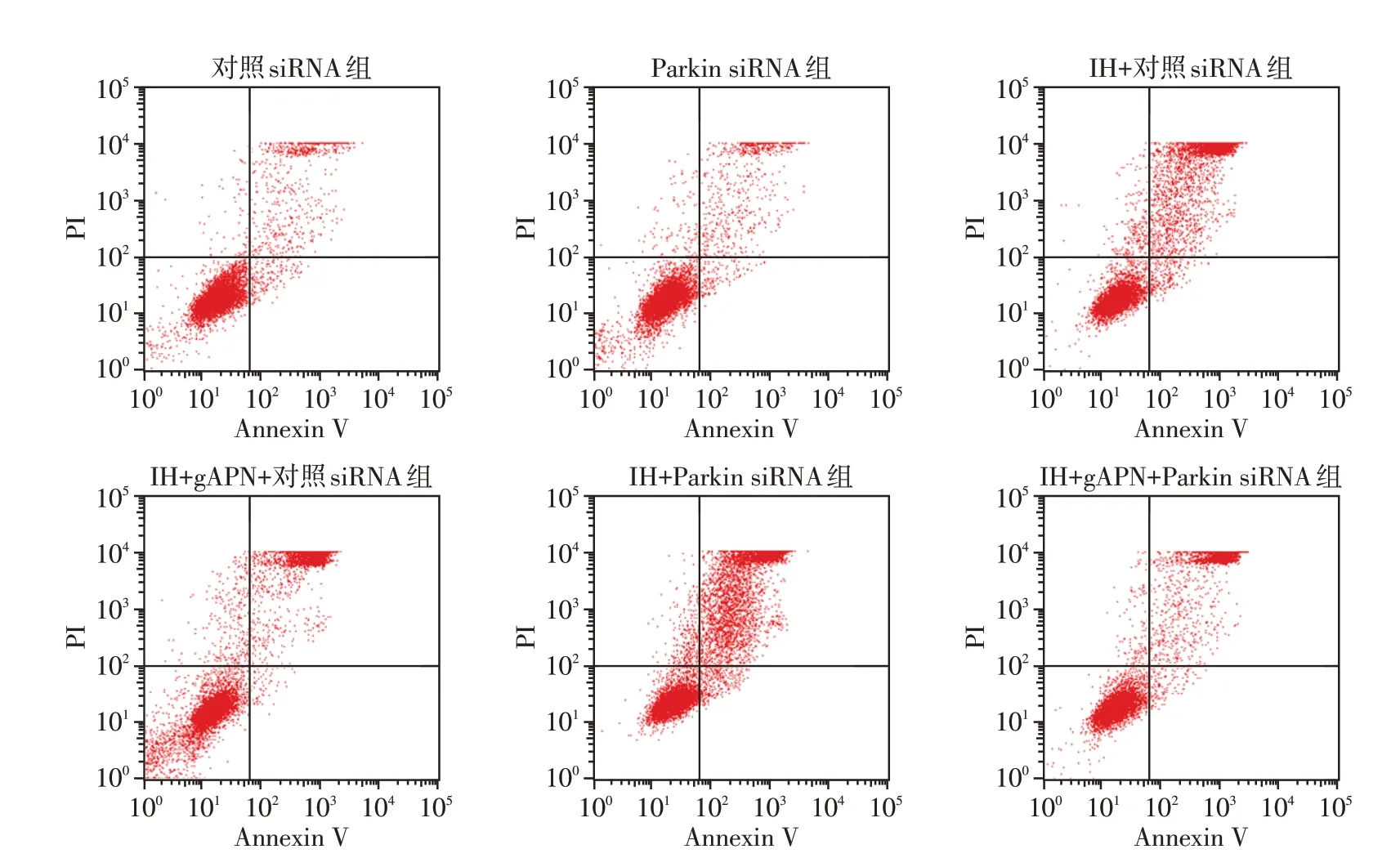
图5 抑制Parkin表达后各组H9C2细胞凋亡率Figure 5 H9C2 cell apoptosis in each group after inhibiting Parkin gene expression
2.6 Parkin siRNA转染抑制Parkin表达,增加H9C2细胞线粒体损伤
如图6所示,与对照siRNA组及Parkin siRNA组相比,IH+对照siRNA组MMP及Bcl⁃2蛋白表达水平下降,Bax 蛋白表达水平升高;与IH+对照siRNA 组相比,IH+gAPN+对照siRNA组MMP及Bcl⁃2蛋白表达水平升高,Bax 蛋白表达水平下降;与IH+对照siRNA 组相比,IH+Parkin siRNA 组MMP 及Bcl⁃2 蛋白表达水平下降,Bax 蛋白表达水平升高;与IH+gAPN+对照siRNA 组相比,IH+gAPN+Parkin siRNA组MMP及Bcl⁃2蛋白表达水平下降,Bax蛋白表达水平升高;差异均具有统计学意义(P<0.05,n=3)。对照siRNA组和Parkin siRNA组上述指标差异无统计学意义(P>0.05,n=3)。
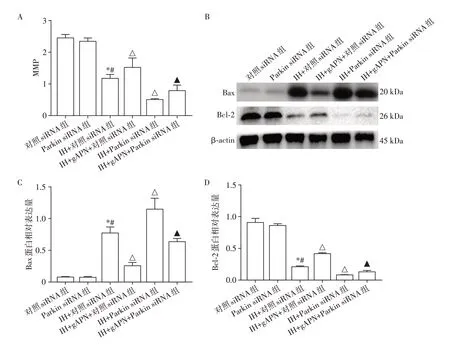
图6 抑制Parkin表达后各组H9C2细胞线粒体损伤Figure 6 Mitochondrial injury of H9C2 cells in each group after inhibiting Parkin gene expression
3 讨论
本研究发现IH可导致H9C2心肌细胞线粒体损伤及细胞凋亡,而gAPN 可减轻IH 所致线粒体损伤及细胞凋亡。同时,Parkin 介导的线粒体自噬可被IH激活,而抑制Parkin介导的线粒体自噬显著增加线粒体损伤及细胞凋亡。gAPN 可通过进一步上调Parkin 介导的线粒体自噬,减轻IH 所致H9C2 心肌损伤。
近年来心血管疾病的死亡率占总死亡率的31%,较前明显升高,而OSAHS 是心血管疾病常见的被忽视的危险因素。持续未治疗的OSAHS 会导致心肌损伤、心功能障碍,甚至心衰[11]。研究发现IH可导致心肌损伤[12]。本研究也证实IH导致H9C2心肌细胞凋亡。
线粒体是细胞内重要的细胞器,通过氧化磷酸化产生能量。当细胞受到外界刺激,可损伤线粒体结构及功能。为了维持细胞存活,线粒体相关多个信号通路被激活,包括线粒体自噬、线粒体融合与分裂及线粒体相关凋亡通路[13]。本研究发现IH 可导致线粒体损伤(MMP下降、Bcl⁃2蛋白表达水平下降及Bax蛋白表达水平升高)。
线粒体自噬通过降解损伤的线粒体及过多的线粒体,对维持细胞稳态起到至关重要的作用[13]。Parkin 通路是线粒体自噬重要的调控因子,当线粒体受到损伤时,Parkin被招募至损伤的线粒体上,进而激活线粒体自噬,降解损伤线粒体,维持细胞稳态[13]。刁佳宇等[14]发现Parkin介导的线粒体自噬可减轻高糖处理的H9C2 心肌氧化应激损伤、细胞凋亡及细胞肥大等。Gao等[15]发现Parkin 介导的线粒体自噬可减轻年龄所致的心肌细胞凋亡及细胞衰老。Abudureyimu等[16]发现小檗碱可通过上调Par⁃kin 介导的线粒体自噬减轻主动脉弓缩窄术诱导的心肌细胞凋亡及心功能不全。上述研究均提示Parkin 介导的线粒体自噬起保护作用。如前所述,过度的线粒体自噬会导致细胞凋亡,有损伤作用。Luo等[17]发现抑制Parkin 介导的线粒体自噬可减轻缺血再灌注所致H9C2 心肌细胞凋亡。Ren等[6]发现抑制线粒体自噬可减轻过氧化氢所致C2C12 细胞凋亡。而线粒体自噬在IH 处理的H9C2 心肌细胞中的作用暂不清楚。本研究发现IH 可激活Parkin 介导的线粒体自噬,而抑制Parkin介导的线粒体自噬显著增加IH 所致心肌细胞凋亡,提示Parkin 介导的线粒体自噬在IH 所致心肌损伤中起到保护作用。
gAPN 是具有多种保护作用的细胞因子。Kim等[18]发现gAPN可通过上调自噬减轻对乙酰氨基酚所致肝损伤。Zhu等[19]发现gAPN 可减轻心肌缺血再灌注损伤,提示gAPN 具有心肌保护作用。前期研究发现gAPN可上调线粒体自噬减轻IH所致大鼠颏舌肌损伤[20]。与前期研究一致,本研究发现gAPN 可减轻IH 所致H9C2 心肌细胞线粒体损伤及细胞凋亡。同时发现与IH相比,gAPN可进一步上调Parkin介导的线粒体自噬。然而,当Parkin siRNA抑制Parkin 表达后,gAPN 诱导的线粒体自噬被抑制,线粒体损伤及细胞凋亡明显增加,提示gAPN 通过上调Parkin介导的内质网自噬减轻IH所致H9C2心肌细胞损伤。然而,Ren等[6]发现全长脂联素通过抑制Pink1/Parkin 介导的线粒体自噬减轻过氧化氢所致C2C12 细胞损伤,这与本研究不同。多项研究发现全长脂联素和gAPN 具有不同甚至相反的作用。Bang等[21]发现全长脂联素具有抗黑色素形成作用,而Kim等[22]发现gAPN 具有促进黑色素形成作用。Burkus等[23]发现全长脂联素而非gAPN 可促进小鼠囊胚细胞葡萄糖摄取。因此推测不同形态的脂联素及不同的实验条件可能是本研究与Ren等[6]研究不同的主要原因。本研究提示上调Parkin介导的线粒体自噬是gAPN 减轻IH 所致H9C2 心肌细胞损伤的机制。
综上所述,本研究发现Parkin 介导的线粒体自噬在IH 诱导的H9C2 心肌损伤中起保护作用。gAPN通过上调Parkin介导的线粒体自噬减轻IH所致H9C2心肌细胞线粒体损伤及细胞凋亡。本研究有一定的局限性,IH细胞模型不能完全模拟OSAHS在体模型。因此未来将进行体内实验,进一步研究线粒体自噬的作用及相关机制,探索gAPN 减轻IH所致心肌损伤的机制,为gAPN 治疗OSAHS 提供一定的理论基础。

