利用CRISPR/Cas9技术构建ACE2基因修饰的猪胎儿成纤维细胞系
张成霖,方斌,刘晓蕊,李琳,王盈,杨海元,戴一凡
南京医科大学江苏省异种移植重点实验室,江苏 南京 211166
自2019 年12 月以来,新型冠状病毒即严重急性呼吸综合征冠状病毒2 型(severe acute respirato⁃ry syndrome coronavirus type 2,SARS⁃CoV⁃2)已经蔓延到多个国家和地区,引发了严重的全球公共卫生安全问题[1-2]。SARS⁃CoV⁃2 是一种新型β冠状病毒[3],具有高度传染性、较高隐蔽性和广泛组织趋向性等特征。SARS⁃CoV⁃2 为单股正链RNA 病毒,基因组约为29.9 kb,主要由2个侧翼非翻译区和整段可编码蛋白的开放阅读框(open reading frame,ORF)组成[4]。SARS⁃CoV⁃2 编码的S 蛋白是介导病毒入侵宿主细胞的关键蛋白,由S1 和S2 两个亚基组成。S1 亚基上的受体结合域能与靶细胞上的受体特异性结合,从而决定病毒对细胞的趋向性和致病性[5]。
已有研究表明血管紧张素转换酶2(angiotensin converting enzyme 2,ACE2)是SARS⁃CoV⁃2的主要功能受体[6],ACE2 的表达是SARS⁃CoV⁃2 感染靶器官的关键。不同物种的ACE2与SARS⁃CoV⁃2的S蛋白亲和力表现出差异性,决定了相应物种对SARS⁃CoV⁃2 病毒易感性的不同。如鸡、大鼠、兔等对SARS⁃CoV⁃2病毒不易感,而人、水貂、猫等对SARS⁃CoV⁃2 病毒易感。猪作为重要的农业品种之一,与人类关系密切,存在着作为中间宿主间接向人类传播SARS⁃CoV⁃2 的风险[7]。因此,通过改造猪的ACE2 来构建SARS⁃CoV⁃2 不易感猪模型有重要现实意义。ACE2 是由X 染色体基因编码的锌⁃金属肽酶,属于Ⅰ型跨膜糖蛋白,含有N 端信号肽、C 端结构域和胞外催化结构域[8]。ACE2 除了作为SARS⁃CoV⁃2 主要的功能受体,本身还行使促进血管紧张素成熟、调控血管收缩和血压等重要生理功能[9]。因此,构建SARS⁃CoV⁃2 不易感的猪不能通过直接敲除猪的ACE2 基因来实现,而应采取策略将猪内源ACE2 替换为与S 蛋白低亲和力的ACE2。
本研究通过对多个物种的ACE2蛋白序列进行生物信息学分析,构建了与SARS⁃CoV⁃2 低亲和力的嵌合ACE2基因片段。然后,利用CRISRP/Cas9基因编辑技术将该ACE2 整合到猪的ACE2 基因位点,同时实现猪内源ACE2 基因敲除和嵌合ACE2基因敲入,构建了ACE2 基因修饰的猪胎儿成纤维细胞(porcine fetal fibroblast,PFF)系,为进一步利用体细胞核移植(somatic cell nuclear transfer,SCNT)技术构建SARS⁃CoV⁃2 不易感的猪模型奠定了基础。
1 材料和方法
1.1 材料
1.1.1 实验细胞
培养27 d的长白猪PFF细胞为本实验室留存的细胞。
1.1.2 主要试剂与仪器
pX330质粒(Addgene公司,美国);DH5α感受态细胞、质粒抽提试剂盒(北京天根生化科技有限公司);BbsⅠ限制性内切酶、T4DNA连接酶和T7E1酶(New England Biolabs 公司,美国);Basic Nucleofec⁃torTMKits 转染试剂盒(Lonza 公司,德国);DMEM 培养液、G418药物、胎牛血清、0.25%胰蛋白酶、青链霉素双抗和DPBS 缓冲液(赛默飞世尔科技公司,美国)。单孔细胞核转染仪(Lonza 公司,德国);生物安全柜(赛默飞世尔科技公司,美国)。引物序列和磷酸化的寡核苷酸序列(南京金斯瑞公司)。
1.2 方法
1.2.1 ACE2嵌合基因的设计
利用DNAstar软件中的Protean模块分析猪和大鼠ACE2蛋白的二级结构,使用Chou Fasman算法预测猪和大鼠ACE2 蛋白α螺旋、β折叠、β转角的比例。使用Swiss Model 在线(https://www.swissmodel.ex pasy.org/)对猪和大鼠ACE2蛋白进行三维建模,然后利用Pymol软件比较两者三维结构的相似度,得出均方根偏差(root mean square deviation,RMSD)值。
在NCBI 数据库中下载大鼠和鸡的ACE2 氨基酸序列,在DNAMAN 中进行氨基酸序列比对,根据氨基酸序列的比对结果在大鼠ACE2氨基酸序列的基础上,将与SARS⁃CoV⁃2 结合的几个关键氨基酸残基替换为相应位点鸡ACE2 的氨基酸残基,并通过密码子优化获得ACE2 嵌合基因的基因序列,交由南京金斯瑞生物技术有限公司合成。
1.2.2 靶向猪ACE2的打靶载体构建
根据NCBI数据库中的ACE2基因序列,选取第10外显子设计1对扩增引物,上游引物ACE2_F:5′⁃CCAGTATGACATGGCTTATGCCAT⁃3′,下游引物ACE2_R:5′⁃CCCCAACTGCCTCATGGAAAC⁃3′,以长白猪PFF 细胞的基因组为模板进行PCR 扩增测序,确定是否与数据库中的ACE2 基因序列一致。使用在线工具CRISPOR(http://crispor.tefor.net/)设计sgRNA,合成相应的2 条Oligo 片段:5′⁃GCATT⁃AGCTCCATTTCTGAGC⁃3′和5′⁃GCTCAGAAATG⁃GAGCTAATGC⁃3′。利用BbsⅠ酶切pX330 质粒,酶切产物进行1%的琼脂糖凝胶电泳(100 V、60 min),切胶回收后纯化。用去离子水将sgRNA Oligo稀释至100 μmol/L。设置PCR 仪退火程序:37 ℃30 min,95 ℃5 min,再以5 ℃/min 的速度降至25 ℃。将线性化的pX330载体与退火产物用T4DNA连接酶进行连接,连接产物转化DH5α感受态细胞,涂板挑取单菌落测序鉴定正确的重组子,获得pX330_ACE2载体。
1.2.3T7E1酶切实验
将转染ACE2打靶载体后的细胞转移到6 cm培养皿中培养,待细胞长满后,消化提取基因组。PCR扩增并回收目的片段。T7E1 酶切体系:纯化产物200 ng;10×NEB Buffer 2 2 μL;去离子水补至19 μL。在PCR 仪中进行退火:95 ℃5 min;-2 ℃/s 降至85 ℃;-0.1 ℃/s 降至25 ℃;4 ℃保存。体系中加入1 μLT7E1酶,37 ℃孵育90 min。之后每管加入4 μL的6×Loading buffer,1%琼脂糖凝胶电泳,1 h后分析结果。根据公式InDel(%)=100×[1-(1-裂解产物占比)1/2],计算编辑效率。
1.2.4 ACE2嵌合基因敲入载体构建
在长白猪ACE2第10外显子上的敲除位点上下游各选取40 bp 序列作为同源的左臂(LA)和右臂(RA),中间加入连接肽(GSG Linker)以及2A 肽序列,在两同源臂外侧设计相同且反向的sf_sgRNA靶点序列(5′⁃GTGCTTCGATATCGATCGTTTGG⁃3′),合成得到pUC57_ARM⁃2A 载体。利用引物In⁃Fu⁃sion_F:5′⁃GAGAACCCTGGACCTATGTCAAGCTCC⁃TGCTGGC⁃3′,In⁃Fusion_R:5′⁃ATTAGCTCCATTT⁃CTCGCGCCGCACACAAA⁃3′,通过In⁃fusion 克隆将ACE2嵌合基因插入到经Esp3Ⅰ线性化pUC57_ARM⁃2A载体上,构建ACE2嵌合基因敲入的供体ACE2_KI。
合成2条Oligo片段(sf_sgRNA⁃F:5′⁃GTGCTTC⁃GATATCGATCGTT⁃3′和sf_sgRNA⁃R:5′⁃AACGATC⁃GATATCGAAGCAC⁃3′),退火后与线性化的pX330载体进行连接构建ACE2 嵌合基因敲入载体pX330_sf。
1.2.5 细胞转染与单克隆细胞的筛选与鉴定
将生长27 d 的原代长白公猪PFF 细胞复苏在6 cm培养皿中,细胞量约为2.6×106个。使用含16%FBS的全培养基(42 mL DMEM 培养液、8 mL FBS和500 μL 青链霉素双抗),在38.5 ℃、5%CO2的条件下培养约24 h,至细胞融合度>90%。用0.05%胰酶消化约2 min,1 200 r/min 离心收集细胞。将ACE2嵌合基因敲入载体ACE2_KI和两个打靶载体pX330_ACE2、pX330_sf以及抗性质粒pHY54_SV40⁃neo按照Lonza核转染试剂盒说明书建议比例配置,并进行细胞转染,程序为U⁃023。转染结束后,将细胞分盘至10 cm 培养皿中,细胞培养24 h后,用1 mg/mL的G418筛选9~12 d,挑单细胞克隆于24孔板中,待细胞长满后,消化至12 孔板中培养。留部分细胞在24 孔板中继续培养,长满后消化并用NP40裂解细胞,提取细胞基因组DNA[10-11]。使用在线工具Cas⁃OFFinder(http://www.rgenome.net/cas⁃of⁃finder/)寻找潜在的脱靶位点并设计引物。对基因组DNA进行PCR测序鉴定,将基因型鉴定正确且未发生脱靶效应的细胞克隆进行冻存。
2 结果
2.1 猪/大鼠ACE2结构的比较
对猪和SARS⁃CoV⁃2 不易感动物大鼠的ACE2结构进行比较[12],利用DNAstar 软件中的Protean 模块分析猪和大鼠ACE2 的二级结构,并使用Chou⁃Fasman算法预测猪和大鼠ACE2的α螺旋、β折叠、β转角的比例。猪ACE2 的α螺旋占41.2%,β折叠占24.7%,β转角占27.8%(图1A);大鼠ACE2 的α螺旋占40.4%,β折叠占27.5%,β转角占28.8%(图1B),显示猪和大鼠ACE2 蛋白具有高度相似的二级结构。使用Swiss Model在线工具对猪和大鼠ACE2进行三维建模,接着利用Pymol软件比较两者三维结构的相似度,得出RMSD值为0.052,表明两者在三维结构上亦具有极高的相似性(图1C),因此可以推测猪和大鼠ACE2在相应组织或器官内应具有相似的生理功能,使用大鼠ACE2替换猪ACE2具有可行性。
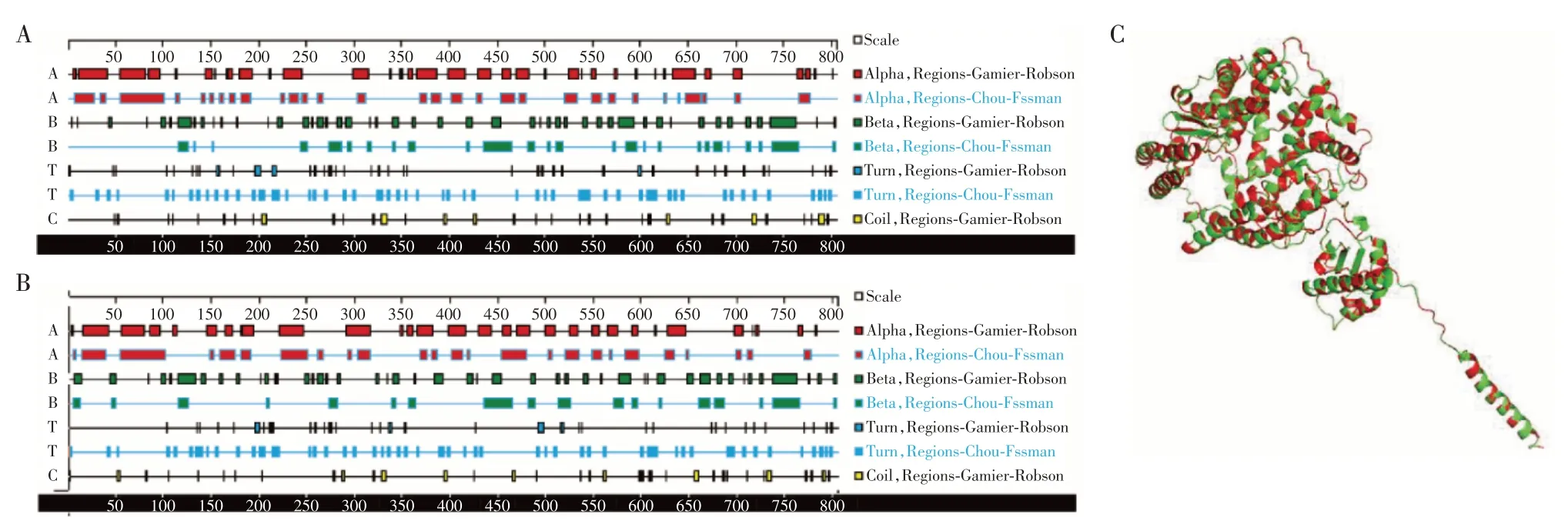
图1 猪/大鼠ACE2蛋白质二级结构和三级结构分析Figure 1 Analysis of secondary and three⁃dimensional structures of ACE2 protein between pigs and rats
2.2 ACE2嵌合基因的合成及猪/嵌合ACE2结构的比较
随着病毒在人群和自然界中的不断复制,新的变异也随之出现,新变异株的产生可能会增加大鼠感染SARS⁃CoV⁃2 的风险。因此,本研究在大鼠ACE2 的基础上构建大鼠/鸡ACE2 嵌合基因作为敲入基因。首先,根据大鼠和鸡的ACE2 的氨基酸序列比对结果(图2A),将ACE2 与S 蛋白结合的关键氨基酸位点(第19、31、34、35、42、353、354位氨基酸残基)替换为鸡的氨基酸残基。
对嵌合ACE2进行三维建模,并与猪ACE2的三维结构进行比对(图2B),得出RMSD 值为0.054,表明改造后的嵌合ACE2 结构并未发生较大变化,与猪的ACE2 仍具有极高的相似性,可以使用该嵌合的ACE2来替换猪的ACE2。

图2 嵌合ACE2氨基酸序列的比对(A)和三级结构的分析(B)Figure 2 Comparison of chimeric ACE2 amino acid sequences(A)and analysis of tertiary structures(B)
2.3 载体的构建及靶位点编辑效率检测
依据测序确认的长白猪ACE2 第10 外显子序列,利用在线工具设计sgRNA(图3A)。利用BbsⅠ酶将pX330载体线性化(图3B),并与sgRNA退火形成的双链连接,最后将连接产物进行转化,挑取单菌落并送测序,测序结果表明pX330 载体上成功插入了猪ACE 基因靶点的sgRNA 序列。以转染打靶载体pX330_ACE2后的细胞基因组为模板进行PCR扩增,将PCR 产物退火,再经过T7E1 酶切,琼脂糖凝胶电泳结果显示目的片段被切成两段(图3C)。公式计算得出编辑效率为12.02%。
利用Esp3Ⅰ酶线性化pUC57_ARM⁃2A载体,同时根据设计的In⁃Fusion 引物扩增ACE2 嵌合基因,通过无缝克隆技术将ACE2嵌合基因插入敲入载体中,构建ACE2 嵌合基因敲入载体(图3D),使用In⁃Fusion 引物对敲入载体进行测序验证,测序结果显示ACE2嵌合基因敲入载体ACE2_KI构建成功。此外将两臂外侧的sgRNA 与线性化的pX330 载体连接,将连接产物进行测序验证,测序结果表明打靶载体pX330_sf构建成功(图3E)。
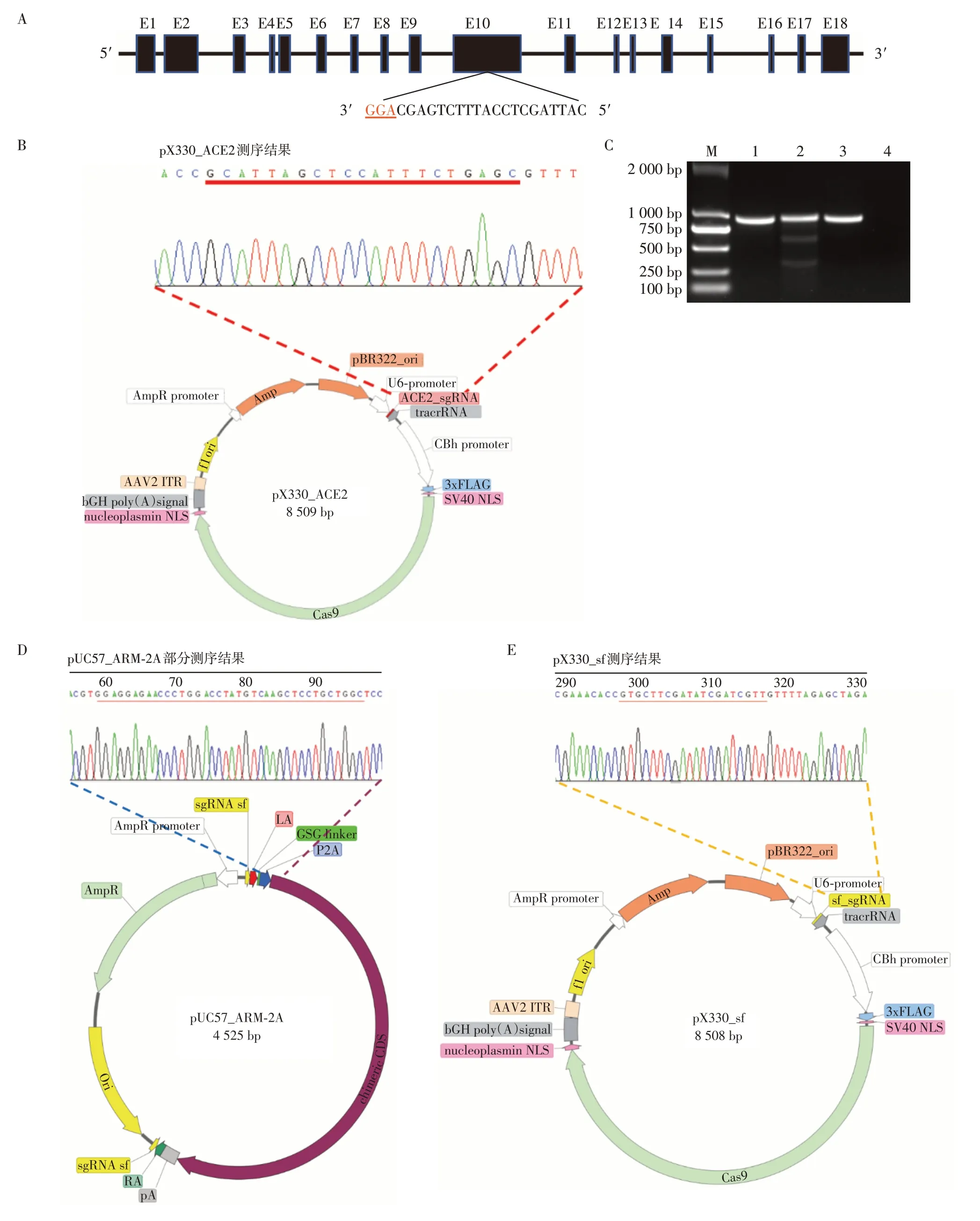
图3 载体的构建和剪切效率验证Figure 3 Construction of the vector and verification of shearing efficiency
2.4 长白猪PFF细胞系ACE2基因靶向编辑过程
将ACE2嵌合基因敲入载体ACE2 KI_pUC57和两个打靶载体pX330_ACE2、pX330_sf 以及抗性质粒pHY54 SV40⁃neo转染长白猪PFF细胞后,Cas9蛋白会在sf_sgRNA 和ACE2_sgRNA 的引导下分别对ACE2 嵌合基因敲入载体ACE2 KI_pUC57(图4)和猪的ACE2 基因第10 外显子进行剪切,通过同源定向修复机制将含有同源臂的线性ACE2嵌合基因整合到猪ACE2基因内部,从而导致猪的ACE2基因被破坏,而嵌合ACE2 基因在P2A 短肽自我剪切作用下,可以获得完整的嵌合ACE2蛋白。
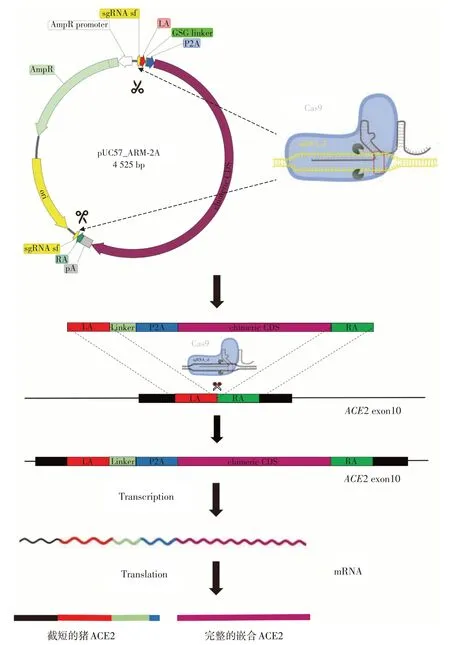
图4 嵌合ACE2基因的敲入编辑策略Figure 4 Schematic of chimeric ACE2 knock⁃in strategy
2.5 ACE2编辑的细胞克隆鉴定
经G418 筛选后共获得19 个单细胞克隆,测序结果显示有4 个单细胞克隆的ACE2 基因成功被ACE2 嵌合基因所替换(表1,图5A),敲入效率达21%。对在线工具Cas⁃OFFinder寻找到的10个潜在脱靶位点进行测序验证,测序结果显示所有潜在位点并未发生脱靶效应(图5B)。
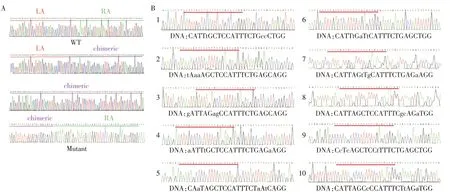
图5 嵌合ACE2敲入的细胞克隆测序分析Figure 5 Sequencing of chimeric ACE2 knock⁃in cell colonies
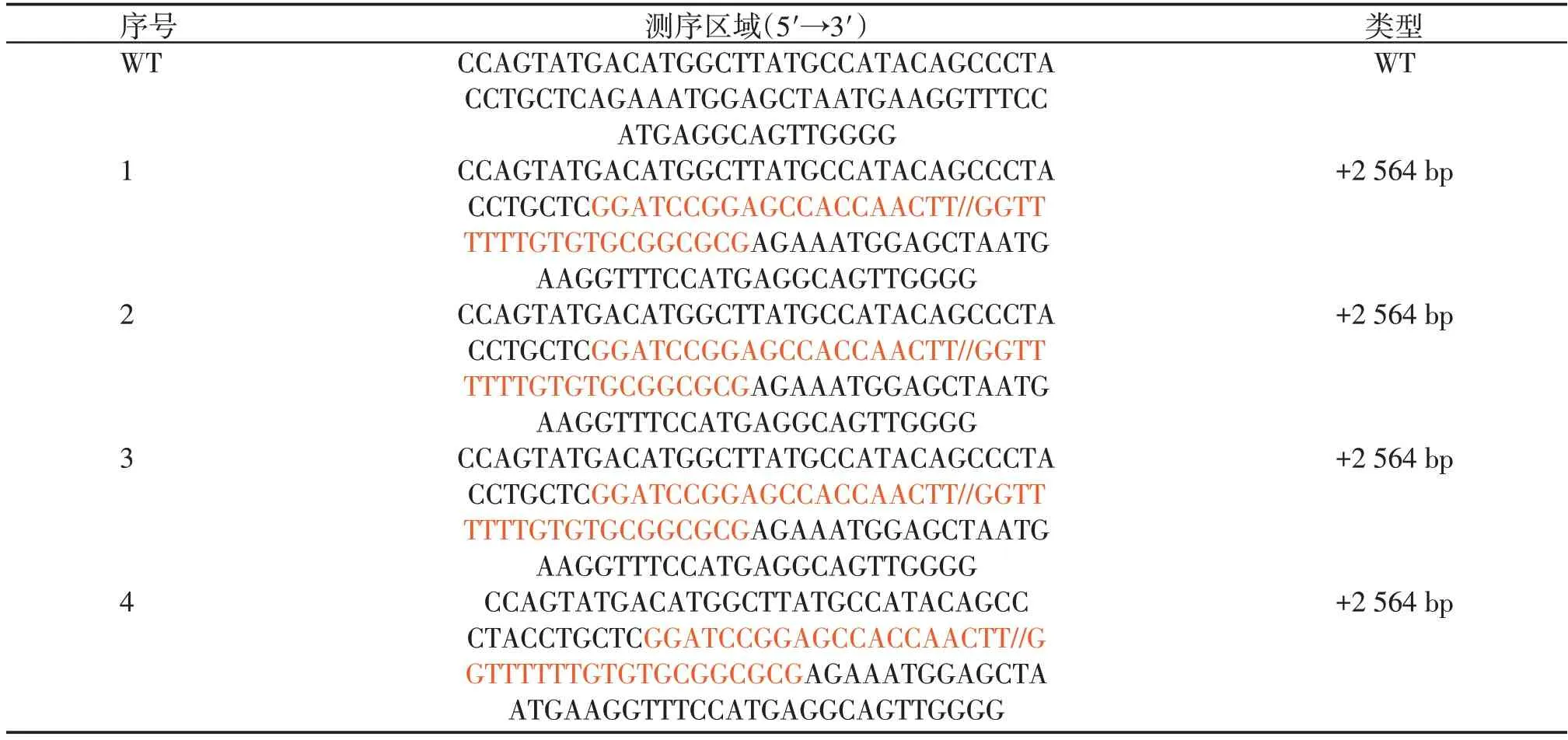
表1 嵌合ACE2敲入的长白猪PFF的基因型Table 1 Gene type of chimeric ACE2 knock⁃in cell colonies of PFF
3 讨论
CRISPR/Cas9基因编辑技术在猪遗传修饰研究中的应用,极大推动了抗病猪品种的培育[13-14]。如猪繁殖与呼吸综合征(porcine reproductive and respi⁃ratory syndrome,PRRS)又称“蓝耳病”,是造成全世界养猪产业经济损失最严重的猪传染病之一,该病的病原是猪繁殖与呼吸综合征病毒(porcine reproduc⁃tivc and respiratory syndrome virus,PRRSV)。经研究发现CD163蛋白是PRRSV 感染宿主的必需受体[15],2014年,Whitworth等[16]成功制备了CD163双等位基因敲除猪,该基因编辑猪在进行攻毒试验后未表现出蓝耳病的临床症状。该研究表明病毒受体基因编辑后能显著提高猪的抗病能力。因此,对猪进行基因编辑以降低其对SARS⁃CoV⁃2的易感性是一种可行策略。
ACE2 是SARS⁃CoV⁃2 的主要功能受体,ACE2还参与调节血压、体液平衡和细胞增殖等过程,具有重要的生理功能。ACE2基因缺失会引起动物的生理功能异常甚至死亡[17]。目前尚未出现SARS⁃CoV⁃2 感染大鼠的报道,但随着病毒在人群和自然界中的不断复制,产生的新变异毒株存在感染大鼠的风险。但SARS⁃CoV⁃2 作为一种β属冠状病毒能够感染包括人类、家畜在内的哺乳动物,却无法感染鸟类。因此,本研究采取了一种新的策略来进行猪ACE2 基因的改造。在SARS⁃CoV⁃2 不易感的大鼠ACE2 基因的基础上,将与S 蛋白RBD 区域直接接触的关键氨基酸序列进一步替换为β冠状病毒不易感的鸡ACE2 序列[18],构建大鼠/鸡嵌合ACE2 基因,利用CRISPR/Cas9基因编辑技术将嵌合ACE2基因整合到猪ACE2基因的第10号外显子上。利用猪内源的ACE2 基因启动子和2A 肽序列来表达嵌合的ACE2基因,同时实现了猪内源ACE2基因的敲除和嵌合ACE2基因的敲入。
本研究利用短同源臂(40 bp)来构建ACE2基因敲入供体,转染后获得19 个抗性的猪PFF 细胞克隆,其中4 个为阳性单细胞克隆(即嵌合的ACE2 基因整合到猪内源的ACE2位点),基因敲入效率高达21%。以上结果显示,短同源臂的供体简化了载体构建过程,而且不会降低基因敲入效率。
由于ACE2 基因在猪的PFF 细胞中不表达,本研究没有对ACE2 编辑的PFF 细胞克隆进行ACE2的表达检测和功能验证。本研究设计的嵌合ACE2 是否能在猪体内发挥正常的生理功能和降低猪对SARS⁃CoV⁃2 的易感性,还需要通过体细胞核移植获得ACE2 编辑的克隆猪后,开展实验来进行研究探讨。
综上,本研究首次在猪PFF细胞中利用CRISPR/Cas9 技术实现了外源ACE2 基因的定点整合,成功建立了ACE2 基因编辑的长白猪PFF 细胞系,为SARS⁃CoV⁃2 不易感猪模型的构建提供了重要的实验材料。

