血浆外泌体通过微小RNA⁃25⁃3p对心肌纤维化影响的初步研究
顾寰宇,李姗姗,王芹,姜敏,王春
南京大学医学院附属鼓楼医院老年科,江苏 南京 210008
心肌纤维化几乎是所有慢性心血管疾病进展到心力衰竭的重要病理状态,伴纤维化疾病已占所有疾病死亡率的45%[1]。临床尚无有效药物治愈纤维化,除了心脏磁共振,在临床也无有效安全的诊断标志物[2]。心肌纤维化是在致病因素如炎症、高血压长期作用下,心脏成纤维细胞增殖并向肌成纤维细胞表型转化,特征性高表达α⁃平滑肌肌动蛋白(α⁃smooth muscle actin,α⁃SMA)[3]。肌成纤维细胞有更强的增殖和分泌胶原的能力,使得胶原浓度高于正常水平,最终导致细胞外基质异常积聚,影响心脏的正常结构和功能[4]。心肌细胞外基质含量常被用于评估心肌纤维化程度,其胶原成分主要由Ⅰ型和Ⅲ型胶原构成[5]。心肌纤维化的发生机制复杂且未明确,病理过程有众多细胞因子参与,如血管紧张素Ⅱ(angiotensin Ⅱ,Ang Ⅱ)、转化生长因子β、血小板源性生长因子等[6]。炎症因子、肾素⁃血管紧张素⁃醛固酮系统、氧化应激等因素经由相同或不同的信号转导通路如WNT/β⁃catenin、MAPK/ERK参与心肌纤维化的发生发展[7]。
随着近些年研究的逐渐深入,外泌体被发现广泛参与心血管系统的病理生理过程[8]。外泌体(exo⁃some)是一种由各种细胞分泌的直径30~150 nm 呈圆形小碟状的脂质双层囊泡,广泛存在于血液、尿液、唾液、乳汁等各种体液中。主要由蛋白质和脂质构成,包括融合蛋白、热休克蛋白、CD蛋白(CD9、CD63、CD81)及丰富的脂质[9]。外泌体可携带有功能活性的内容物,如蛋白质、核酸(DNA、mRNA、microRNA、lncRNA)、脂质等来进行细胞间的信息传递,这种分子信号交换在生理和病理过程中都有重要作用[10]。研究表明小鼠胚胎干细胞来源的外泌体有支持心肌细胞存活和抗心肌纤维化的作用[11]。人脐带间充质干细胞来源的外泌体可减轻大鼠心脏左前降支结扎引起的心肌纤维化[12]。所以外泌体可能在心肌纤维化的发生发展中扮演了重要角色。
外泌体包裹的生物活性成分微小RNA(microRNA,miRNA)在多种疾病中表达异常,被认为是一种有前途的标志物或治疗靶点[13]。miRNA是一类由20~23个核苷酸组成的单链非编码小分子RNA,它通过碱基互补配对和mRNA 3′端非翻译区结合,抑制靶基因表达和下游蛋白合成[14]。研究报道miRNA与众多心脏疾病相关,在心衰患者血浆中有多种miRNA表达异常[15]。微小RNA⁃25⁃3p(microRNA⁃25⁃3p,miR⁃92b⁃5p)在扩张性心肌病引起的急性心衰患者血清外泌体中上调[16]。
miR⁃25⁃3p 是人染色体7q22.1 基因簇的成员之一,目前对其研究主要集中在肿瘤领域,它参与多种恶性肿瘤的发生发展。研究表明miR⁃25⁃3p有促进心肌纤维化的作用[17]。目前尚无miR⁃25⁃3p在血浆外泌体中的相关研究。本研究旨在初步探索miR⁃25⁃3p在健康小鼠和心肌纤维化小鼠血浆外泌体中含量的区别,并明确其与心肌纤维化的关系,为将来探索心肌纤维化的治疗靶点和诊断标志物提供新思路。
1 材料和方法
1.1 材料
动物:SPF 级健康雄性C57BL/6 小鼠20只,8 周龄,体重25~30 g,由杭州医学院提供[动物证许可号:SCXK(浙)2019⁃0059]。自由饮食,喂养全价营养颗粒饲料。
主要试剂:ExoQucik exosome precipitation solu⁃tion、Exosome RNA Purification Column kit(SBI公司,美国);水合氯醛(上海生工生物);Ⅱ型胶原酶、胰酶、Ang Ⅱ、α⁃SMA⁃Cy3 抗体(Sigma 公司,美国);马血清(BI 公司,以色列);DMEM、胎牛血清(fetal bo⁃vine serum,FBS)(Gibco公司,美国);双抗、细胞裂解液、PMSF、BSA、kFluor488 Click⁃iTEdU kit(南京凯基生物);miRNA 模拟物/抑制物、miRNA 引物(广州锐博生物);Lipofectamine2000(Invitrogen公司,美国);Trizol、焦碳酸二己酯(diethyl pyrocarbonate,DEPC)水、miRNA Universal SYBR qPCR Master Mix(南京诺唯赞生物);SYBR®GREEN、5× Prime Script RT Master Mix、BCA Protein Assay Kit(TaKaRa 公司,日本);抗体(CD63、CD9、α⁃SMA、GAPDH)(武汉Ab⁃clonal公司);ECL(上海Tanon公司)。
主要仪器:qPCR 仪、酶标仪(Thermo Fisher 公司,美国);透射电子显微镜(JEM⁃200CX,JEOL 公司,日本);Zetaview 粒子跟踪分析仪(Particle Metrix公司,德国);荧光显微镜(Leica 公司,德国);West⁃ern blot 电泳仪、转膜仪、曝光成像系统(Bio⁃Rad 公司,美国);NanoPhotometer(IMPLEN公司,德国)。
1.2 方法
1.2.1 小鼠心肌梗死模型构建及取样
小鼠称重,5%水合氯醛麻醉,仰卧位固定,四肢皮下连接心电图电极。颈左侧胸前区脱毛并消毒,气管切开插管,连接呼吸机。切开皮肤,分离肌肉,在小鼠第四肋间进入胸腔;打开心包膜,在冠状动脉左前降支根部,用6⁃0 缝合线结扎;对照组行假手术,打开胸腔,不行血管结扎。冠脉结扎成功后逐层关胸,缝合皮肤,消毒,脱离呼吸机观察小鼠呼吸,稳定后拔除气管插管,置于电热毯上,等待苏醒。术后常规饲养3周,麻醉,行眼眶采血,血浆混合后行外泌体相关后续实验。本研究已通过南京鼓楼医院实验动物伦理委员会审查(批准号2021AE01061)。
1.2.2 血浆外泌体提取(SBI试剂盒提取法)
根据ExoQucik exosome precipitation solution 说明书步骤操作:将血浆样本与1/2体积的凝血活素D充分混合;去除沉淀,留存上清,将上清与Exoquick试剂按体积4∶1混合均匀,室温放置30 min,1 500g离心30 min,见管底有沉淀;去除上清,1 500g离心5 min后去除上层液体组分;沉淀用1/10原始体积的PBS重悬即得实验所需外泌体。
1.2.3 外泌体RNA提取(SBI试剂盒提取法)
根据Exosome RNA Purification Column kit 说明书步骤操作:外泌体沉淀加入350 μL Lysis buffer,震荡15 s,静置5 min;加入200 μL Ethnaol 震荡10 s后移入离心柱,13 000 r/min离心1 min;去除液体,离心柱放回收集管后加入400 μL洗涤液,13 000 r/min离心1 min,重复1次该步骤;去除液体,13 000 r/min离心2 min以干燥;去除收集管,换成干净无酶1.5 mL离心管,加入30 μL 洗脱液于离心柱,2 000 r/min 离心2 min;13 000 r/min离心1 min,收集外泌体RNA。
1.2.4 透射电镜及纳米颗粒跟踪分析鉴定外泌体
外泌体溶液置于铜网上,用2%醋酸双氧铀染色1 min,再置于灯下烤10 min 后用电镜观察拍照。Zetaview粒子跟踪分析仪测量纯化的外泌体的浓度和粒径分布。
1.2.5 新生小鼠心脏成纤维细胞分离及培养
高温灭菌器械和玻璃器皿,配置组织消化液(Ⅱ型胶原酶40 mg+胰酶60 mg 加入PBS 定容至100 mL),0.22 μm 滤膜过滤后待用。75%乙醇消毒新生3 d 内小鼠胸腹部皮肤,开胸取出心脏,在PBS中漂净后移至安瓿瓶内剪碎成匀浆状;碎组织移至200 mL玻璃瓶,加入30 mL消化液,37 ℃110 r/min摇床15 min,加入马血清终止消化;收集悬液1 000 r/min离心5 min;弃上清,沉淀加入成纤维细胞培养液(DMEM+10%FBS+1%双抗)重悬,多次重复以上步骤至组织消化成白色絮状物。收集所有细胞悬液铺至10 cm 细胞培养皿中,置于37 ℃、5%CO2细胞培养箱2 h 行差速贴壁后吸去培养液,贴壁细胞即心脏成纤维细胞,加入新鲜细胞培养液后置于细胞培养箱用于后续实验。
1.2.6 心脏成纤维细胞纤维化模型建立及细胞转染
在避光、无血清条件下,200 nmol/L AngⅡ处理细胞48 h以构建细胞纤维化模型。miRNA模拟物和抑制物的转染浓度分别为100 nmol/L和200 nmol/L,配置转染体系(以1 mL 为例,5 μL 模拟物或10 μL 抑制物+200 μL DMEM+4 μL Lipo2000)吹打混匀;将以上转染体系加入800 μL 无血清培养液中,加入细胞培养板后放入细胞培养箱中培养,8 h 后换液1次,48 h后收取细胞。
1.2.7 细胞RNA提取及qPCR检测
吸去培养液,PBS洗净,Trizol充分裂解细胞;加入Trizol 体积20%的氯仿震荡15 s,静置5 min;4 ℃12 000 r/min离心15 min;上层相转移至另一无RNA酶离心管中,加入等体积异丙醇;4 ℃12 000 r/min离心10 min,去上清后加入1 mL 75%乙醇;4 ℃12 000 r/min离心10 min,弃上层乙醇后干燥10 min;加30 μL DEPC 水溶解沉淀。NanoPhotometer 仪器测定RNA浓度及纯度,参照试剂盒说明书行逆转录及qPCR。制备mRNA 的qPCR 体系后置于定量PCR仪中,设定程序:95 ℃,3 min预变性;95 ℃15 s,60 ℃30 s,72 ℃30 s,共40 个循环,用18 S 做内参。制备miRNA 的qPCR 体系置于定量PCR 仪中,设定程序:95 ℃20 s预变性;95 ℃10 s,60 ℃20 s,72 ℃10 s,共40 个循环,用5 S 做内参。引物序列见表1。
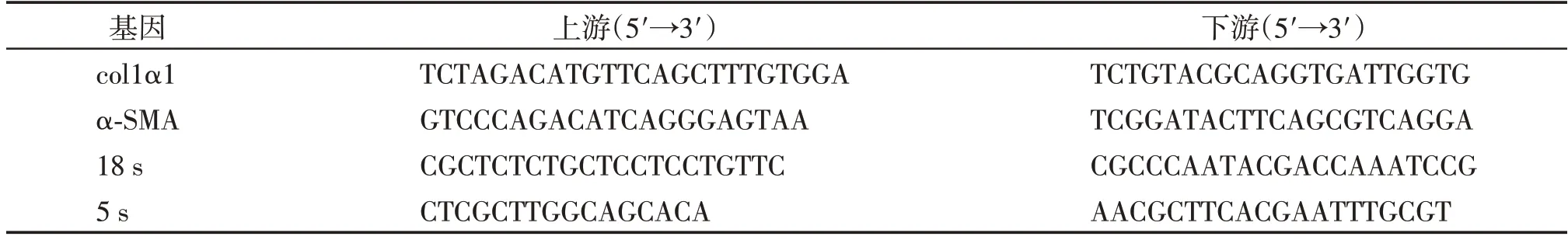
表1 qPCR引物序列Table 1 Primer sequences for qPCR
1.2.8 细胞蛋白提取及蛋白免疫印迹法
吸去细胞培养基,PBS 清洗,加入细胞裂解液(以100 μL 为例,100 μL 细胞裂解液+1 μL PMSF),刮板刮取细胞转移至1.5 mL 离心管,冰上静置30 min;4 ℃12 000 r/min 离心15 min,上清即蛋白溶液;BCA法测定蛋白浓度;蛋白溶液加入1/4体积的含β⁃巯基乙醇的5×Loading buffer 混匀,100 ℃煮蛋白10 min,冷却后备用。配置分离胶和浓缩胶,将相同质量的蛋白样本加入上样孔中,100 V电泳1.5~2 h;PVDF 膜浸于甲醇活化15 s,300 mA恒流转膜,根据蛋白分子量大小设定转膜时间;5% BSA 室温封闭2 h;一抗(α⁃SMA、GAPDH、CD63、CD9)4℃孵育过夜后用TBST 洗3遍,每次15 min;室温孵育二抗2 h后用TBST 洗3遍,每次15 min;滴加ECL 发光液于膜上置于成像系统中曝光,用Image J 软件行条带灰度分析。
1.2.9 细胞免疫荧光染色
吸去细胞培养基,PBS 清洗,4%PFA 固定细胞20 min,PBS 洗3遍,每次5 min;0.1%TritonX⁃100 破膜20 min,PBS洗3遍,每次5 min;5%BSA室温封闭2 h;吸去BSA,加α⁃SMA⁃Cy3抗体室温孵育2 h(全程避光,该抗体是一抗二抗联合抗体);PBS洗3遍,每次5 min。荧光显微镜下观察拍照。用α⁃SMA 荧光强度指示成纤维细胞的分化程度。
1.2.10 EdU荧光染色
根据kFluor488 Click⁃iTEdU kit 说明书步骤操作(全程避光):实验终点前2 h,加50 μmol/L EdUA液至细胞培养液中,使EdU 插入正在复制的DNA中。配置反应液(Apollo 反应缓冲液+催化剂溶液+荧光染料溶液+缓冲添加剂);细胞孔加入反应液,室温30 min 后吸去,PBS 洗3遍,每次5 min;加入DAPI 反应液染细胞核,室温30 min 后吸去,PBS 洗3遍,每次5 min。用Edu+细胞数/DAPI+细胞数的比例指示细胞增殖率。
1.3 统计学方法
使用SPSS 20.0 统计软件,数据以均数±标准差()表示。两组之间比较用独立样本t检验,两组以上比较用单因素方差分析,方差齐时用Bonferroni分析,不齐时用Dunnett’sT3分析。P<0.05为差异有统计学意义。
2 结果
2.1 小鼠血浆外泌体鉴定
小鼠行心梗手术构建心脏纤维化模型,分别提取假手术对照组和心梗手术心肌纤维化模型组小鼠的血浆外泌体,在电镜下观察到两组均可见圆形双层囊泡(图1A)。粒子跟踪分析仪检测两组外泌体的颗粒浓度均为1.2×107个/mL,平均粒径均为100 nm(图1B),符合外泌体分布特征。Western blot结果显示所提外泌体明显表达外泌体的标志蛋白CD63和CD9(图1C)。
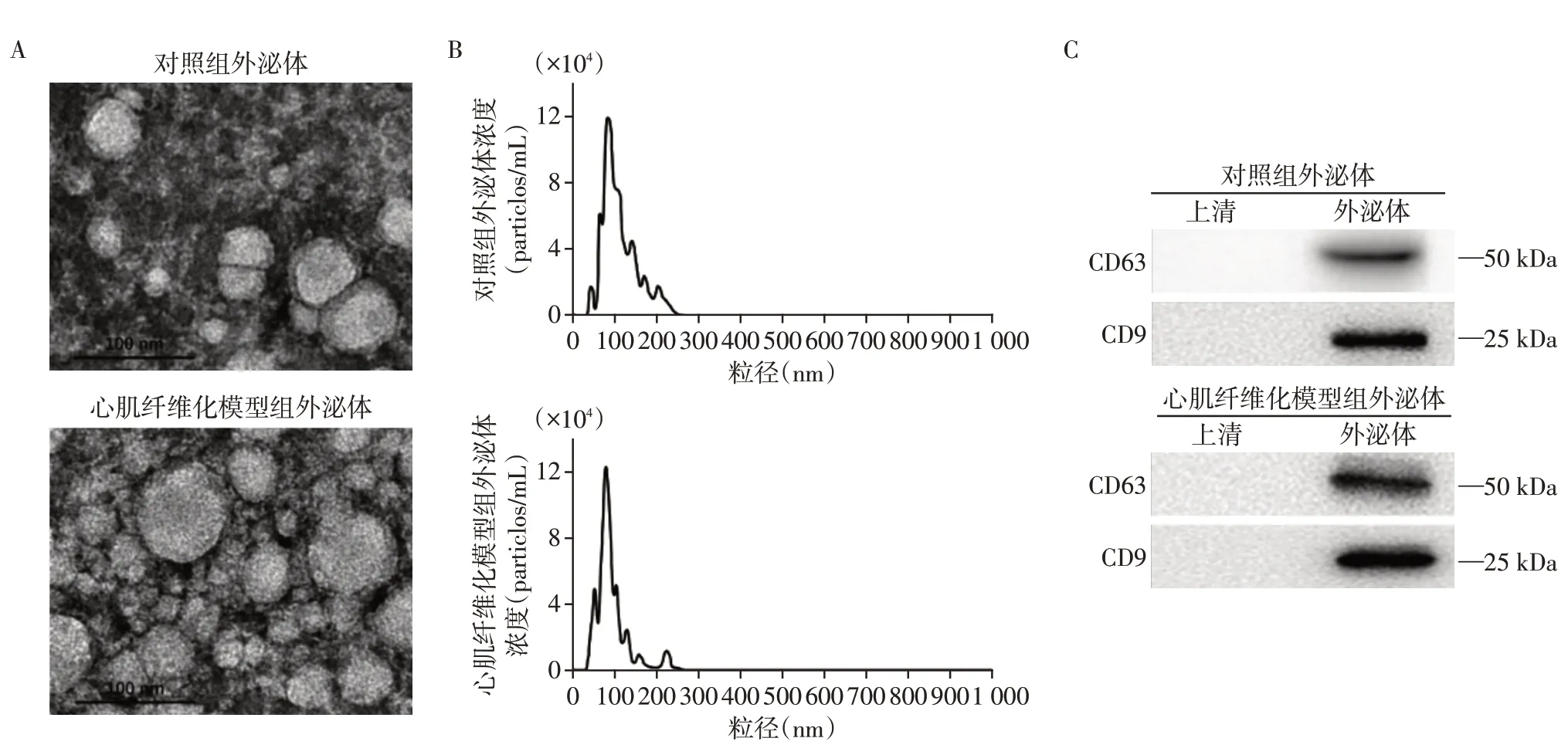
图1 小鼠血浆外泌体鉴定Figure 1 Characterization of mouse plasma exosome
2.2 血浆外泌体对心脏成纤维细胞纤维化水平的影响
Ang Ⅱ刺激原代小鼠心脏成纤维细胞在体外构建细胞纤维化模型,通过qPCR 和Western blot 分别检测细胞两个具有代表性的促纤维化相关指标的水平(图2),结果显示:Ang Ⅱ刺激后,细胞的α⁃SMA和Ⅰ型胶原α1(collagen type Ⅰalpha 1,col1α1)水平均明显升高;添加对照组的血浆外泌体可以逆转细胞的纤维化水平,但心肌纤维化模型组的血浆外泌体却失去这一作用。这提示两组血浆外泌体的成分有所不同,心肌纤维化模型组的外泌体内可能有更多促纤维化的成分或更少的抗纤维化成分。
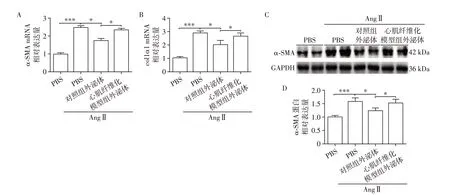
图2 血浆外泌体对心脏成纤维细胞纤维化水平的影响Figure 2 Effects of plasma exosome on cardiac fibrosis
2.3 正常小鼠和心肌纤维化模型小鼠的血浆外泌体内miR⁃25⁃3p的表达差异
检测正常小鼠和心肌纤维化模型小鼠的血浆外泌体内miR⁃25⁃3p的水平(图3)。结果显示:心肌纤维化模型组血浆外泌体内的miR⁃25⁃3p含量明显高于对照组。这提示心肌纤维化模型组血浆外泌体失去抗心肌纤维化的能力,可能是miR⁃25⁃3p 含量增加介导的。
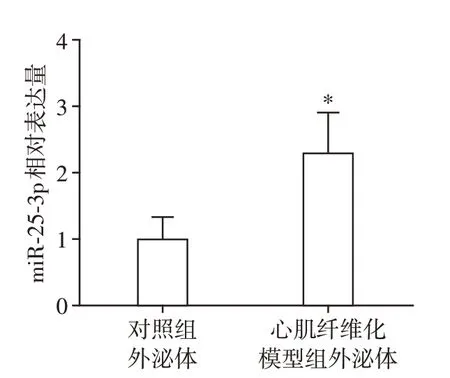
图3 两组小鼠血浆外泌体内miR⁃25⁃3p的表达差异Figure 3 Verification of miR⁃25⁃3p in plasma exosome of mice between two groups
2.4 miR⁃25⁃3p过表达对小鼠心脏成纤维细胞纤维化水平的影响
在细胞水平明确miR⁃25⁃3p对心肌纤维化的影响,qPCR验证miR⁃25⁃3p模拟物有效上调miR⁃25⁃3p的表达量近1 500倍(图4A)。miR⁃25⁃3p模拟物在基础水平增加心脏成纤维细胞α⁃SMA 的蛋白表达水平,但在Ang Ⅱ刺激情况下却不能进一步增加其表达(图4B、C)。细胞免疫荧光染色结果显示:miR⁃25⁃3p模拟物在基础水平可促进心脏成纤维细胞向肌成纤维细胞表型转化,但对细胞的增殖水平无影响;Ang Ⅱ处理后,细胞的增殖和分化水平均增加,但miR⁃25⁃3p模拟物却不会进一步促进细胞的这两种能力(图4D~F)。
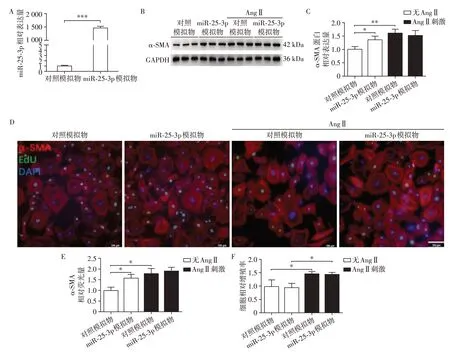
图4 miR⁃25⁃3p模拟物对心脏成纤维细胞纤维化水平的影响Figure 4 Effects of miR⁃25⁃3p mimic on cardiac fibrosis
2.5 miR⁃25⁃3p敲低对小鼠心脏成纤维细胞纤维化水平的影响
qPCR 验证miR⁃25⁃3p 抑制物可有效下调miR⁃25⁃3p 的表达量(图5A)。miR⁃25⁃3p 抑制物分别在基础水平和Ang Ⅱ刺激情况下减少心脏成纤维细胞α⁃SMA 的蛋白表达量(图5B、C)。细胞免疫荧光染色结果显示:在基础水平和Ang Ⅱ刺激情况下,miR⁃25⁃3p抑制物均可阻碍心脏成纤维细胞向肌成纤维细胞表型转化,但不影响细胞的增殖能力(图5D~F)。以上结果表明血浆外泌体中的miR⁃25⁃3p可发挥促进心脏成纤维细胞向肌成纤维细胞表型转化的作用。
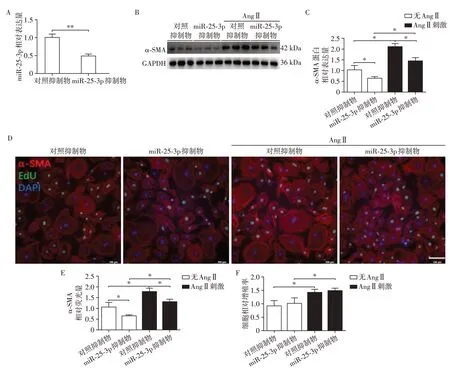
图5 miR⁃25⁃3p抑制物对心脏成纤维细胞纤维化水平的影响Figure 5 Effect of miR⁃25⁃3p inhibitor on cardiac fibrosis
3 讨论
心肌纤维化是由多种病理因素导致心脏疾病发展至一定阶段所共有的病理改变,是心室重构以及心功能失代偿的重要病理基础之一。防治心肌纤维化对很多心血管疾病都至关重要,但临床尚无有效药物治愈心肌纤维化,这不但严重影响患者生活质量,还增加国家医疗保障系统的负担[18]。因此探索新的有效干预心肌纤维化的靶点或有效诊断标志物是亟待解决的重要问题。
心肌纤维化发生时的主要事件有成纤维细胞增殖、向肌成纤维细胞分化、细胞外基质异常积聚,心肌细胞外基质含量多少常被用于评估心肌纤维化程度。目前临床针对心肌纤维化的药物主要有RAAS阻滞剂、β受体阻滞剂、抗炎药物、血管紧张素受体⁃脑啡肽酶双重抑制剂LCZ696、心脏起搏电流抑制剂伊伐布雷定等[2]。但这些药物只能改善疾病症状,不能阻断疾病进程,心脏结构和功能依旧发生不可逆损害。
在心血管系统,外泌体能在心肌细胞、心脏成纤维细胞、血管内皮细胞之间传递分子信号来参与心肌细胞存活、心肌纤维化、心室重构、血管新生等过程[19]。这些作用使外泌体成为心肌纤维化防治的潜在新靶点。血液中的外泌体浓度较高,它们在不同细胞和组织之间扮演信息传递者的角色。人和大鼠的血浆外泌体在体内体外实验中都有心脏保护作用[20],而血浆外泌体是否能够抑制心肌纤维化及其作用机制鲜有报道。心肌纤维化是一个复杂的过程,例如Ⅰ型胶原纤维较粗,抗牵拉功能较强,维持心室壁强度;Ⅲ型胶原纤维则较细,有良好伸展性,影响心肌和血管顺应性,它们在纤维化的不同阶段会有不同的表达量,在纤维化的不同阶段发挥不同作用[21]。同样地,本课题提取的外泌体是基于慢性心肌梗死模型,区别于急性心肌梗死,需进一步在不同时间点提取血浆外泌体,分别检测以明确外泌体内容物的含量是否有时间依赖性。
本研究利用Ang Ⅱ刺激心脏成纤维细胞建立细胞纤维化模型,细胞α⁃SMA 和col1α1 的mRNA 表达量均升高,提示建模成功。提取的外泌体的形态、直径分布及标志物表达均符合外泌体的特征。发现对照组小鼠血浆外泌体有改善心肌纤维化的作用,而心肌纤维化模型组小鼠的血浆外泌体则没有,这说明两者外泌体的内含物种类或含量有差异。外泌体内容物的成分复杂,其中miRNA有高稳定性和靶向性[22]。本课题只研究了miR⁃25⁃3p的作用,其在外泌体内对心肌纤维化的影响是否扮演了关键作用还需进一步探索。本研究发现miR⁃25⁃3p模拟物在基础水平上调成纤维细胞α⁃SMA 的蛋白表达水平,但α⁃SMA表达水平在Ang Ⅱ刺激情况下却不能进一步增加,这可能是因为该刺激已经使细胞达到了纤维化的上限,其他处理不能再继续上调纤维化水平。本课题目前只初步研究了血浆外泌体内miR⁃25⁃3p 对心肌纤维化的作用,后续需在体内外继续表型和机制研究以验证实验结果。
综上所述,血浆外泌体可改善心肌纤维化,血浆外泌体内的miR⁃25⁃3p上调可促进心肌纤维化发生,提示该指标可能是心肌纤维化潜在的生物标志物,这将为探索心肌纤维化的潜在治疗靶点提供新思路。
——外泌体与老年慢性疾病相关性的研究进展

