LncRNA XIST靶向miR-132-3p影响人宫颈癌细胞株Hela增殖、侵袭和迁移*
鲍 慧 孙晓东 乔 健 贺 晶
宫颈癌是原发于子宫颈部的恶性肿瘤。全球范围内,宫颈癌年龄标准化发病率为13.1/10万,年龄标准化死亡率为6.9/10万,严重影响妇女健康[1]。目前宫颈癌治疗手段包含靶向药物治疗以及以手术为主并辅以放、化疗的治疗,虽然具有一定疗效,但存在很大局限性以及毒副作用,而基因治疗已成为当今肿瘤治疗研究的热点[2]。长链非编码核糖核酸(LncRNA)和微小RNA(miRNA)在肿瘤的发生发展中发挥重要作用。XIST是具有广泛生物学作用的LncRNA,参与结直肠癌、乳头状甲状腺癌等多种肿瘤细胞的增殖、侵袭和迁移过程[3,4]; miR-132-3p在套细胞淋巴瘤等多种肿瘤细胞的增殖、侵袭和迁移过程也发挥重要功能[5];已有研究报道XIST可促进宫颈癌的发生和发展[6]。然而miR-132-3p在宫颈癌中发挥的功能未知。有研究发现XIST可靶向miR-132-3p调控结直肠癌发生发展[7],但XIST能否通过靶向miR-132-3p调控宫颈癌细胞增殖、侵袭和迁移尚未可知。有研究发现miR-132-3p可通过靶向性别决定因子同源盒4(SOX4)调控肝癌细胞增殖、凋亡、迁移和侵袭[8];且已有报道指出SOX4可通过调控上皮-间质转化(EMT)调节宫颈癌细胞增殖、侵袭和迁移[9]。LncRNA XIST能否通过靶向miR-132-3p调控宫颈癌细胞增殖、侵袭和迁移未知。鉴于此,本研究选取人宫颈癌细胞株Hela进行体外细胞实验,探究XIST对调控宫颈癌细胞增殖、侵袭和迁移的作用及其机制。
1 材料与方法
1.1 实验材料
1.1.1 细胞和试剂:人宫颈癌细胞株Hela(购自欧洲标准细胞收藏中心,批号EC-0101);脂质体(Lipofectamine 2000)转染试剂盒(购自美国英杰生命技术有限公司,生产批号11668-019);干扰-XIST(si-XIST,合成序列:5’-AAA GCU AAG AUA AAU GGA AGA-3’)质粒、干扰-对照(si-NC,合成序列:5’-UGC CCA GGA AGU UAC CUU AAG-3’)质粒、过表达-XIST(pcDNA3.1-XIST,合成序列:正义链5’-AAC CAA AUC AAA GAU GUC CGG-3’,反义链5’-CAA GUA AGG UUC CGG CAU UCU-3’)质粒、pcDNA3.1-XIST对照(pcDNA3.1-control,合成序列:正义链5’-AGC AGG UGC GGG UUA GAA GGU-3’,反义链5’-UAA ACC AAG CGU AUC UGU CCA-3’)质粒、野生型和突变型XIST报告基因质粒(野生型pGLO-XIST和突变型pGLO-XIST)、野生型和突变型SOX4报告基因质粒(野生型pGLO-SOX4和突变型pGLO-SOX4)(由百奥迈科生物技术有限公司合成);甲基噻唑蓝(MTT)溶液(购自北京索莱宝科技有限公司,生产批号M1025);侵袭小室(Transwell,孔径5μm)、基质胶(购自美国康宁公司,生产批号3422、354277);结晶紫染色液(购自上海复申生物科技有限公司,生产批号FS0466);总RNA提取试剂(购自北京雷根生物技术有限公司,生产批号NR0002);XIST、miR-132-3p、SOX4、细胞增殖抗原标记物(Ki-67)、细胞周期蛋白D1(CyclinD1)、E-钙黏蛋白(E-cadherin)、波形蛋白(Vimentin)、基质金属蛋白酶2(MMP-2)、U6、β-肌动蛋白(β-actin)聚合酶链反应(PCR)引物(由重庆威斯腾生物医药科技有限公司合成);鼠抗人SOX4、Ki-67、CyclinD1、E-cadherin、Vimentin、MMP-2、β-actin单克隆抗体(一抗),兔抗鼠SOX4、Ki-67、CyclinD1、E-cadherin、Vimentin、MMP-2、β-actin辣根过氧化物酶标记多克隆抗体(二抗)(购自北京冬歌博业生物科技有限公司,生产批号H00006659-A01、NBP2-22112、2926P、ab228022、ab8978、12015-01、BM3501-01;PAB14638、BS1454、BS2436、C1817、3932S、BS1236、LS-C212187);双荧光素酶报告基因检测试剂盒(购自上海李记生物科技有限公司,生产批号AC19L022)。
1.1.2 仪器:AE31型荧光显微镜(购自麦克奥迪实业集团有限公司);Gemini EM型酶标仪[购自美谷分子仪器(上海)有限公司];IX83型倒置显微镜(购自日本奥林巴斯);M402118型核酸蛋白检测仪(购自北京海富达科技有限公司);7500型PCR仪(购自美国ABI)。
1.2 方法
1.2.1 细胞培养:将人宫颈癌细胞株Hela接种至含有10%胎牛血清、100U/ml青霉素和100mg/ml链霉素的杜氏培养液(DMEM)中,于37℃、5%CO2条件下培养。
1.2.2 转染和分组:待细胞生长至对数期时接种至24孔板培养,当细胞融合度达到85%时,参照Lipofectamine 2000说明书分别将si-XIST、si-NC、pcDNA3.1-XIST、pcDNA3.1-control质粒转染至人宫颈癌细胞株Hela,分别记为XIST下调组、下调对照组、XIST上调组、上调对照组,转染成功细胞呈绿色荧光。XIST下调组、下调对照组、XIST上调组、上调对照组转染效率分别为(89.64±16.92)%、(84.07±15.14)%、(80.14±14.08)%、(83.79±15.78)%。见图1。另取未处理人宫颈癌细胞株Hela,记为空白组。每组设6个复孔。

图1 各组细胞转染效率(荧光显微镜,×100,刻度尺:100μm)
1.2.3 MTT法检测细胞增殖活性:转染48h后,收集各组细胞,调整细胞密度为5×103个/ml,接种至96孔板(100μl/孔),37℃、5%CO2培养48h,加入MTT溶液(20μl/孔),混匀避光孵育4h,弃上清,加二甲基亚砜(150μl/孔),混匀后置于酶标仪检测波长490nm处光密度值。各组细胞增殖抑制率=(空白组光密度值-实验组光密度值)/空白组光密度值×100.00%。
1.2.4 Transwell实验检测细胞侵袭、迁移能力:转染48h后收集各组细胞,胰酶消化,磷酸盐缓冲液洗涤,调整细胞密度为1×105个/ml,向预先用基质胶包被的Transwell小室上室加150μl细胞悬液,下室加含血清培养基,常规培养24h;磷酸盐缓冲液淋洗,小心擦去微孔膜内层细胞,乙醇固定5min,结晶紫染色,倒置显微镜计数穿膜细胞数,每组随机选取5个视野,取平均值。检测细胞迁移能力时,小室上室无需基质胶包被基底膜,其余步骤与细胞侵袭能力检测方法相同。
1.2.5 实时逆转录PCR(RT-qPCR)检测细胞XIST、miR-132-3p表达及SOX4、Ki-67、CyclinD1、E-cadherin、Vimentin、MMP-2 mRNA表达:转染48h后,参照总RNA提取试剂说明提取各组细胞总RNA,核酸蛋白检测仪测定RNA浓度,稀释RNA浓度为40μg/ml。逆转录为互补脱氧核糖核酸后用PCR仪进行PCR扩增。PCR反应条件:95℃变性5min,95℃ 30s、60℃ 30s、72℃ 30s,40个循环。引物序列见表1。采用2-△△Ct法[10]计算待测基因相对表达量。其中选取U6为miR-132-3p内参基因,β-actin为其余基因的内参基因。

表1 PCR引物序列
1.2.6 免疫印迹法(WB)检测细胞SOX4、Ki-67、CyclinD1、E-cadherin、Vimentin、MMP-2蛋白表达:转染48h后,收集各组细胞,加入细胞裂解液,获取各组细胞蛋白质。BCA法定量蛋白,蛋白样品以4∶1比例加入蛋白上样缓冲液,电泳,转膜,封闭,加入一抗(稀释倍数1∶1 000)4℃孵育,次日加入辣根过氧化物酶标记二抗(稀释倍数为1∶5 000),室温孵育1h,显色反应,分析各蛋白条带灰度值,以β-actin为内参照,目的蛋白条带灰度值与内参条带灰度值的比值即为该蛋白相对表达量。
1.2.7 LncRNA XIST靶向调控miR-132-3p验证:应用生物信息学软件StarBase V2.0(http://starbase.sysu.edu.cn/)预测LncRNA XIST的miRNA结合位点。分别将野生型XIST、突变型XIST与miR-132-3p mimic、miR-NC共转染至人宫颈癌细胞株Hela,严格按照试剂盒说明书应用双荧光素酶报告基因系统检测miR-132-3p mimic组和miR-NC组中XIST相对荧光强度,相对荧光强度=萤火虫荧光素酶荧光强度/海肾荧光素酶荧光强度。
1.3 统计学处理

2 结 果
2.1 各组细胞增殖抑制率比较
各组细胞增殖抑制率比较,差异有统计学意义(P<0.01)。与空白组、下调对照组和上调对照组比较,XIST下调组细胞增殖抑制率上升(t均>13.21,P<0.01),XIST上调组细胞增殖抑制率下降(t均>13.21,P<0.01);与XIST下调组比较,XIST上调组细胞增殖抑制率下降(t=18.96,P<0.01),空白组、下调对照组、上调对照组间细胞增殖抑制率差异无统计学意义(t均=0,P>0.05)。见表2。
表2 各组细胞增殖抑制率比较
2.2 各组细胞侵袭、迁移能力比较
各组细胞侵袭数目和迁移数目差异均有统计学意义(P<0.01)。与空白组、下调对照组和上调对照组比较,XIST下调组细胞侵袭和迁移数目均减少(t均>3.24,P<0.01),XIST上调组细胞侵袭和迁移数目增多(t均>3.07,P<0.05或P<0.01);与XIST下调组比较,XIST上调组细胞侵袭和迁移数目增多(t均>9.24,P<0.01),空白组、下调对照组、上调对照组间细胞侵袭数目和迁移数目差异无统计学意义(t均<0.86,P>0.05)。见图2、3和表3。
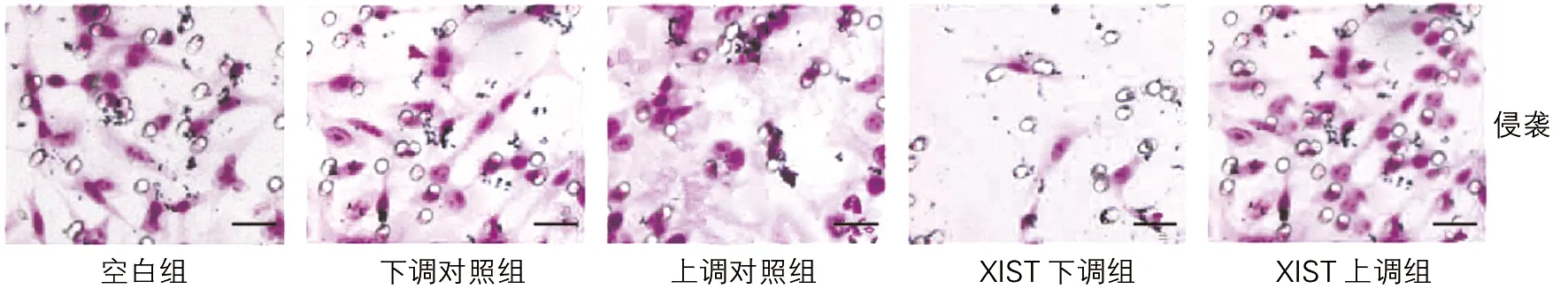
图2 各组细胞侵袭能力变化(结晶紫染色,×200,刻度尺:30μm)
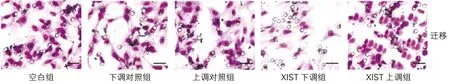
图3 各组细胞迁移能力变化(结晶紫染色,×200,刻度尺:30μm)
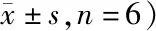
表3 各组细胞侵袭、迁移数目(个,
2.3 各组细胞XIST、miR-132-3p水平及SOX4、Ki-67、CyclinD1、E-cadherin、Vimentin、MMP-2 mRNA表达比较
各组细胞XIST、miR-132-3p表达及SOX4、Ki-67、CyclinD1、E-cadherin、Vimentin、MMP-2 mRNA表达差异均有统计学意义(P<0.01)。与空白组、下调对照组和上调对照组比较,XIST下调组细胞XIST表达及SOX4、Ki-67、CyclinD1、Vimentin、MMP-2 mRNA表达下降、miR-132-3p表达和E-cadherin mRNA表达升高,差异有统计学意义(t均>2.32,P<0.05或P<0.01),XIST上调组细胞XIST表达及SOX4、Ki-67、CyclinD1、Vimentin、MMP-2 mRNA表达升高、miR-132-3p表达和E-cadherin mRNA表达下降,差异有统计学意义(t均>2.02,P<0.05或P<0.01);与XIST下调组比较,XIST上调组细胞XIST表达及SOX4、Ki-67、CyclinD1、Vimentin、MMP-2 mRNA表达上升、miR-132-3p表达和E-cadherin mRNA表达下降,差异有统计学意义(t均>2.08,P<0.05或P<0.01)。空白组、下调对照组和上调对照组间各指标差异无统计学意义(t均<0.71,P>0.05)。见表4。
2.4 各组细胞SOX4、Ki-67、CyclinD1、E-cadherin、Vimentin、MMP-2蛋白表达比较
各组细胞SOX4、Ki-67、CyclinD1、E-cadherin、Vimentin、MMP-2蛋白表达差异均有统计学意义(P<0.01)。与空白组、下调对照组和上调对照组比较,XIST下调组细胞SOX4、Ki-67、CyclinD1、Vimentin、MMP-2蛋白表达下降、E-cadherin蛋白表达上升,差异有统计学意义(t均>5.46,P<0.01),XIST上调组细胞SOX4、Ki-67、CyclinD1、Vimentin、MMP-2蛋白表达上升、E-cadherin蛋白表达下降,差异有统计学意义(t均>7.64,P<0.01);与XIST下调组比较,XIST上调组细胞SOX4、Ki-67、CyclinD1、Vimentin、MMP-2蛋白表达上升、E-cadherin蛋白表达下降,差异有统计学意义(t均>10.20,P<0.01)。空白组、下调对照组和上调对照组各蛋白表达差异无统计学意义(t均<0.01,P>0.05)。见图4、表5。
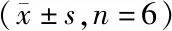
表4 各组细胞XIST、miR-132-3p表达及SOX4、Ki-67、CyclinD1、E-cadherin、Vimentin、MMP-2 mRNA表达
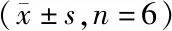
表5 各组细胞SOX4、Ki-67、CyclinD1、E-cadherin、Vimentin、MMP-2蛋白表达
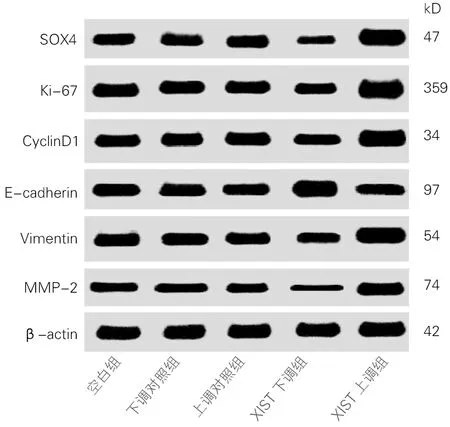
图4 各组细胞SOX4、Ki-67、CyclinD1、E-cadherin、Vimentin、MMP-2蛋白表达(WB)
2.5 LncRNA XIST靶向调控miR-132-3p
生物信息学软件StarBase预测XIST与miR-132-3p存在相似结合位点,见图5。在转染野生型XIST细胞中,miR-132-3p mimic组细胞相对荧光强度低于miR-NC组细胞(t=4.58,P<0.05);在转染突变型XIST细胞中,miR-132-3p mimic组细胞相对荧光强度与miR-NC组细胞差异无统计学意义(t=0.31,P>0.05),见图6。
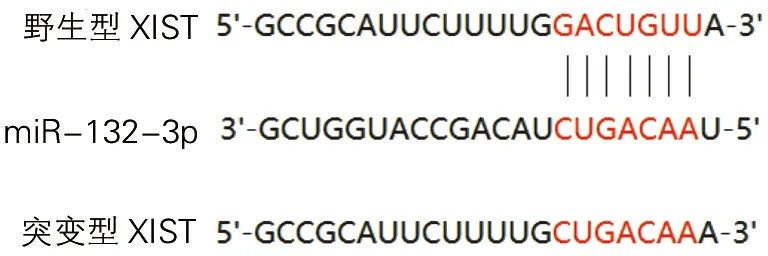
图5 XIST与miR-132-3p潜在结合位点

注:与野生型XISTmiR-NC组比较,*P<0.05
3 讨 论
本研究结果显示,与空白组、下调对照组和上调对照组比较,XIST下调组细胞增殖抑制率上升、细胞侵袭和迁移数目减少,XIST上调组细胞增殖抑制率下降、细胞侵袭和迁移数目增多。以上结果显示,XIST在宫颈癌细胞增殖、侵袭和迁移过程发挥促进作用,miR-132-3p在宫颈癌细胞增殖、侵袭和迁移过程发挥抑制作用。
本研究结果表明XIST过表达可增强人宫颈癌细胞株的增殖、侵袭与迁移能力,而低表达可降低其增殖、侵袭与迁移能力,表明调控LncRNA XIST可影响人宫颈癌细胞株的恶性生物学行为。EMT与肿瘤细胞的增殖、侵袭和迁移过程密切相关,有报道表明XIST可通过靶向miR-133a调控SOX4调节EMT过程从而调控胶质瘤细胞增殖和转移[11]。有研究指出miR-132-3p可直接靶向SOX4促进骨肉瘤细胞增殖[12]。LncRNA XIST参与恶性肿瘤细胞增殖、迁移及侵袭的作用途径包括影响细胞周期、调控MMP-2和MMP表达等。另有研究显示[13],LncRNA XIST表达与宫颈癌临床分期、分化程度、淋巴结转移、肌层浸润等均有关,且其高表达能够增加复发率、缩短无进展生存期和总生存期。由此可知LncRNA XIST可参与宫颈癌的发生与发展。据此推测,XIST和miR-132-3p可能通过靶向SOX4调控EMT过程从而调节宫颈癌的发生发展。本研究还显示,XIST过表达可促进SOX4、Ki-67、CyclinD1、Vimentin、MMP-2表达,抑制E-cadherin和miR-132-3p表达;miR-132-3p沉默表达可促进SOX4、Ki-67、CyclinD1、Vimentin、MMP-2表达,抑制E-cadherin表达。以往研究显示XIST在不同肿瘤中发挥不同调节功能,袁甫军等[14]指出XIST可抑制乳腺癌细胞的增殖和转移能力,发挥抑癌作用;周明龙等[15]发现抑制XIST 可抑制CyclinD1,抑制肝癌细胞增殖;徐倩等[16]研究发现抑制XIST表达,可抑制MMP-2表达,抑制宫颈癌细胞的侵袭和迁移能力,发挥促癌作用。
本研究还发现,双荧光素酶实验结果显示miR-132-3p mimic可抑制野生型XIST质粒转染细胞相对荧光强度,但对突变型XIST质粒转染细胞无影响,证明XIST可直接靶向调控miR-132-3p。miR-132-3p在不同肿瘤中也发挥不同调节功能,Wang 等[17]指出miR-132-3p在非小细胞肺癌中处于高表达状态,过表达miR-132-3p可促进非小细胞肺癌细胞增殖,发挥促癌作用;牛文惠等[18]指出miR-132-3p可通过靶向SOX4抑制EMT发生过程,调控E-cadherin和Vimentin表达,调节耐药细胞的增殖、侵袭和迁移能力;Zhao等[19]指出SOX4可调控 Ki-67、Cyclin D1、MMP-2表达,调节黑色素瘤的增殖与侵袭;He等[20]指出SOX4通过调控Ki-67、CyclinD1表达,提高急性髓性白血病细胞的增殖能力;Meng等[21]指出SOX4可调控E-cadherin和Vimentin表达,调节宫颈癌的肿瘤生长和转移。本研究结果与上述肝癌、黑色素瘤、急性髓性白血病研究结果相同,与乳腺癌、非小细胞肺研究结果相反,可能与XIST和miR-132-3p功能具有多向性,在不同肿瘤环境发挥不同功能相关。有研究发现XIST可直接靶向miR-132-3p加重急性肺损伤[22],同时也有研究指出了miR-132-3p对SOX4的靶向作用[23],本研究与两者研究结果一致,证实了XIST对miR-132-3p的直接靶向作用。
综上所述,XIST可能通过靶向调控miR-132-3p表达,促进SOX4、Ki-67、CyclinD1、Vimentin、MMP-2表达,抑制E-cadherin表达,发挥促癌作用。本研究首次发现在宫颈癌中miR-132-3p发挥抑癌功能以及XIST对miR-132-3p直接靶向作用,提示XIST可能是宫颈癌治疗的潜在靶点,有助于指导宫颈癌靶向治疗研究,具有创新性和重要意义,同时也有望减轻宫颈癌患者的痛苦、延长其生存期。
◀
本文第一作者简介:
鲍 慧(1982-),女,汉族,副主任医师,研究方向:妇科肿瘤