STRAP、Ki-67表达对乳腺癌新辅助化疗后肿瘤残余的评估价值
张伟强 王凤琴 姚文娟 吴冬梅 仝志超 张婉琳 于 婧
乳腺癌是致癌因子作用于乳腺上皮细胞,使其发生增殖失控进而恶变的一种病理变化[1]。即使近年来我国乳腺癌筛查率不断增加,但部分患者就诊时即为局部晚期乳腺癌,极难通过手术切除治疗[2],大多采取新辅助化疗。新辅助化疗通过抑制肿瘤细胞增殖、清除肿瘤细胞,从而缩小肿瘤体积,降低肿瘤分期、分级[3,4]。但新辅助化疗前后乳腺癌残余肿瘤组织的评估研究仍不明确,寻找有效的残余肿瘤组织标志物作为新辅助化疗疗效及评判预后的指标十分重要。
增殖指数Ki-67被作为是评价肿瘤细胞增殖力和侵袭力的重要指标,丝氨酸-苏氨酸激酶受体相关蛋白(STRAP)在肿瘤的发生、发展中具有多种作用[5],最新的研究[6]提示Ki-67及STRAP在胃癌、肺癌等术后评估具有重要提示作用,但在乳腺癌临床诊断和治疗中的价值仍有待进一步研究。故而,本研究尝试探讨STRAP、增殖指数Ki-67表达在乳腺癌新辅助化疗后残余肿瘤组织中的评估价值,以期为乳腺癌临床诊断和治疗提供可靠的参考依据,现报道如下。
1 资料与方法
1.1 研究对象和分组
选取2020-01-2021-05在本院就诊的乳腺癌患者100例(乳腺癌组),4-8个周期新辅助化疗后,根据Miller-Payne[7]病理评价系统,将乳腺癌组患者分为病理完全缓解组(qCR组)患者21例,非病理完全缓解组(qCR组)患者79例。纳入标准:(1)女性患者;(2)符合TNM分期中的ⅡB-Ⅲ期[8];(3)在本院接受新辅助化疗,且化疗后接受局部手术治疗;(4)患者及家属知情同意。排除标准:(1)合并有心、肝、肾等重要脏器疾病;(2)合并有其它系统恶性肿瘤;(3)非初治患者。
同时选取乳腺良性病变患者50例(乳腺良性病变组),包括乳腺纤维腺瘤23例,乳腺囊性增生21例,导管囊性扩张6例,纳入标准:(1)女性患者;(2)经病理学确诊;(3)在本院接受手术治疗;(4)患者及家属知情同意。排除标准:合并有心、肝等重要脏器疾病。
乳腺癌和乳腺良性病变患者临床一般资料比较见表1,组间各指标差异无统计学意义(P>0.05),具有可比性。本次研究获得医院伦理委员会批准(审批号KYLL-2020-018)。
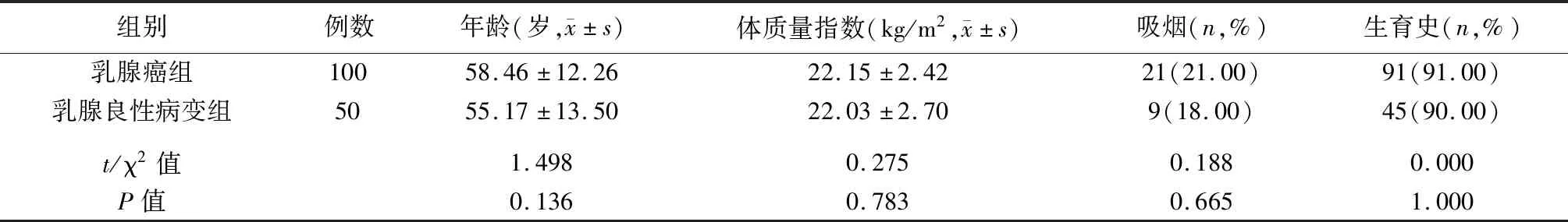
表1 乳腺癌和乳腺良性病变患者临床一般资料比较
1.2 治疗方法
所有乳腺通过前哨淋巴结活检或穿刺确定有无腋窝淋巴结转移。化疗方案均首选蒽环类和(或)紫杉醇为主的新辅助化疗,且至少完成4个周期。每2个化疗周期后行MRI检测评价治疗效果,根据文献标准确定是否化疗成功[9]。若临床评定为疾病进展(PD)或4个化疗周期后评定为疾病稳定(SD)则更换化疗方案。完成4-8周期化疗后根据具体情况制定手术方案。根据术后病理结果及疗效评价制定后续治疗方案(根据乳腺癌诊疗规范(2011年版))[10]。
1.3 检查方法
取化疗前肿瘤组织,常规处理后保存,以备免疫组化检测。
1.3.1 STRAP免疫组化法: 60℃的恒温器中烘烤30min后使用不同梯度二甲苯、乙醇、H2O脱蜡水化,室温下封闭10min;抗原修复,微波炉中加热0.01mol/L柠檬酸钠缓冲溶液(pH6.0)直至沸腾,将组织切片放入柠檬酸钠缓冲溶液20min,自然冷却至室温后放入蒸馏水中浸泡10min,山羊血清封闭lh后吸出血清,加入相应的STRAP一抗(兔抗人单抗,1∶100) 4℃孵育24h;使用Tris-HCl于TBST中洗涤3次,每次5min,然后加入STRAP二抗(鼠抗兔单抗)孵育1h,TBST洗涤3次,加入二氨基联苯胺(DAB)进行显色,直到变为浅黄色,放入蒸馏水终止反应;用苏木精染色,脱水并固定玻片,滴加30%中性树胶,用盖玻片固定玻片,根据染色结果判定阳性。STRAP以细胞胞浆呈现棕黄色为阳性细胞,根据染色强度(无染色为0分,浅棕色为1分,棕色为2分,深棕色为3分)和阳性细胞比例(1%-25%为1分,26%-50%为2分,51%-75%为3分,>76%为4分)之和,分数≥3分为阳性表达。
1.3.2 Ki-67免疫组化:采用PV-6000二步法,Ki-67核抗原及PV-6000试剂盒均购自武汉塞维尔生物科技有限公司;4%甲醛溶液固定组织后石蜡包埋,4μm连续切片;组织切片脱蜡、水化;微波修复20min;3%H2O2孵育5min,PBS冲洗;滴加一抗,4℃冰箱过夜,PBS冲洗,2min×3次;滴加通用型IgG抗体-HRP多聚体,37℃孵育20min,PBS冲洗,2min×3次;DAB溶液显色;蒸馏水冲洗、复染、脱水、封片。用已知阳性切片作阳性对照,用PBS代替一抗作阴性对照。Ki-67以细胞核呈现棕黄色为阳性细胞,选取细胞密集区观察计数500个细胞,计算阳性细胞的比例作为增殖指数。
1.4 统计学处理

2 结 果
2.1 乳腺癌和乳腺良性病变组织Ki-67、STRAP表达比较
乳腺组织Ki-67和STRAP免疫组化染色阳性图片见图1。乳腺癌组组织Ki-67和STRAP阳性表达率明显高于乳腺良性病变组组织(P<0.01)。见表2。
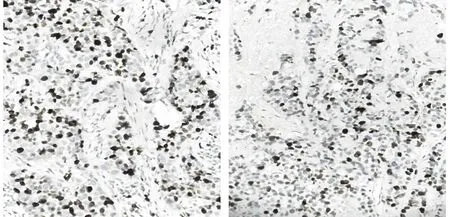
Ki-67阳性表达 STRAP阳性表达

表2 两组患者病变组织Ki-67、STRAP表达比较
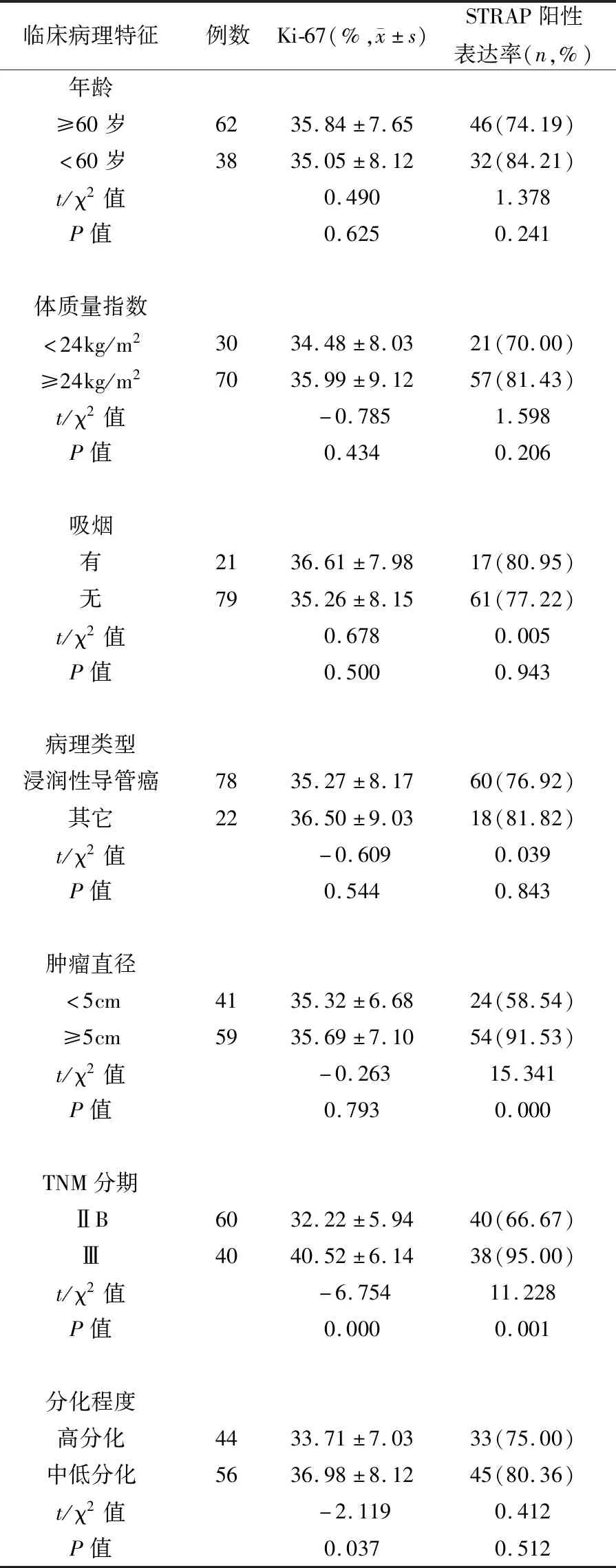
表3 Ki-67、STRAP表达与乳腺癌患者临床病理特征比较
2.2 乳腺癌不同临床病理特征患者Ki-67、STRAP表达比较
不同年龄、体质量指数、吸烟、病理类型、肿瘤直径患者病变组织Ki-67比较差异无统计学意义(P>0.05);不同年龄、体质量指数、吸烟、病理类型、分化程度患者病变组织STRAP比较差异无统计学意义(P>0.05)。
TNM分期Ⅲ期、中低分化乳腺癌组织Ki-67明显高于ⅡB期、高分化组织(P<0.05或P<0.01);肿瘤直径≥5cm、TNM分期Ⅲ期乳腺癌组织STRAP阳性表达率明显高于肿瘤直径<5cm、ⅡB期组织(P<0.01)。见表3。
2.3 qCR组和非qCR组乳腺癌患者病变组织Ki-67、STRAP表达比较
qCR组患者Ki-67和STRAP阳性表达率明显低于非qCR组患者(P<0.01),见表4。

表4 两组乳腺癌患者病变组织Ki-67、STRAP表达比较
2.4 Ki-67联合STRAP对非qCR的预测价值
Ki-67联合STRAP预测非qCR的ROC曲线下面积为0.819,明显高于Ki-67、STRAP单独预测的0.711和0.632(P<0.01),灵敏度和特异度分别为84.50%和87.00%,见图2和表5。
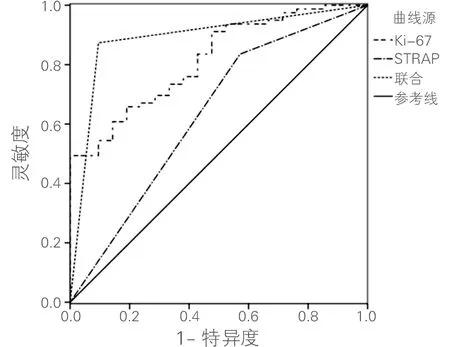
图2 Ki-67、STRAP对非qCR预测价值的ROC曲线分析

表5 Ki-67、STRAP对非qCR的预测价值分析
3 讨 论
Ki-67抗原是目前公认的一种与细胞增殖密切相关的蛋白,其表达与细胞周期密切相关,Ki-67说明乳腺癌细胞增殖敏感性,Ki-67阳性表达率反映了肿瘤细胞快速增殖、高侵袭、转移率,其阳性表达率越高,肿瘤细胞增殖越快[11,12]。有研究发现[13],Ki-67不表达于DNA修复状态的细胞,能更好地显示与肿瘤增殖之间的关系。本研究结果显示,乳腺癌组织Ki-67阳性表达率明显高于乳腺良性病变组织,与以往观点相符。其机制可能是Ki-67促进微血管形成,导致乳腺癌肿瘤快速增长,考虑降低其表达会抑制肿瘤增殖,因此可将Ki-67表达降低作为化疗后病理缓解程度的指标。
既往研究指出STRAP在癌细胞中高表达,促进癌细胞的增殖并抑制其凋亡,其表达水平与癌细胞的分化水平相关, STRAP的异常表达导致恶性肿瘤的产生[14]。本研究结果显示,乳腺癌组织STRAP阳性表达率明显高于乳腺良性病变组织,佐证了上述观点,可能与该蛋白普遍存在于癌细胞的细胞质与细胞核中,在细胞核中发挥其生物学特性有关。
本研究显示肿瘤直径≥5cm、TNM分期Ⅲ期乳腺癌组织STRAP阳性表达率明显高于肿瘤直径<5cm、ⅡB期组织(P<0.05)。提示sTRAP可作乳腺癌分化程度的标志物,其表达水平对于恶性肿瘤的发生和发展十分重要[15]。本研究创新性提出以STRAP作为评价指标,为乳腺癌的临床诊断提供可靠的理论依据。Ki-67与肿瘤细胞快速增殖有关, 本研究发现TNM分期Ⅲ期、中低分化乳腺癌组织Ki-67明显高于ⅡB期,高分化组织(P<0.05);Ki-67增殖指数是乳腺癌分子分型的标志物,故检测残留Ki-67水平在患者后续治疗计划及预后评估中显得十分重要[16]。
既往研究发现新辅助化疗后Ki-67水平与癌细胞数量减少有关[17,18]。本研究显示,qCR患者Ki-67阳性表达率明显低于非qCR患者,提示新辅助化疗效果好的患者Ki-67阳性表达率较低,其呈低表达抑制了肿瘤细胞的增殖。STRAP促进癌细胞的增殖与分化,在多种癌变组织中高表达[19],本研究发现qCR患者STRAP阳性表达率明显低于非qCR患者(P<0.05),说明STRAP水平与新辅助化疗效果有关。有资料显示[20]Ki-67不同程度的表达是影响乳腺癌预后最主要因素,临床上乳腺癌化疗期间可将Ki-67作为判断其治疗效果和预后的重要标志物。同时在新辅助化疗领域,涉及Ki-67的研究也层出不穷,其对治疗效果的预测作用逐渐上升为研究重点领域。
本研究在以往研究基础上联合检测了STRAP水平,旨探讨新辅助化疗后肿瘤残余的预测价值,结果显示Ki-67联合STRAP预测非qCR的ROC曲线下面积明显高于Ki-67、STRAP单独预测,说明二者均能够反映肿瘤细胞的增殖活性。 Ki-67一般出现在细胞分裂周期的G1、S、G2和M期,如若在病理报告中Ki-67指标表达较高,也就意味肿瘤细胞处于增殖较快阶段,能准确反映细胞增殖状态; STRAP能够调节多条信号通路的转导,是一种较为理想的细胞增殖标志物,在判断肿瘤细胞增殖活性、指导临床治疗及判断化疗疗效中十分重要。
综上所述,乳腺癌患者STRAP、Ki-67表达明显增强,与TNM分期、肿瘤直径、分化程度有一定关系;STRAP联合Ki-67预测新辅助化疗后肿瘤残余方面有一定应用价值。本研究样本量不足,下一步应扩大样本量进行更深入、全面的研究。
◀
本文第一作者简介:
张伟强(1980-),男,汉族,主管技师,研究方向:免疫组织化学病理诊断