异常凝血酶原II和甲胎蛋白联合检测对原发性肝癌的诊断价值
付 琳 钱 波 卢勤宁
原发性肝癌(Primary Liver Cancer,PLC)是最常见的消化道恶性肿瘤之一,也是癌症相关死亡的第三大常见原因[1]。PLC侵袭性强、进展迅速,五年存活率只有7%,严重危害患者生命健康[2, 3]。该病起病较为隐匿,在疾病早期多无明显临床症状,多于体检中检查发现,大多数患者在确诊时已为中晚期阶段,错过最佳治疗时机[4]。因此,检测简便、廉价、无创、可重复的血清生物标志物在PLC的早期筛查中发挥着重要作用[5]。
自20世纪70年代开始,甲胎蛋白(Alpha Fetal Protein,AFP)就已经作为临床诊断PLC的首选标志物而广泛应用于PLC的诊断,但约40%的PLC患者血清AFP水平并不明显升高[6]。此外,AFP在一些良性肝脏疾病中也可出现不同程度的升高,如慢性肝炎和肝硬化[7]。因此,为提高对PLC的早期诊断,使患者及时接受治疗,寻找更为敏感和特异的的生物标志物迫在眉睫。1984年,Liebman等[8]发现,因缺乏维生素K或由拮抗剂-II诱导的凝血酶原(Prothrombin Induced by Vitamin K Absence or Antagonist-II,PIVKA-II)在PLC患者血清中显著升高,可能成为诊断肝癌的新型标志物。PIVKA-II是机体因缺乏维生素K、维生素K利用障碍或存在维生素K拮抗剂而大量合成的一种异常凝血酶原。近年来,大量临床研究表明PIVKA-II对PLC的诊断有较好的敏感度和特异度,因此PIVKA-II逐渐作为肝癌筛查和诊断的临床诊断指标[9]。本文纳入204例PLC患者,分析PLC患者血清AFP、PIVKA-II水平变化及对疾病的临床诊断价值,为该指标的临床应用提供参考。
1 资料与方法
1.1 研究对象
选取2021-06-2022-06于本院就诊且首次诊断为PLC的患者204例(肝癌组),男性151例,女性53例,平均年龄(53.41±8.59)岁;CNLCⅠa期患者89例,CNLCⅠb期患者70例,CNLCⅡa期患者40例,CNLCⅡb期患者5例。纳入标准:(1)临床或病理诊断符合PLC诊疗指南(2019 年版)[10];(2)临床资料完整。排除标准:(1)合并病毒性肝炎、肝硬化等肝病或诊断为其它恶性肿瘤;(2)服用了影响指标检测的相关药物。选择同期于本院就诊且诊断为慢性病毒性肝炎的患者126例(肝炎组),其中男性94例,女性32例,平均年龄(51.91±12.25)岁。纳入标准:临床上根据相关检查结果已确诊为慢性病毒性肝炎。排除标准:(1)由其它原因引起的慢性肝炎,如酒精性、自身免疫性等;(2)合并其它恶性肿瘤或严重的全身性疾病。同时,选取同期健康体检者224例为对照组,男性178例,女性46例,平均年龄(52.14±9.84)岁。各组对象一般资料见表1,组间基本资料差异无统计学意义(P>0.05)。

表1 三组对象一般资料比较
1.2 观察指标和方法
患者进行治疗前,于清晨空腹条件下,采集3ml静脉血至促凝管中,3 000rpm离心10min以分离血清,并保存于-80℃冰箱待检。使用Siemens ADVIA CENTAUR XP全自动化学发光免疫分析仪双抗体夹心法测定血清AFP水平; Siemens Advia 2400全自动生化分析仪测定丙氨酸氨基转移酶(ALT)、天冬氨酸氨基转移酶(AST)、碱性磷酸酶(ALP)、谷氨酰转肽酶(GGT)和总胆红素(TBIL)水平,使用Siemens相关配套试剂进行检测。化学发光仪G1200化学发光酶免疫法测定血清PIVKA-II水平,生物参考区间为≤40mAU/ml。
1.3 统计学处理

2 结 果
2.1 三组血清ALT、AST、ALP、GGT和TBIL水平的比较
如表2所示,三组间血清ALT、AST、ALP、GGT和TBIL水平差异均有统计学意义(均P<0.01)。与对照组比较,肝炎组和肝癌组患者ALT、AST、ALP、GGT和TBIL水平均升高(肝炎组TBIL除外),肝癌组升高更明显,差异均有统计学意义(z均>3.087,P<0.05)。

表2 三组血清ALT、AST、ALP、GGT和TBIL水平的比较[M(P25,P75)]
2.2 三组间血清AFP和PIVKA-II水平比较
如表3所示,三组间血清AFP、PIVKA-II水平差异均有统计学意义(均P<0.01)。与对照组比较,肝炎组AFP水平升高,肝癌组AFP、PIVKA-II水平均升高;与肝炎组比较,肝癌组患者AFP、PIVKA-II水平均升高,差异均有统计学意义(z均>3.120,P<0.05)。

表3 三组血清AFP和PIVKA-II水平的比较[M(P25,P75)]
2.3 AFP和PIVKA-II与一般肝功能指标的相关性分析
分析肝癌组患者血清AFP、PIVKA-II水平与一般肝功能指标的相关性,结果如表4所示,AFP与AST(r=0.225,P<0.01)和GGT(r=0.206,P<0.01)呈正相关;PIVKA-II与ALT(r=0.144,P<0.05)、AST(r=0.445,P<0.01)、ALP(r=0.304,P<0.001)、GGT(r=0.365,P<0.01)和TBIL(r=0.129,P<0.05)呈正相关。AFP和PIVKA-II也呈正相关(r=0.592,P<0.01)。
2.4 Logistic回归分析
Logistic回归分析示PIVKA-II水平升高是PLC的独立危险因素(P<0.01)。
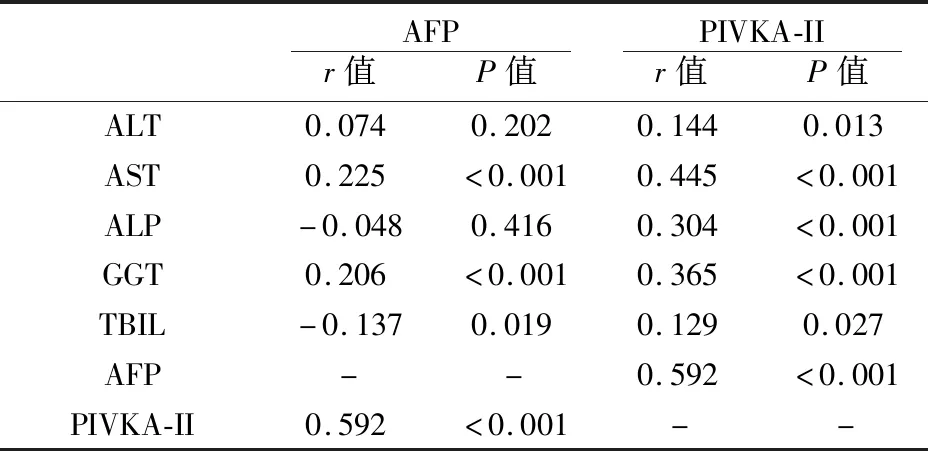
表4 AFP和PIVKA-II与肝功能指标的相关性分析
2.5 AFP和PIVKA-II单独检测及二者联合检测诊断PLC的ROC曲线
单独检测AFP时,ROC曲线下面积及95%置信区间为[0.831(95% CI:0.791-0.871)](P<0.01);单独检测PIVKA-II时,ROC曲线下面积及95%置信区间为[0.995(95% CI:0.991-0.998)](P<0.01);AFP和PIVKA-II联合检测时,ROC曲线下面积最大[0.998(95% CI:0.997-0.999)](P<0.01)。而AFP和PIVKA-II二者联合检测对PLC的诊断价值最大。见图1和表6。
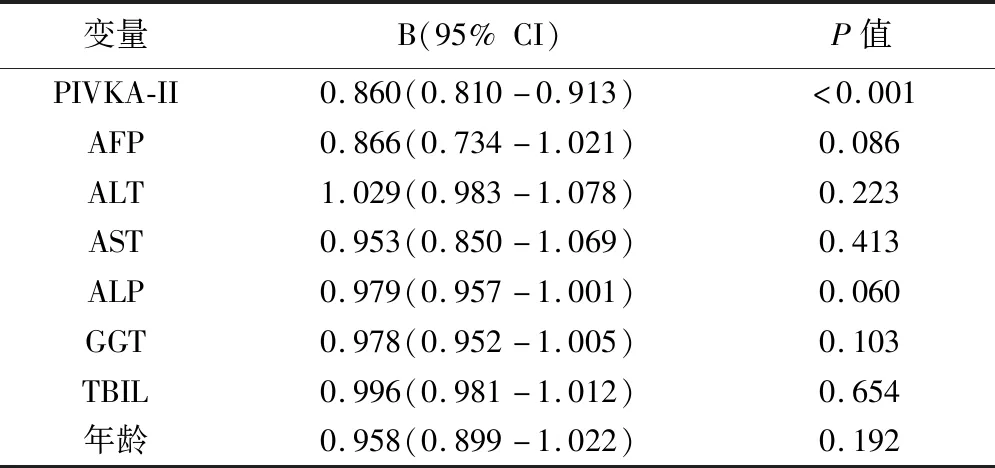
表5 Logistic回归分析
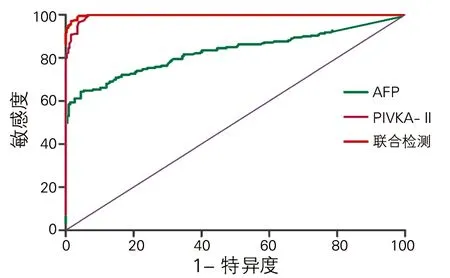
图1 AFP 和PIVKA-II单检及联合检测诊断PLC的ROC曲线
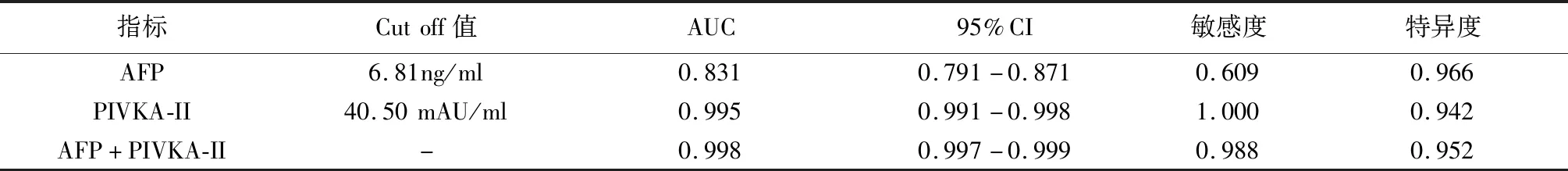
表6 AFP和PIVKA-II单检和联合检测对PLC的诊断价值
3 讨 论
PLC是一种常见的消化系统恶性肿瘤,具有侵袭性生长和早期转移的特点,是中国癌症死亡的第二大原因[4]。由于PLC早期无典型临床症状,许多患者在诊断时已为中晚期,因此,系统性筛查高危人群是早期诊断的必要条件。AFP是PLC筛查最常用的生物标志物,但其敏感性和特异性均不理想,尤其是对疾病的早期诊断[11]。如本研究中AFP诊断PLC的ROC曲线下面积为[0.831(95% CI:0.791-0.871)](P<0.001),与既往研究相符,支持了AFP作为PLC诊断生物标志物的不足。因此,需要寻找新的、可靠的生物标志物来提高对PLC的诊断水平。
近年来,PIVKA-II在PLC诊断中的应用受到了广泛关注。正常情况下,维生素K是肝脏合成凝血因子II、VII、IX和X所必需的。在缺乏维生素K或存在拮抗剂的情况下,依赖维生素K的羧化酶活性受到抑制,导致凝血因子N端谷氨酸残基羧基化改变,这种异常的凝血因子无法发挥其相应的凝血功能[8]。既往研究表明PIVKA-II是一种潜在的PLC诊断标志物[12, 13]。本研究结果显示,PLC患者血清PIVKA-II水平显著高于对照组和肝炎患者;且PIVKA-II与患者异常的肝功能指标如ALT、AST、ALP、GGT和TIBL均存在显著正相关关系。此外,相关性分析结果显示PIVKA-II与AFP存在显著正相关。Logistic回归分析结果显示,PIVKA-II水平的升高是PLC的独立危险因素。虽然PIVKA-II对PLC的诊断效率优于AFP,但并不认为PIVKA-II可以完全替代AFP用于肝癌的早期筛查。与单独应用PIVKA-II诊断PLC相比,PIVKA-II与AFP联合检测时,ROC曲线下面积最大,二者联合检测可提高对PLC的诊断性能。即对于PLC的诊断,PIVKA-II可对AFP发挥重要的补充作用,PIVKA-II与AFP联合应用更可取。
综上所述,PLC患者血清PIVKA-II水平显著升高,血清PIVKA-II水平可能是独立且有利于PLC诊断的肿瘤标志物,PIVKA-II可作为AFP在PLC诊断中的补充。PIVKA-II和AFP两种血清标志物联合检测可大大提高对PLC的诊断效能。
◀
本文第一作者简介:
付 琳(1977-),女,汉族,副主任技师,研究方向:免疫学检验、血栓与止血检验和生化检验