2 种奥卡西平片在中国健康受试者中空腹及餐后单次口服给药的安全性研究
方智 唐维 丁晶 刘艳红 张茜 龚凤云
奥卡西平(oxcarbazepine)是第二代抗癫痫药物,是第一代抗癫痫药物卡马西平的酮衍生物[1-3]。该药物主要通过其药理活性代谢物(10-单羟基衍生物,MHD)发挥作用[4]。其主要适用于治疗原发性全面性强直-阵挛发作和部分性发作,伴有或不伴有继发性全面性发作[5,6]。奥卡西平最早是由瑞士汽巴-嘉基公司开发,1990 年首次在丹麦上市,2000 年美国食品药品监督管理局(FDA)批准奥卡西平片上市,规格为0.15、0.3、0.6 g。国家药监局批准诺华作为持有人的进口奥卡西平片,商品名为曲莱(Trileptal),规格为0.3、0.15 g。武汉人福药业有限责任公司2004 年仿制奥卡西平片并获得批准文号,规格为0.3 g,商品名为万仪(Wanyi)。本研究旨在比较国产仿制奥卡西平片(万仪)与进口原研药奥卡西平片(曲莱)在中国健康受试者中空腹及餐后条件下单次口服给药的安全性。
1 受试者、材料与方法
1.1 试验设计 空腹试验采用单中心、随机、开放、单次给药、2 个周期、双交叉试验设计。餐后试验采用单中心、随机、开放、单次给药、3 个周期、部分重复交叉试验设计。
1.2 受试者 本试验申办方为武汉人福药业有限责任公司,已在国家药监局药物临床试验登记与信息公示平台登记公示,登记号为CTR20211866。研究由武汉金银潭医院药物Ⅰ期临床试验研究室完成,获得武汉金银潭医院伦理委员会批准(批件号GCPICT-2021-09)。所有受试者均签署知情同意书。
入选标准:18~65 岁的男性和女性;男性体重≥50.0 kg,女性体重≥45.0 kg,体质量指数(BMI)19.0~26.0 kg/m2;受试者无心血管、肝脏、肾脏、血液和淋巴、内分泌、免疫、精神、神经、胃肠道系统等慢性疾病史或严重疾病史,并且总体健康状况良好。
排除标准:对奥卡西平或任意药物组分有过敏史;吞咽困难或胃肠道疾病史;可能影响试验安全性的手术史、外伤史;2 周内使用过任何药品或者保健品;6 个月内有药物滥用史者;3 个月内使用过毒品;3 个月内吸烟量>5 支/d,或试验期不能戒烟;3 个月内每周饮酒量>14 单位(1 单位=17.7 ml 乙醇),或试验期不能禁酒;3 个月内参加过其他的药物临床试验;4 周内接种过疫苗,或计划试验期接种疫苗;女性处在哺乳期;乙型肝炎(乙肝)、丙型肝炎(丙肝)、人类免疫缺陷病毒(HIV)或梅毒患者;女性受试者在筛选期妊娠检查结果阳性者。
1.3 药物 受试制剂为武汉人福药业有限责任公司生产的奥卡西平片(万仪),规格0.3 g,批号49102101,含量99.6%,有效期至2023 年12 月。参比制剂为Novartis Farma S.p.A 生产的奥卡西平片(曲莱),规格0.3 g,批号T0099,含量97.1%,有效期至2023 年01 月。
1.4 分组及给药 空腹试验中,受试者按照1∶1 比例随机分配到2 个给药顺序组(T-R 组/R-T 组)之一。餐后试验中,受试者按照1∶1∶1 比例随机分配到3 个给药顺序组(T-R-R 组/R-T-R 组/R-R-T 组)之一。Ⅰ期临床试验研究室药师根据随机化列表为每阶段试验分配试验用药品。
每个周期给药当日,在室温条件下空腹(空腹试验)或进食高脂餐食后(30±0.5)min(高脂餐后试验)口服万仪1 片(0.3 g)或曲莱1 片(0.3 g),240 ml 水送服。服药后要检查口腔和盛药容器,以确保药物的正确服用。受试者在给药前1 h 至给药后1 h 内禁止饮水,给药后4 h 内禁食。
1.5 药物安全性评价 安全性评价指标包括不良事件,严重不良事件,合并用药,临床实验室结果的改变(血常规、血生化、尿常规等),临床症状、生命体征测定结果,12-导联心电图和体格检查结果。
参考NCI CTCAE 5.0 标准评估不良事件严重程度,根据药物与不良事件因果关系判断标准,将不良事件与受试药物应用的相关性分为五级,肯定有关、很可能有关、可能有关、可能无关、肯定无关。所有临床事件和有临床意义的实验室不良反应均按照常见不良反应事件评价标准NCI CTCAE5.0 版进行处理。临床事件和有临床意义的实验室检测异常均将按照NCI CTCAE5.0 进行分级。无论是否被视为与治疗相关,均必须定期监测发生不良事件的所有受试者(如果可行),直至症状消退、任何异常实验室值恢复正常或恢复至基线水平或认为它们不可逆,或直至可恰当解释所观察到的变化。
1.6 安全性分析 统计不良事件、严重不良事件、不良反应、严重不良反应的发生率。
2 结果
2.1 试验完成情况 空腹试验入组56 例,男46 例,女10 例;汉族54 例,土家族2 例;年龄最小18 岁,最大40 岁,平均年龄(26.04±4.97) 岁;平均身高(169.62±7.20)cm;平均体重(63.58±8.05)kg;BMI 最小19.0 kg/m2,最大26.0 kg/m2,平均BMI(22.07±2.10)kg/m2。55 例受试者完成了2 个周期的给药试验。1 例完成第1 个周期后自行退出研究。
餐后试验入组75 例,男60 例,女15 例;汉族72 例,土家族2 例,彝族1 例;年龄最小18 岁,最大43 岁,平均年龄(28.29±5.92)岁;平均身高(168.11±7.75)cm;平均体重(64.39±7.94)kg;BMI 最小19.3 kg/m2,最大25.6 kg/m2,平均BMI(22.73±1.74)kg/m2。71 例受试者按照方案完成了3 个周期的给药,1 例受试者随机后未给药退出,3例受试者第1个周期给药后自行退出。
2.2 安全性分析 空腹56 例受试者均纳入全分析集(FAS)、安全数据集(SS)。空腹试验万仪组出现2例(3.6%,2/55)受试者发生3 例次不良反应,曲莱组出现11 例(19.6%,11/56)受试者发生11 例次不良反应,均无严重不良反应。见表1,表2。全部不良反应均随访至痊愈/恢复。见表3。
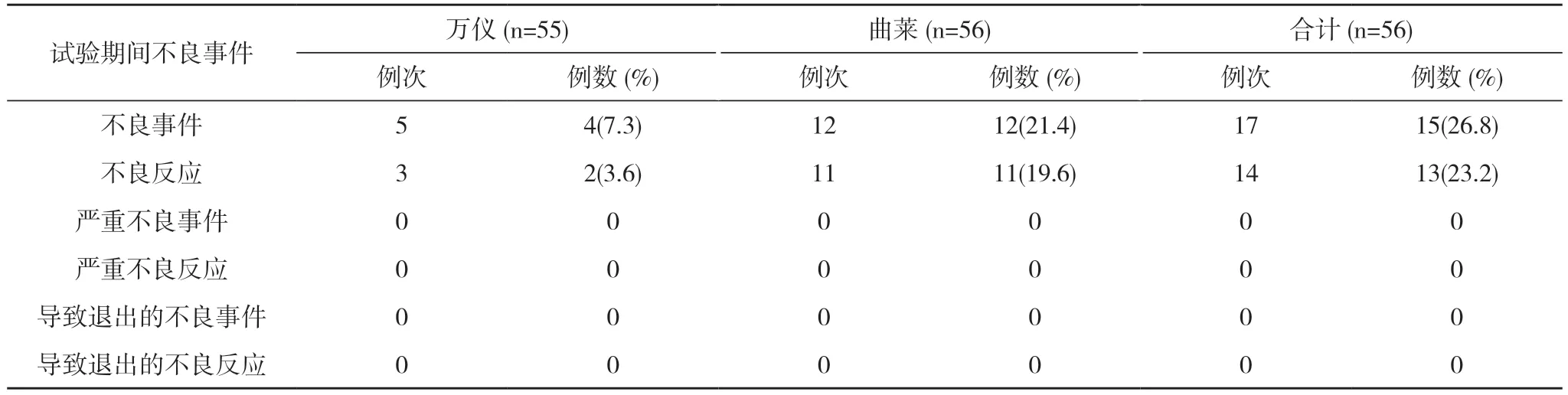
表1 空腹试验期间不良事件发生情况(SS)
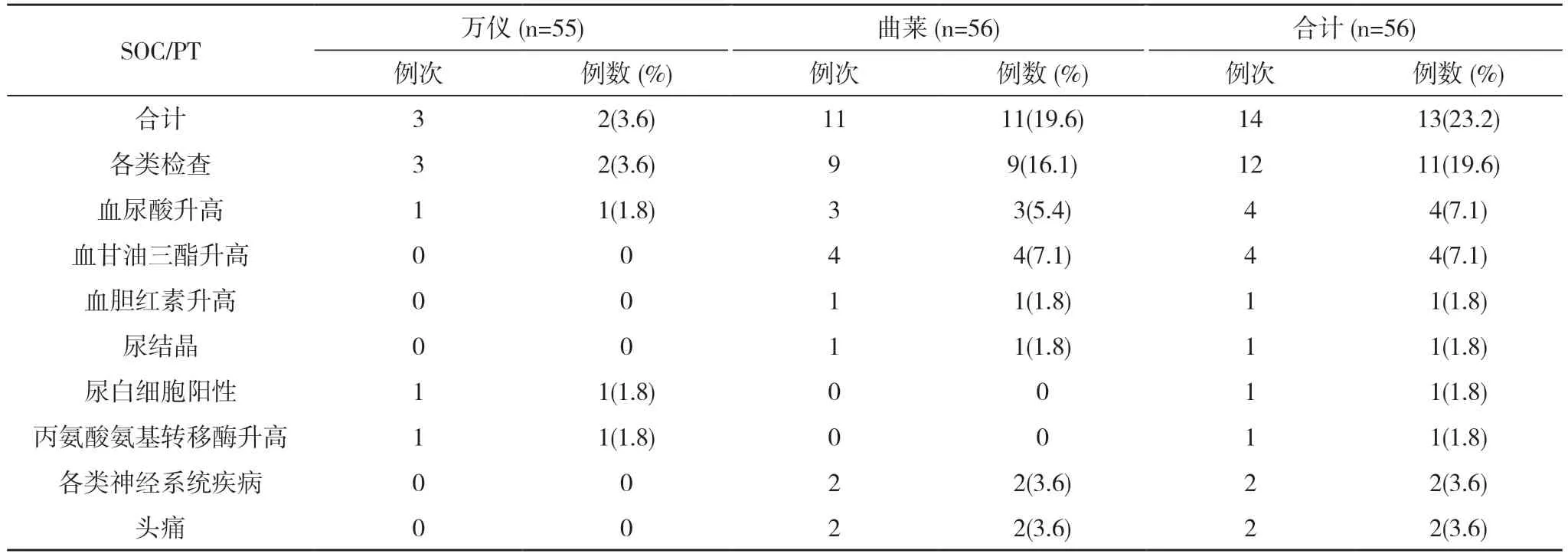
表2 空腹试验各系统不良反应发生情况(SS)
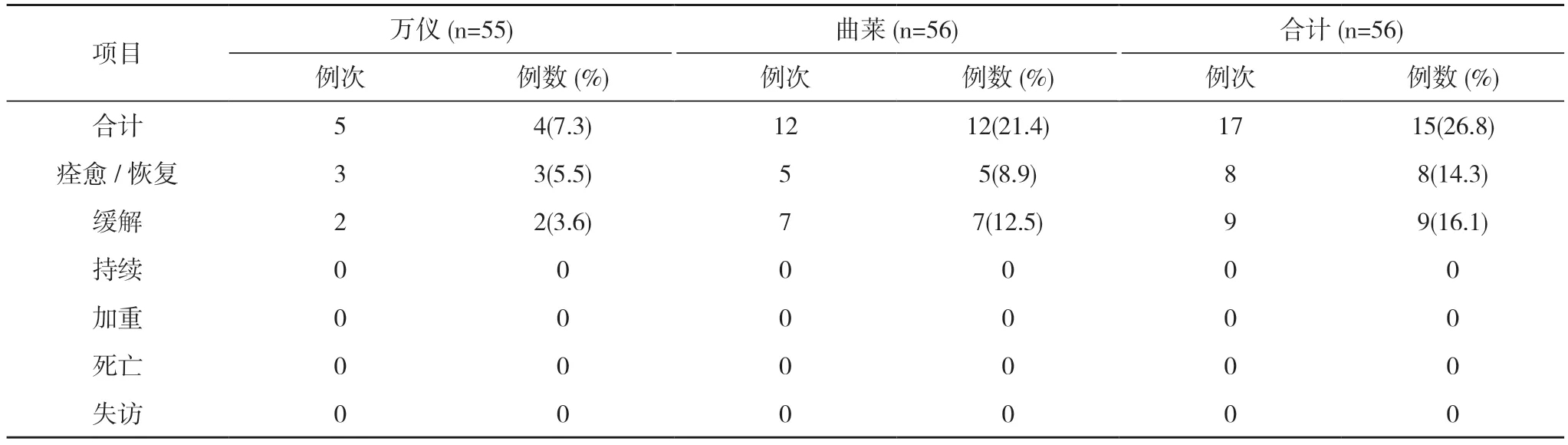
表3 空腹不良事件转归(SS)
餐后试验75 例受试者均纳入FAS,74 例受试者纳入SS(1 例因拒绝进食高脂餐未给药,并退出研究)。餐后试验万仪组出现10 例(14.1%,10/71)受试者发生10 例次不良反应,曲莱组出现16 例(21.6%,16/74)受试者发生20 例次不良反应,均无严重不良反应。见表4,表5。全部不良反应均随访至痊愈/恢复,见表6。

表4 餐后试验期间不良事件发生情况(SS)

表5 餐后试验各系统不良反应发生情况(SS)
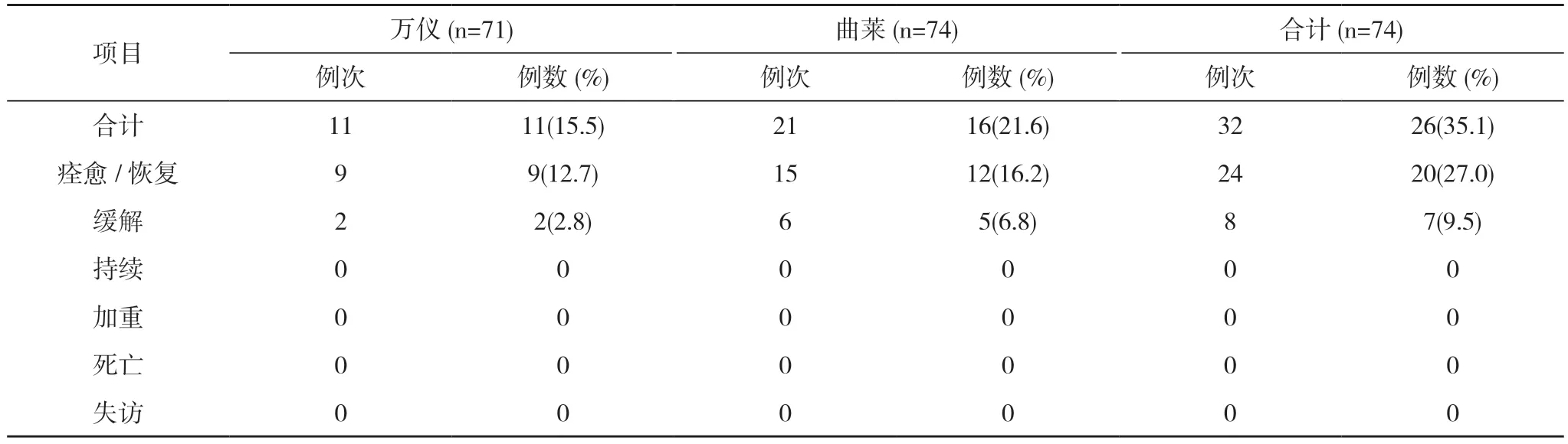
表6 餐后试验不良事件转归(SS)
统计结果表明,万仪组的不良事件、不良反应略少于曲莱,但2 种制剂的不良事件、不良反应的发生率、种类、严重程度和转归无统计学差异。
3 讨论
奥卡西平片作为第二代抗癫痫药物,在世界及中国大规模临床应用已有20 余年,安全性和耐受性较好已成为医学界共识[7,8]。本研究结果亦表明,国产仿制药奥卡西平片(万仪)和进口原研药奥卡西平片(曲莱)的不良反应较轻,主要表现为尿酸升高和甘油三酯升高。两种制剂在试验期间均无严重不良事件发生,不良反应发生率、类型、严重程度和转归无统计学差异,且全部治愈或缓解,无持续、加重或死亡发生。
综上所述,国产仿制药奥卡西平片(万仪)与进口原研药奥卡西平片(曲莱)在中国健康受试者空腹及餐后单次口服给药安全性良好。

