LINC01116靶向miR-203加剧氧糖剥夺/复氧诱导下人海马星形胶质细胞损伤
黄正义, 赵增霞, 符秋红, 刘淑云, 陈协辉
急性缺血性脑卒中(AIS)是一种常见的脑血管疾病,也是全世界范围内引发60岁以上人群致残和死亡的主要原因之一[1]。脑缺血再灌注损伤(CIRI)是指由缺血缺氧引起的脑组织损伤在重新获得血氧供应后进一步加重甚至不可逆的病理过程。研究表明,CIRI涉及一系列病理变化,包括细胞增殖受损、凋亡增加、氧化应激和炎症反应激活等,最终导致神经元损伤甚至坏死[2]。因此,进一步探究CIRI潜在分子机制,并寻找新的有效的治疗靶点是十分必要的。
近年来众多转录组测序与表达谱芯片证实,长链非编码RNA (lncRNAs)与微小RNA (miRNAs)在AIS中异常表达并与疾病进展密切相关[3]。到目前为止,研究已报道了一些lncRNAs在CIRI中的详细作用机制,如H19印记母体表达转录产物(H19)、转移相关肺腺癌转录产物1 (MALAT1)、X染色体失活特定转录产物(XIST)及小核仁RNA宿主基因12(SNHG12)等[4]。作为一个lncRNA,LINC01116的研究主要集中在肿瘤方面,被发现与多种肿瘤进展有关,并可作为诊断与预后的新型生物标志物[5]。我们通过分析GEO数据库中GSE122709与GSE140275结果,发现LINC01116在AIS患者外周血高表达,推测其可能在CIRI中发挥一定的作用。基于以上证据,本研究目的在于明确LINC01116在AIS海马星形胶质细胞中的作用及相关分子机制。
1 资料与方法
1.1 主要试剂 RNA结合蛋白免疫沉淀(RIP)试剂盒来自美国Merck Millipore公司,人海马星形胶质细胞(hHA)来自上海中乔新舟公司,杜尔贝科改良伊格尔培养基(DMEM)、无糖DMEM及胎牛血清(FBS)来自美国ThermoFisher公司,sh-Ctrl载体、sh-LINC01116载体、对照抑制物及miR-203抑制物来自上海吉玛基因公司,Advanced高效DNA/RNA转染试剂盒来自美国Zeta Life公司,细胞增殖/毒性试剂盒-8(CCK-8)与末端脱氧核苷酸转移酶介导的原位缺口末端标记法(TUNEL)试剂盒来自上海生工生物公司,激活型半胱氨酸天冬氨酸蛋白酶-3(caspase-3)、Bcl-2相关X蛋白(Bax)、B细胞淋巴瘤/白血病-2(Bcl-2)、真核翻译起始因子2C2(AGO2)及甘油醛-3-磷酸脱氢酶(GAPDH)抗体来自美国Abcam公司,活性氧(ROS)与乳酸脱氢酶(LDH)试剂盒来自苏州碧云天生物技术公司,酶联免疫吸附试验(ELISA)相关试剂盒来自上海科艾博生物公司。
1.2 临床标本 回顾性选择了2018年1月-2019年12月期间在深圳市龙华区中心医院经溶栓治疗的131例AIS患者。纳入标准:按照中国AIS诊治指南2018版[6]诊断为AIS,且在发病6 h内入院治疗。排除标准:AIS发病超过6 h,复发性AIS、短暂性脑缺血发作、脑出血、蛛网膜下腔出血、颅内占位性病变、意识障碍、严重肝肾功能不全、凝血功能障碍、恶性肿瘤及急慢性感染性疾病。收集所有的患者溶栓前后静脉血5 ml,放置于抗凝管,并于-20 ℃保存备用。本研究已获深圳市龙华区中心医院伦理委员会审批,并得到所有参与者的知情同意。
1.3 方法
1.3.1 总RNA提取和反转录 取500 μl静脉血,加入1.5 ml RNAiso Blood,充分混匀后,按照试剂盒提供步骤萃取总RNA。对于lncRNAs反转录,取1 μg总RNA,2 μl 5×PrimeScript RT Master Mix及适量去离子水至总体积为10 μl;之后依次37 ℃ 15 min,85 ℃ 5 s,4 ℃ 30 min合成互补脱氧核糖核酸(cDNA)。对于miRNAs反转录,取2 μg总RNA,5 μl 2×mRQ Buffer,1.25 μl mRQ Enzyme及适量去离子水至总体积为10 μl;随后按照37 ℃ 60 min,85 ℃ 5 min,4 ℃ 30 min合成cDNA。
1.3.2 实时荧光定量PCR 对于LINC01116实时荧光定量PCR试验,取2 μl cDNA,10 μl 2×TB Green Premix Ex Taq II,0.4 μl 50×ROX Reference Dye,0.8 μl正向引物,0.8 μl反向引物及6 μl去离子水至总体积为20 μl;之后依次95 ℃ 30 s,95 ℃ 5 s,60 ℃ 45 s,共40个循环。对于miR-203实时荧光定量PCR试验,取2 μl cDNA,12.5 μl 2×TB Green Advantage Premix,0.5 μl 50×ROX Dye,0.5 μl通用引物,0.5 μl miR-203引物及9 μl去离子水至总体积为25 μl;之后依次95 ℃ 15 s,95 ℃ 5 s,60 ℃ 20 s,共40个循环。反应结束后,分别以GAPDH和U6为内参基因采用2-ΔΔCt法计算LINC01116与miR-203表达水平。LINC01116正向引物:5’-CACCATGCCTGGCTGATTTGTC-3’,反向引物:5’-GTGTACTTCAGGGCCTTTGGGT-3’; GAPDH正向引物:5’-CATGGGTGGAATCATATTGGAA-3’,反向引物:5’-GAAGGTGAAGGTCGGAGT-3’; miR-203引物:GTGAAATGTTTAGGACCACTAG;U6正向引物:5’-CTCGCTTCGGCAGCACA-3’,反向引物:5’-ACGCTTCACGAATTTGCGT-3’。
1.3.3 细胞培养 hHA细胞复苏后,采用DMEM和10% FBS培养,并在培养基中添加2 mmol/L谷氨酰胺、100 μg/ml链霉素及100 U/ml青霉素,置于含5%二氧化碳的恒温(37 ℃)加湿培养箱中培养。
1.3.4 双荧光素酶报告基因试验 LINC01116-野生型(WT)序列包含与miR-203预测结合位点被扩增并插入pmirGLO双荧光素酶miRNAs表达载体,建立报告载体pmirGLO-LINC01116-WT。同时使用GeneArt®定点诱变PLUS系统突变(MUT)LINC01116序列中包含与miR-203预测结合位点,建立报告载体pmirGLO-LINC01116-MUT。取对数期生长的hHA细胞接种至24孔板(约5×105/孔),培养过夜。第二天采用Advanced高效DNA/RNA转染试剂将0.5 μg报告载体与30 nmol miR-203抑制物或30 nmol对照抑制物共转染到细胞中并培养48 h。根据荧光素酶报告基因试剂盒检测各孔荧光素酶活性。
1.3.5 RIP试验 用4 ℃预冷的PBS缓冲液洗涤细胞后,加入RIP裂解缓冲液冰上孵育20 min,13,000 r/min离心30 min收集上清液。将100 μl上清液转移至含有AGO2抗体(货号:ab186733,稀释倍数:1∶50)偶联磁珠的RIP免疫沉淀缓冲液中,4 ℃孵育过夜后,以IgG抗体(货号:ab172730,稀释倍数:1∶250)作为对照。第二天将磁珠用RIP洗涤缓冲液洗涤3次,然后用蛋白酶K在55 ℃孵育30 min,并过柱纯化提取RNA。最后检测LINC01116与miR-203表达水平。
1.3.6 氧糖剥夺/复氧(OGD/R)模型建立 取对数期生长的hHA细胞接种至24孔板(约5×105/孔),培养过夜。第二天采用无糖DMEM和10% FBS培养6 h,培养条件为37 ℃、0.5% O2、94.5% N2和5% CO2。之后,去除所有培养基添加DMEM和10% FBS在37 ℃、95%空气及5% CO2条件下继续培养24 h,即建立OGD/R。
1.3.7 实验分组及细胞转染 体外hHA细胞实验设为5个部分:分别为对照组、OGD/R组、对照干扰组、LINC01116干扰组及LINC01116联合miR-203干扰组。对照组与OGD/R组不进行细胞转染,而对照干扰组、LINC01116干扰组及LINC01116联合miR-203干扰组利用Advanced高效DNA/RNA转染试剂分别向细胞中转染0.75 μg sh-Ctrl载体,0.75 μg sh-LINC01116载体及0.5 μg sh-LINC01116载体+30 nmol miR-203抑制物。
1.3.8 CCK-8 将细胞接种至96孔培养板(约8×103/孔),每组设计3个复孔,在培养0 h、12 h、24 h、36 h及48 h后向对应各孔加入12 μl CCK-8,继续在37 ℃孵育4 h。随后采用酶标仪测定各孔在450 nm波长时的吸光度值,并计算细胞增殖曲线。
1.3.9 TUNEL 将0.2%聚乙二醇辛基苯基醚加入爬片孵育5 min进行透膜处理。之后,用5 μmol/L TUNEL在37 ℃染色15 min。将爬片放入0.3%过氧化氢中孵育10 min,并用0.5 μg/ml 4’,6-二脒基-2-苯基吲哚在黑暗中37 ℃染色5 min。利用荧光显微镜观察细胞着色情况,并计算凋亡率(%)。
1.3.10 蛋白质印迹 提取细胞中总蛋白,取30 μg蛋白进行10%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳。利用湿转膜法将蛋白转移至聚偏二氟乙烯(PVDF)膜。将PVDF膜用5% 脱脂奶粉在37 ℃封闭2 h,随后加入激活型caspase-3(货号:ab32042,稀释倍数:1∶500)、Bax(货号:ab32503,稀释倍数:1∶2500)、Bcl-2(货号:ab32124,稀释倍数:1∶1000)及和GAPDH(货号:ab9485,稀释倍数:1∶2500)抗体在4 ℃孵育过夜。第2天将PVDF膜用含辣根过氧化物酶标记的抗兔二抗(货号:ab205718,稀释倍数:1∶5000)在37 ℃孵育1 h。最后在避光环境中将PVDF膜用增强化学发光显色试剂处理并曝光,采用Image Pro Plus7.0软件分析灰度值并计算蛋白表达水平。
1.3.11 ROS与LDH试验 取106个细胞重悬于10 μmol/L活性氧荧光探针(DCFH-DA)中,并在37 ℃孵育20 min。之后,用DMEM充分洗涤细胞去除未进入细胞内的DCFH-DA,利用荧光分光光度计测定细胞中ROS水平。向上清液中加入150 μl检测液(稀释10倍),并在37 ℃孵育1 h。随后400 r/min离心5 min再次收集上清液,并取120 μl上清液加入到96孔板相应孔中,采用酶标仪测定各测试孔在490 nm波长时的吸光度值,并计算LDH活性。
1.3.12 ELISA试验 将上清液和标准样品分别放入测试孔内在37 ℃孵育2 h,之后用缓冲液洗涤测试孔。将ELISA试剂盒自带的生物素标记抗体(TNF-α、IL-1β、IL-4、IL-6、IL-10及IL-13)放入测试孔内在37 ℃孵育1 h。然后将链霉亲和素标记的辣根过氧化物酶放入测试孔内在37 ℃孵育20 min,并与四甲基联苯胺孵育20 min。通过酶标仪测定各测试孔在450 nm波长时的吸光度值,绘制标准曲线并计算炎症因子浓度。
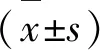
2 结 果
2.1 AIS患者溶栓前后血清中LINC01116与miR-203的表达水平及二者的关系 本研究共收集131例AIS患者,其中女54例,男77例,年龄29~83岁(57.41±9.26)岁。AIS患者溶栓后血清中LINC01116表达水平高于溶栓前,差异有显著性(P<0.05)。AIS患者溶栓后血清中miR-203表达水平低于溶栓前,差异有显著性(P<0.05)。LINC01116与miR-203表达呈负相关(P<0.05) (见图1)。

A:溶栓后血清中LINC01116表达高于溶栓前;B:溶栓后血清中miR-203表达低于溶栓前;1C:LINC01116与miR-203表达呈负相关。与溶栓前比较*P<0.05
2.2 LINC01116与miR-203的调控关系 通过生物信息学分析,预测LINC01116转录产物(NR_040001.2)中“ATTTCA”序列可与miR-203中“TAAAGT”序列结合,提示miR-203可能受LINC01116调控。miR-203干扰显著上调报告载体pmirGLO-LINC01116-WT荧光素酶活性(P<0.05),而不影响报告载体pmirGLO-LINC01116-MUT荧光素酶活性。AGO2抗体显著富集LINC01116与miR-203表达(P<0.05)。二者结果表明,LINC01116通过“ATTTCA”序列海绵吸附miR-203(见图2)。

A:双荧光素酶报告基因试验,与对照抑制物比较*P<0.05;B:RIP试验分析,与IgG抗体比较*P<0.05
2.3 LINC01116干扰对miR-203表达的影响 OGD/R组中LINC01116表达水平高于对照组,而miR-203表达水平低于对照组,差异有显著性(P<0.05)。LINC01116干扰组中LINC01116表达水平低于对照干扰组,而miR-203表达水平高于对照干扰组,差异有显著性(P<0.05)。LINC01116联合miR-203干扰组中miR-203表达水平低于LINC01116干扰组,差异有显著性(P<0.05),表明LINC01116抑制miR-203表达(见图3)。
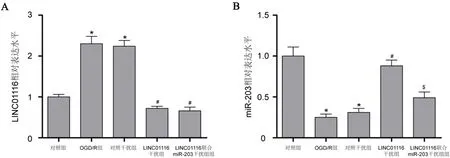
A:各组中LINC01116表达水平比较;B:各组中miR-203表达水平比较。与对照组比较*P<0.05;与OGD/R组与对照干扰组比较#P<0.05;与LINC01116干扰组比较$P<0.05
2.4 LINC01116干扰与LINC01116联合miR-203干扰对OGD/R诱导下hHA细胞损伤的影响 OGD/R组较对照组细胞增殖能力降低,细胞凋亡率升高,激活型caspase-3与Bax蛋白表达升高而Bcl-2蛋白表达降低,ROS生成增加,LDH活性升高,TNF-α、IL-1β及IL-6浓度上调而IL-4、IL-10及IL-13浓度下调(P<0.05),表明OGD/R诱导下hHA细胞损伤。LINC01116干扰组较OGD/R组与对照干扰组细胞增殖能力提高,细胞凋亡率下降,激活型caspase-3与Bax蛋白表达降低而Bcl-2蛋白表达升高,ROS生成减少,LDH活性下降,TNF-α、IL-1β及IL-6浓度下调而IL-4、IL-10及IL-13浓度上调(P<0.05),表明LINC01116干扰减轻OGD/R诱导下hHA细胞损伤。此外,miR-203干扰逆转LINC01116干扰对OGD/R诱导下hHA细胞损伤的保护作用(P<0.05),表明LINC01116通过靶向miR-203促进OGD/R诱导下hHA细胞损伤(见图4)(见表1)。

表1 各组细胞凋亡率与ROS生成及LDH活性比较
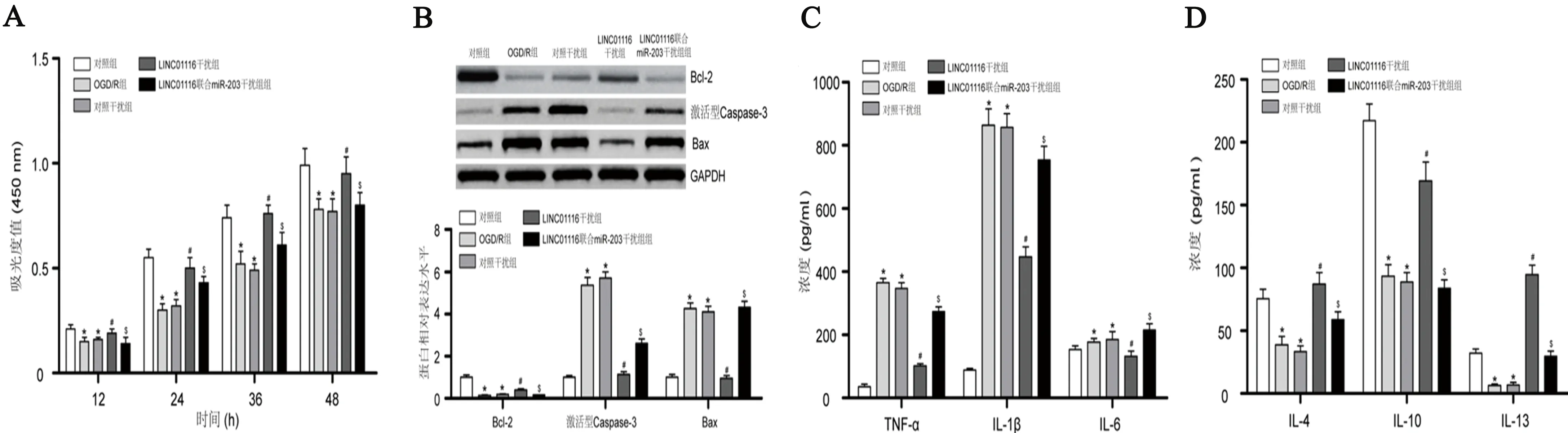
A:CCK-8试验;B:蛋白质印迹试验;C:ELISA试验检测TNF-α、IL-1β及IL-6浓度;D:ELISA试验检测IL-4、IL-10及IL-13浓度。与对照组比较*P<0.05;与OGD/R组与对照干扰组比较#P<0.05;与LINC01116干扰组比较$P<0.05
3 讨 论
最新研究发现,LINC01116通过调节miR-203/SMAD5信号轴影响瘢痕疙瘩成纤维细胞的增殖、迁移和凋亡[7]。LINC01116 还可以通过海绵吸附miR-9-5p上调叉头框转录因子P1促进子宫内膜基质细胞的增殖和迁移[8]。以上证据表明,LINC01116在各种疾病中具有广泛的生物学功能。目前如何改善CIRI一直是提高AIS治疗需面临的重要问题。前期我们在AIS患者外周血lncRNAs表达谱中发现LINC01116高表达[9]。此外,多篇文献证实异常表达的lncRNAs在CIRI中发挥重要的调节作用[10]。因此,我们推测LINC01116可能与CIRI有关。本研究通过一系列体外细胞实验及机制验证,发现LINC01116靶向miR-203促进OGD/R诱导下hHA细胞损伤,将为CIRI防治提供新的证据与潜在靶点。
越来越多的研究显示,lncRNAs可作为CIRI治疗的有希望的分子靶点。例如,Xu等[11]报道CAMK2D相关转录产物2(C2dat2)通过miR-30d-5p/DDIT4/mTOR轴促进CIRI中胶质细胞自噬和凋亡,表明C2dat2可能是CIRI有前景的治疗靶点。Tu等[12]发现CEBPA反义转录产物1通过靶向miR-340-5p调节APPL1/LKB1/AMPK通路减轻CIRI。此外,Ni等[13]揭示核富集转录产物1(NEAT1)干扰调节小胶质细胞的活化并减少AKT信号和神经元凋亡,提示NEAT1可能是CIRI治疗干预的潜在靶点。本研究在AIS患者溶栓后血清中检测到LINC01116表达升高,与Zhu等[14]报道一致,表明可信度高。另外,最近Zhang等[15]一项研究证实LINC01116在急性髓性白血病患者血清中高表达。以上证据充分说明,LINC01116是一种循环lncRNA,提示其可能作为AIS的新型分子标志物。
胶质细胞广泛参与调控炎症与免疫反应,也对神经发生、血管生成和突触重塑至关重要[16]。本研究采用hHA细胞建立OGD/R,经CCK-8、TUNEL与蛋白质印迹、ROS与LDH检测及ELISA实验发现细胞增殖能力降低,细胞凋亡率升高,激活型caspase-3与Bax蛋白表达升高而Bcl-2蛋白表达降低,ROS生成增加,LDH活性升高,TNF-α、IL-1β及IL-6浓度上调而IL-4、IL-10及IL-13浓度下调。以上结果表明,OGD/R诱导下hHA细胞损伤。有趣的是,还检测到OGD/R中LINC01116表达上调,该结果与AIS患者溶栓后血清LINC01116高表达一致,提示LINC01116在CIRI中可能具有重要作用。
随后进一步检测LINC01116干扰对OGD/R诱导下hHA细胞损伤的影响,发现LINC01116干扰后细胞增殖能力提高,细胞凋亡率下降,激活型caspase-3与Bax蛋白表达降低而Bcl-2蛋白表达升高,ROS生成减少,LDH活性下降,TNF-α、IL-1β及IL-6浓度下调而IL-4、IL-10及IL-13浓度上调,表明LINC01116干扰可抵抗OGD/R诱导下hHA细胞损伤,提示其可能是CIRI治疗的潜在分子靶点。本研究中LINC01116干扰促进细胞增殖并降低细胞凋亡,与其在胶质瘤中报道的作用相悖[17],可能原因是由于hHA细胞与肿瘤细胞的异质性所致,具体原因有待进一步阐明。
越来越多的实验证实,lncRNAs作为ceRNA海绵吸附miRNAs而发挥表观遗传调控作用[18]。目前已报道的受LINC01116调控的miRNAs包括miR-9-5p[8]、miR-93-5p[19]及miR-744-5p[20]等。miR-203是一种高度保守的miRNA,定位于人第14号染色体q32.33区域,与肿瘤进展、2型糖尿病、氧化应激及炎症反应有关[21,22]。最新研究发现,miR-203参与调节心肌缺血再灌注损伤[23]。此外,Zhong等[24]研究发现七氟醚治疗后通过靶向髓样分化因子88上调miR-203表达可以减轻CIRI诱导的神经炎症。以上证据表明,miR-203在CIRI中具有保护作用。本研究发现AIS患者溶栓后血清与OGD/R中miR-203表达下调,且miR-203与LINC01116表达呈负相关,提示miR-203可能受LINC01116调控。进一步经双荧光素酶报告基因与RIP试验证实,LINC01116通过“ATTTCA”序列海绵吸附miR-203,表明miR-203是LINC01116的靶基因。最后通过回补实验发现miR-203干扰逆转LINC01116干扰对OGD/R诱导下hHA细胞损伤的保护作用,该结果与Zhong等[24]报道一致,充分表明LINC01116通过靶向miR-203促进OGD/R诱导下hHA细胞损伤。
综上所述,本研究发现LINC01116在AIS患者溶栓后血清中高表达,LINC01116靶向miR-203促进OGD/R诱导下hHA细胞损伤,表明LINC01116/miR-203通路可能是AIS的潜在治疗靶点。下一步将在大临床样本与动物模型中予以验证,并探讨该通路调控的下游分子。

