HIV低病毒血症的影响因素及其临床意义研究
吕海伟,刘 莉,陈 军,胡静静,卢洪洲
(1.蚌埠医学院,安徽 蚌埠 233030;2.复旦大学附属公共卫生临床中心,上海 201508;3.深圳市第三人民医院,广东 深圳 518000)
艾滋病(acquired immunodeficiency syndrome,AIDS)是人免疫缺陷病毒(Human Immunodeficiency Virus,HIV)感染导致的以细胞免疫受损和缺陷的感染性疾病。虽然目前尚未有彻底治愈AIDS的方法,但抗逆转录病毒治疗(antiretroviral therapy,ART)能够有效抑制HIV复制,最大限度并持久降低患者体内病毒水平,使患者CD4+T淋巴细胞(简称CD4细胞)数量得到有效恢复,以获得免疫重建并维持免疫功能[1]。尽管ART改善了HIV感染者的生存健康状况,但与正常人群相比,HIV感染者的全因死亡率仍偏高[2,3]。
据悉,本项目起点位于藁城西互通(K281+258),向西途经北五女、西兆通,终点与南高营互通衔接(K297+101.679),全长15.844公里。该工程采取半幅断交、半幅双向两车道通行的方式施工。施工期间,施工路段限高2.5米,限速60公里/小时,黄牌货车、危险化学品运输车辆禁止通行。(闫晶)
ART 治疗的目标是将病毒载量(viral load ,VL)抑制到小于50copies/mL甚至检测不到的水平,通常在开始ART后6个月内达到[4]。在长期ART过程中,有些患者仍可检测到一定水平的病毒,这些患者可能出现了低病毒血症(low-level viremia,LLV)。由于担心病毒进化和耐药性的出现,LLV的临床管理仍然具有挑战性。世界卫生组织(WHO)指南对LLV的定义为患者接受至少24周的ART后,连续出现两次或两次以上VL在(50~1 000)copies/ml之间。估计LLV患者患病率在5%~30%[5,6]。病毒控制不良可能增加患者死亡、感染和病毒传播以及耐药的风险[7]。尽管有研究表明发生LLV的机制可能是由于HIV病毒颗粒从潜伏感染细胞中释放或正在进行复制[8]。但目前LLV的临床意义尚不明确,产生机制仍在探讨中。本研究采用回顾性队列研究,纳入长期接受ART的HIV感染者,收集患者社会人口学信息和临床资料,初步分析LLV的流行情况及影响因素。为临床工作提供依据,优化ART方案,避免LLV发生,减少患者和社会因LLV产生的负担。
1 对象与方法
1.1 研究对象 纳入标准:① HIV确诊感染者;②年龄≥18周岁;③ 就诊起始时间为2011年1月1日~2015年12月31日;④ 在上海市公共卫生临床中心进行初始ART。排除标准:① 无VL检测记录;② VL随访检测记录缺失两次及以上;③ 在未出现VL≥50copies/ml之前出现VL≥1000copies/ml;④死亡;⑤ HIV合并多发机会性感染患者。所有数据均通过抗病毒随访数据库收集,包括患者社会人口学信息、初始治疗时是否有合并症、基线VL、CD4细胞计数、ART方案、是否有ART史、确诊HIV感染至开始ART的时间间隔以及从起始ART六个月后至2020年每年一次的VL计数。参考已有文献[9],根据随访期间的VL水平,进一步将LLV分为三类:低水平LLV为50≤VL<200 copies/ml、中水平LLV为200≤VL<400 copies/ml、高水平LLV为400≤VL<1 000 copies/ml。VF定义为患者持续ART 6个月后不能控制病毒复制,包括至少间隔三个月,连续检测两次及以上血浆VL≥1 000 copies/ml。病毒长期抑制定义为患者进行至少6个月ART后血浆 VL 始终 < 50 copies/ml。
1.2 研究对象的筛选及研究指标 筛选纳入研究对象(图1),研究对象分为长期抑制组和LLV组。纳入研究变量包括患者起始ART时年龄、性别、HIV感染途径、基线CD4细胞计数、基线VL、ART期间依从性(在ART期间有中断或停止服药史认为依从性较差)、ART开始时是否有合并症(如发热、腹泻、皮疹、卡氏肺孢子虫肺炎、咳嗽、头痛、咳痰、淋巴结肿大、盗汗、口腔毛状白斑、慢性单纯疱疹病毒感染、呼吸困难、鹅口疮、食管念珠菌感染、尖锐湿疣、梅毒等)、是否有ART史、初治ART方案(见图2)和随访过程中换药次数以及从确诊HIV感染至开始ART的时间间隔。分析LLV的影响因素时,排除在未出现LLV前已出现病毒学失败(VF)的99例患者,在研究LLV对VF的影响时将其重新纳入。
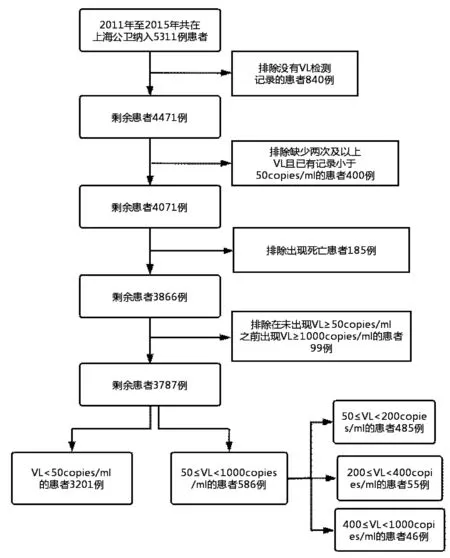
图1 筛选纳入研究对象流程图

图2 两组HIV感染者初始ART方案
采用农药残毒快速检测法对蔬菜产品实行生产至上市全程防污动态监测,层层把关,菜农不用禁用农药、不超标准用药,对用药关键环节、有疑问环节及上市前3个环节实施防污动态监测,严防“毒菜”产生和上市。
2 结果
2.3 LLV对VF的影响 在本研究中,15.47%(586/3787)的参与者至少出现过一次LLV。低水平LLV(50≤VL< 200 copies/ml)、中水平 LLV(200≤ VL < 400 copies/ml)和高水平 LLV(400≤ VL < 1000 copies/ml)组的参与者分别占82.76%(485/586)、9.39%(55/586)和7.85%(46/586)。将抑制组与各水平低病毒血症组进行统计学分析,结果显示,抑制组与各水平低病毒血症组对VF发生差异有统计学意义(P<0.05)。在调整检验水准后,抑制组与低水平LLV组对VF发生差异无统计学意义(P>0.017)。抑制组与中水平LLV组[OR(95% CI):3.96(1.66-9,46)]和高水平 LLV组[OR(95 %CI):3.94(1.53~10.19)]之间对VF差异均有统计学意义(P<0.017)(表3)。由此显示,当LLV患者的VL≥200copies/ml时,LLV是VF的危险因素。
1.3 统计学方法 采用SPSS26.0软件进行统计分析。计量资料采用Shapiro-Wilk test来检验数据是否符合正态分布,若符合正态分布,用(±s)表示,若不符合正态分布,用中位数(四分位数间距)表示。计数资料用n(%)表示,单因素分析采用(χ2检验或Fisher精确检验,将单因素分析中有统计学意义的影响因素纳入logistic回归进行多因素分析,P<0.05认为差异有统计学意义。
当HIV感染者的年龄≥50岁时,更容易出现LLV。这可能由于随着感染者的年龄增长,与身体素质和免疫水平都逐渐下降有关。研究发现较高的基线VL是LLV的影响因素,可能是因为潜伏感染的细胞重新激活是LLV的来源之一[9-11]。较高的VL可产生更大的病毒储存库,因此有更大的能力来释放可检测到的病毒数量[12]。开始ART前基线CD4水平较低和依从性较差可能增加耐药风险从而影响LLV的发生[9,13-15]。初始ART时具有合并症也可能与患者CD4水平较低导致的免疫功能低下有关,从而影响LLV的发生。
2.2 影响LLV的相关因素 本研究结果显示,以下因素对LLV的发生无统计学意义:性别、婚姻状况、感染途径、随访期间是否换药、是否有ART史和从确诊HIV至起始ART的时间间隔。年龄、基线VL、基线CD4细胞计数、依从性、起始ART时是否具有合并症和起始ART方案对LLV的发生有统计学意义(见表1,表2)。基线VL<1×105copies/ml、依从性好、基线CD4≥200个/mm3、起始ART时无合并症和初始ART使用2种核苷类逆转录酶抑制剂+1种非核苷类逆转录酶抑制剂(2 NRTIs +NNRTIs)的感染者更不易出现LLV。与抑制组患者相比,LLV组基线VL≥1×105copies/ml、依从性较差、起始ART时有合并症、初始ART使用LPV/r、基线CD4小于200个/mm3和有换药经历的占比较高,分 别 为(3.16% vs 6.31%)、(0.81 %vs 5.97%)、(23.09%vs 28.33%)、(5.53 %vs 10.58%)、(48.63%vs35.77%)和(33.74% vs 43.52%)。LLV 组 59.73%(350/586)的患者在ART后一年内出现LLV,开始ART一年后LLV的发生呈逐年减少的趋势(见图3)。

表2 病毒抑制组和LLV组患者基本特征及因素多因素logistic回归分析

图3 抗反转录病毒治疗后LLV逐年出现情况分析
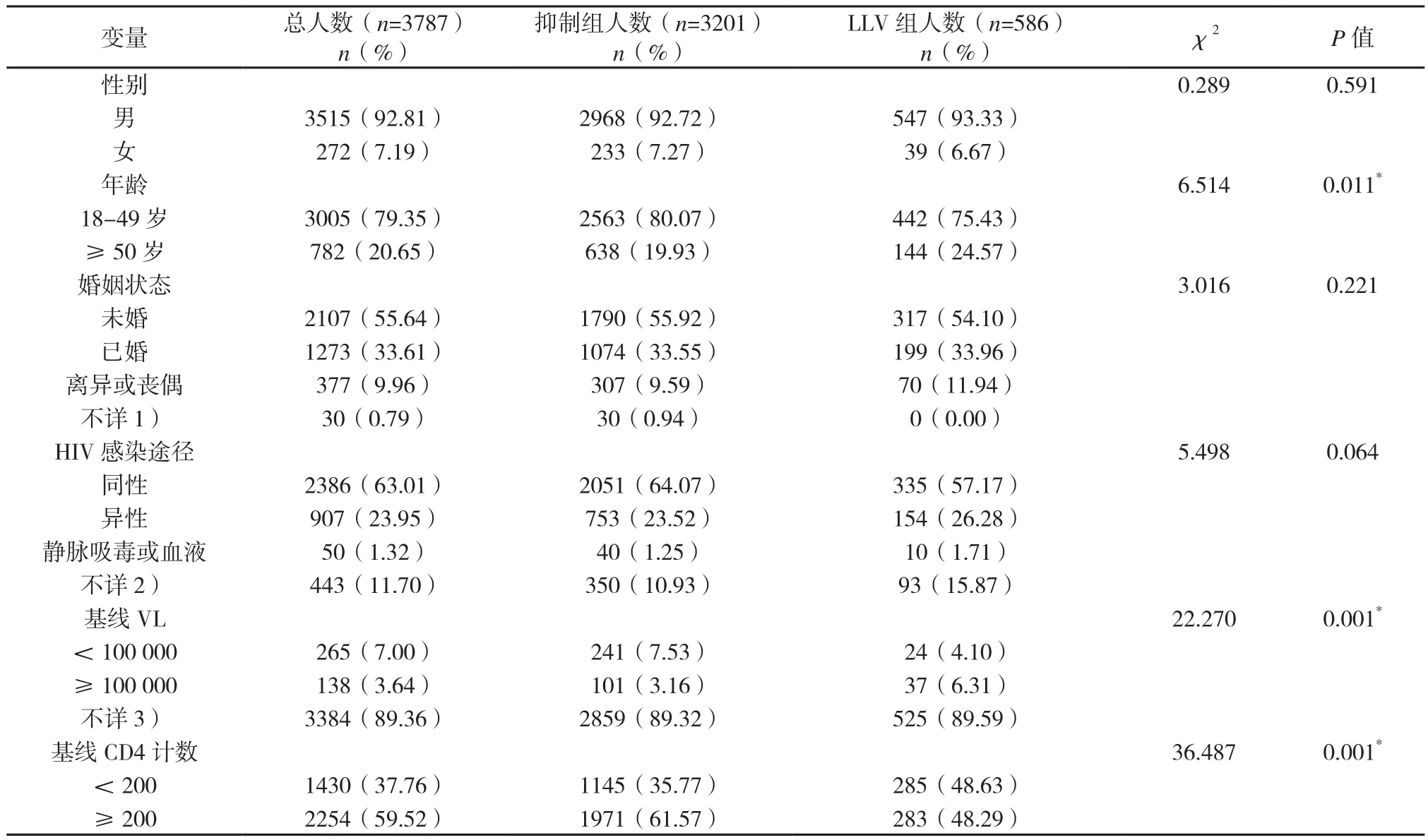
表1 病毒抑制组和LLV组患者基本特征及因素比较
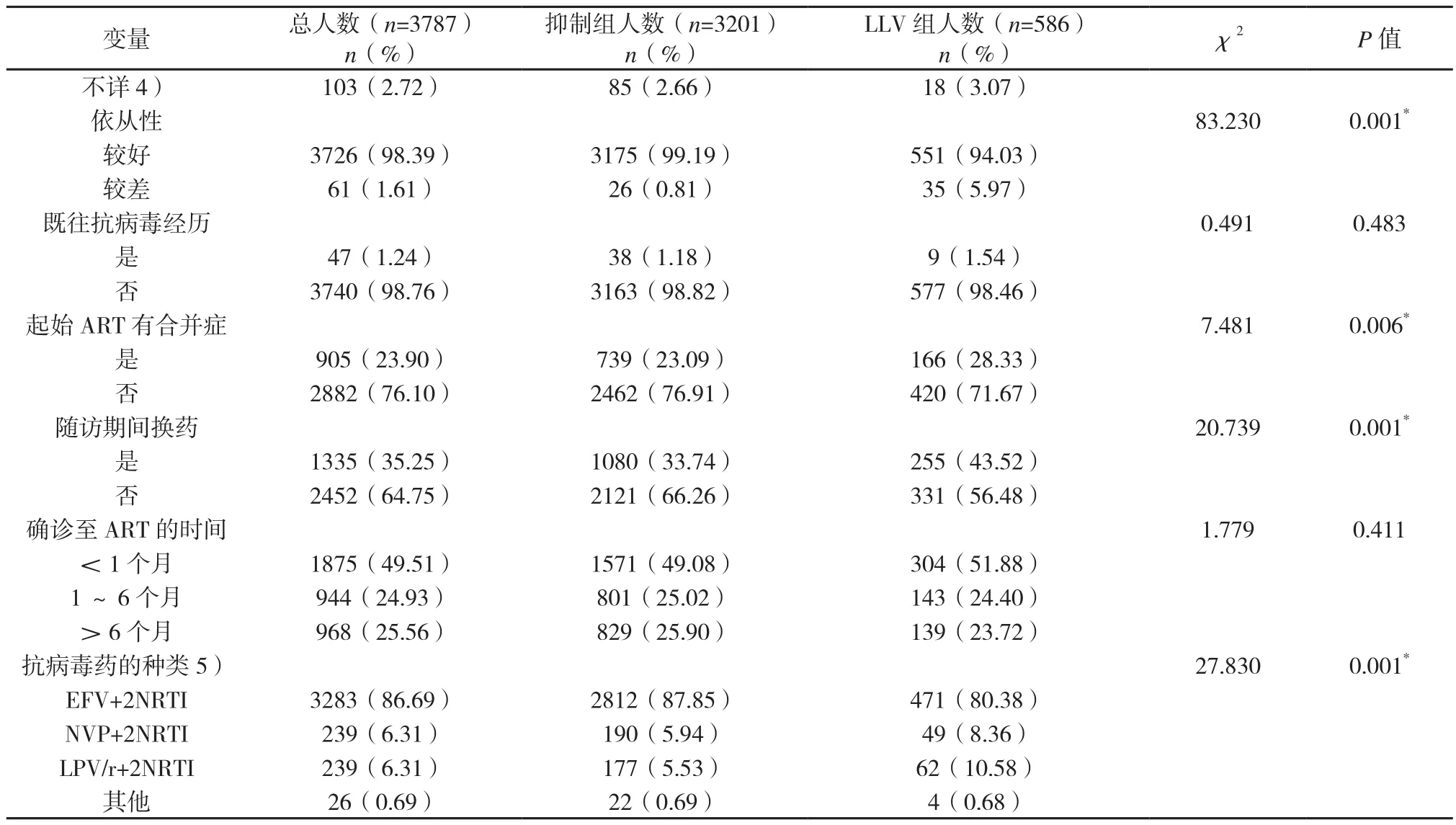
续表1
2.1 队列特征 根据纳入标准,共纳入患者5 311例。首先排除由于数据丢失或死亡而未有VL检测记录的患者840例,进一步排除在开始ART后缺少两次及以上VL记录且已有VL记录<50copies/ml的患者400例,再次排除死亡患者185例以及在未出现LLV就已出现VF的患者99例。共纳入符合标准的研究对象3 787例,抑制组3 201(84.52%)例,LLV组586(15.48%)例,抑制组与LLV组中位年龄分别为34(28,47)岁与35(28,50)岁,男性占比分别为92.72%(2968/3201)与93.34%(547/586),63.01%(2386/3787)为同性性传播感染,86.69%(3283/3787)的患者初始ART时使用EFV+2 NRTIs,6.31%(239/3787)使用 NVP+2 NRTIs,6.31%(239/3787)使用 LPV/r+2 NRTIs。
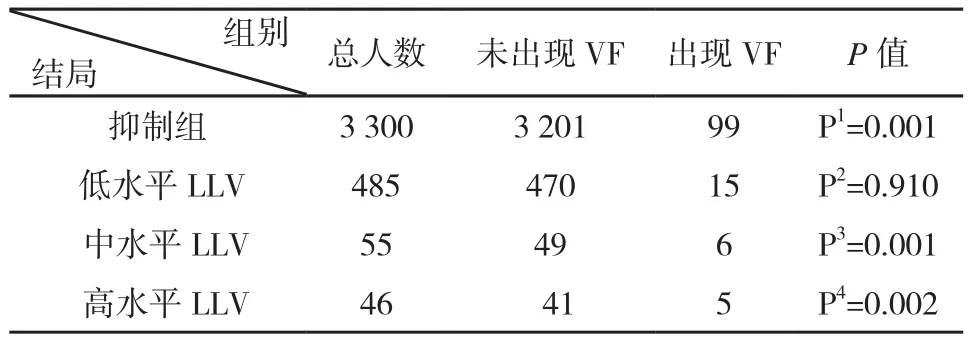
表3 长期病毒抑制组与低病毒血症组及其亚组出现VF的分布情况
3 讨论
本研究通过多年队列随访分析LLV的影响因素及其对VF的影响,研究发现HIV感染者的年龄、基线VL、基线CD4计数、依从性、起始ART时有无合并症和起始ART方案中核心药物可能是影响LLV发生的因素。LLV组59.73% 的患者在开始ART后的一年内出现LLV。当LLV患者VL<200copies/ml时,不会对VF产生影响,但当VL≥200copies/ml时,LLV是VF的危险因素。
进一步考虑工作面来压时6个重点支架循环末阻力超过p、p、p1和p2的超限比例,最终确定支架合理工作阻力。
值得注意的是,在单因素分析中抑制组与LLV组随访期间是否换药这一影响因素差异有统计学意义,但在多因素logistic回归分析中差异无统计学意义,这可能由于其它混杂因素的影响。另外,LLV组59.73%的患者在开始ART后一年内出现LLV,这可能与患者刚开始ART体内的病毒不能被完全抑制有关。因此,应对依从性的挑战,特别是在ART治疗早期,仍是改善病毒抑制目标的关键干预措施。临床医生需密切关注HIV感染者在开始ART后第一年VL的变化,必要时增加检测频率。
我们发现起始ART使用蛋白酶抑制剂(Protease Inhibitors,PIs)可能会增加出现LLV的风险,这进一步证实了PIs会影响LLV发生的文献,美国卫生与人类 服 务 部(Department of Health and Human Services,DHHS)指南中也反映了这一点,该指南不建议使用未增强PIs作为初始方案,而支持使用INSTI和NNRTI[11,16,17]。这可能与 LPV/r的用法用量相关,LPV/r成人需要 2片 /次,2次 /天,相比于 2 NRTIs+ NNRTI(EFV+TDF+3TC)每种药物只需1片 /次,1次/天。这需要患者有更好的依从性,若患者不能准时按量服用药物会增加病毒耐药的风险,这可能进一步解释LLV患者依从性较差的原因,也可能与HIV感染者自身免疫功能较差易导致HIV耐药相关,因此需使用耐药屏障较高的LPV/r,这些可能解释了PIs会增加出现LLV的风险的原因。
随着商业检测变得越来越敏感,了解LLV的意义变得越来越重要。LLV患者的VL在50≤VL<200 copies/ml时,对VF的发生差异无统计学意义,但当LLV组患者VL≥200copies/ml时,LLV是VF的危险因素,这证实并支持LLV应被视为病毒学失败的早期预警信号的证据。由此可见,当LLV患者出现VL<200copies/ml时,应持续关注VL水平,尚不需立即更换ART药物,这为之前的研究提供了证据[9,18-22]。同时也为当前DHHS将VF定义为持续性VL≥200 copies/mL提供了进一步的支持[23]。然而,有研究显示当LLV的VL为(50~200)copies/ml时同样会增加VF的风险,这可能受多方面原因影响。由于目前对VF没有统一的定义,在Gaifer Z的研究中,VF被定义为至少两次连续超200copies/ml的VL,这显然远低于本研究使用的值[7]。因此,未来的研究使用一致的定义是很重要的。
通过对商城县旅游业发展现状的SWOT分析,可以看出,商城县旅游业发展的前景总的来说是机遇与挑战并存。商城县拥有很多得天独厚的优势,同时也面临一定的压力。因此商城县应该充分利用优势,抓住机遇,挖掘市场潜力,开发新的旅游产品和旅游项目,加强与周边地区的合作,提高自身旅游业的综合竞争力。
本研究也存在一定局限性,首先,未对研究人群的合并症、遗传性疾病、其他传染病进行分类分析,在统计分析时未对基线CD4计数、基线VL进行更细划分。其次,本研究只考虑初始ART药物和基线VL对LLV的影响,未将随访时的换药种类以及近两年的VL进行统计分析,这都可能忽略某些LLV的影响因素。最后,本研究HIV感染者随访时VL检测为每年一次,由于时间跨度较大,不太能准确了解感染者短期VL的变化,因此未能分析持续或间歇LLV对VF的影响。
综上,当HIV感染者在开始ART或随访过程中具有上述危险因素时应增加随访次数。通过对不同水平的LLV划分,LLV患者VL≥200copies/ml时出现VF的风险更高,为临床医师治疗HIV LLV患者提供指导依据。

