MCP-1联合CREWS在AECOPD患者不良预后评估中的价值
王晓清, 彭雪梅, 兰美锋, 潘 敏
(川北医学院附属成都新华医院呼吸科,四川 成都 610055)
慢性阻塞性肺疾病(chronic obstructive pulmonary disease,COPD)是一种以持续性、进行性加重的气流受限为特征的呼吸系统疾病,加重与缓解交替出现是COPD常见的临床表现[1]。在寒冷、病原体感染及抵抗力下降等因素刺激下,COPD患者咳嗽、咳痰、气短、喘憋等呼吸症状急性加重被称为慢性阻塞性肺疾病急性加重期(acute exacerbation of chronic obstructive pulmonary disease,AECOPD)[2]。目前,AECOPD的发病机制尚不明确。有研究结果显示,有多种炎症因子参与了AECOPD的病理、生理过程,长期气道炎症可损伤气道黏膜,使气道重塑,肺组织被破坏,最终导致肺功能异常[3]。单核细胞趋化蛋白-1(monocyte chemotactic protein-1,MCP-1)属于C-C亚族趋化因子,通过趋化单核巨噬细胞活性,介导气道炎症反应,在气道重塑中发挥重要作用[4]。有研究发现,MCP-1水平与AECOPD及哮喘急性发作患者肺功能密切相关[5]。慢性呼吸系统早期预警评分(chronic respiratory early warning score,CREWS)是在英国国家早期预警评分的基础上改良过的,能减少对COPD的无意义预警,对AECOPD患者病情及预后具有良好的预测价值[6]。本研究拟探讨MCP-1、CREWS与AECOPD患者疾病严重程度的关系,及其对患者再入院或死亡的预测价值,以期为早期评估和预防AECOPD不良结局提供依据。
1 材料和方法
1.1 研究对象
选取2018年1月—2019年2月于川北医学院附属成都新华医院确诊的AECOPD患者260例,其中男124例、女136例,年龄(63.7±8.8)岁。本研究经川北医学院附属成都新华医院医学伦理委员会审核批准,所有患者均签署知情同意书。
1.2 纳入、排除标准
1.2.1 纳入标准 (1)根据《慢性阻塞性肺疾病诊治指南(2013年修订版)》[7]确诊为COPD:伴有呼吸困难、慢性咳嗽、咳痰等症状,且有吸烟、接触空气污染等危险因素暴露史,肺功能检查提示使用支气管舒张剂后1 s用力呼气容积(forced expiratory volume in one second,FEV1)占最大肺活量(forced vital capacity,FVC)的比例<70%。AECOPD诊断采用Anthonisen标准[8]:有痰量增加、咳脓性痰和呼吸困难中任意1项及以上症状,并在过去5 d内伴有1项及以上次要症状(上呼吸道感染、无原因发热、胸闷、流涕);(2)无其他感染性疾病;(3)3个月内未采取抗炎药物及免疫抑制剂治疗。
1.2.2 排除标准 (1)合并支气管扩张症、哮喘、肺结核、弥漫性泛细支气管炎、闭塞性细支气管炎等其他慢性肺疾病;(2)有充血性心力衰竭等严重并发症;(3)合并自身免疫性疾病、出血性疾病;(4)处于妊娠期或哺乳期;(5)合并肝、肾等其他重要脏器功能衰竭;(6)病例资料不全。
1.3 方法
1.3.1 一般资料收集 统一培训所有参与资料收集的人员。使用统一的登记表收集所有患者入院24 h内的基本临床资料,收集内容包括年龄、性别、病程、体质量指数(body mass index,BMI)、血压、心率、呼吸频率、肺功能分级、吸烟史、糖尿病史、高血压史。
1.3.2 样本采集及MCP-1检测 采集患者入院次日清晨空腹静脉血4 mL,室温静置20 min后,1 510×g离心10 min,分离血清,-80 ℃保存待测。采用酶联免疫吸附试验(enzymelinked immunosorbent assay,ELISA)检测血清MCP-1,试剂盒购自美国R&D公司[试剂盒的检出限为5.56 ng/L,线性范围为10.5~1 000.0 ng/L,变异系数(coefficient of variation,CV)为2.7%,标准曲线r2=0.994],检测仪器为Microlab STAR多功能酶标仪(瑞士Hamilton公司)。严格按试剂和仪器说明书进行操作。
1.3.3 CREWS CREWS系统[9]由体温、脉搏、收缩压、呼吸频率、血氧饱和度、意识水平、是否吸氧7项指标组成,其中是否吸氧根据英国胸科协会成人急诊吸氧指南[10]要求进行判断,若需吸氧,血氧饱和度需在吸氧状态下进行测量。是否吸氧指标为0~2分,其他指标均为0~3分,CREWS总分为0~20分。
1.4 随访
追踪患者住院期间及出院后1年内的预后情况,根据是否发生AECOPD相关性死亡或是否因再发COPD住院,将患者分为预后不良组和预后良好组。以患者因COPD再发入院、死亡或随访结束作为终点,随访截止时间为2020年5月28日。
1.5 统计学方法
采用SPSS 19.0软件进行统计分析。呈正态分布的计量资料以±s表示,2个组之间比较采用独立样本t检验。计数资料以例或率表示,组间比较采用χ2检验。采用多因素Cox回归分析评估AECOPD患者不良预后的危险因素,将中位数作为计数资料转换为等级资料的分界点。采用受试者工作特征(receiver operating characteristic,ROC)曲线评价各项指标判断AECOPD患者预后不良(再入院或死亡)的效能。采用Kaplan-Meier生存曲线评估AECOPD患者的无事件生存情况,采用Log-rank检验比较各组无事件生存率。以P<0.05为差异有统计学意义。
2 结果
2.1 预后不良组和预后良好组各项指标比较
预后不良组肺功能分级Ⅲ~Ⅳ级比例、MCP-1水平及CREWS显著高于预后良好组(P<0.05),其他指标2个组之间差异均无统计学意义(P>0.05)。见表1。
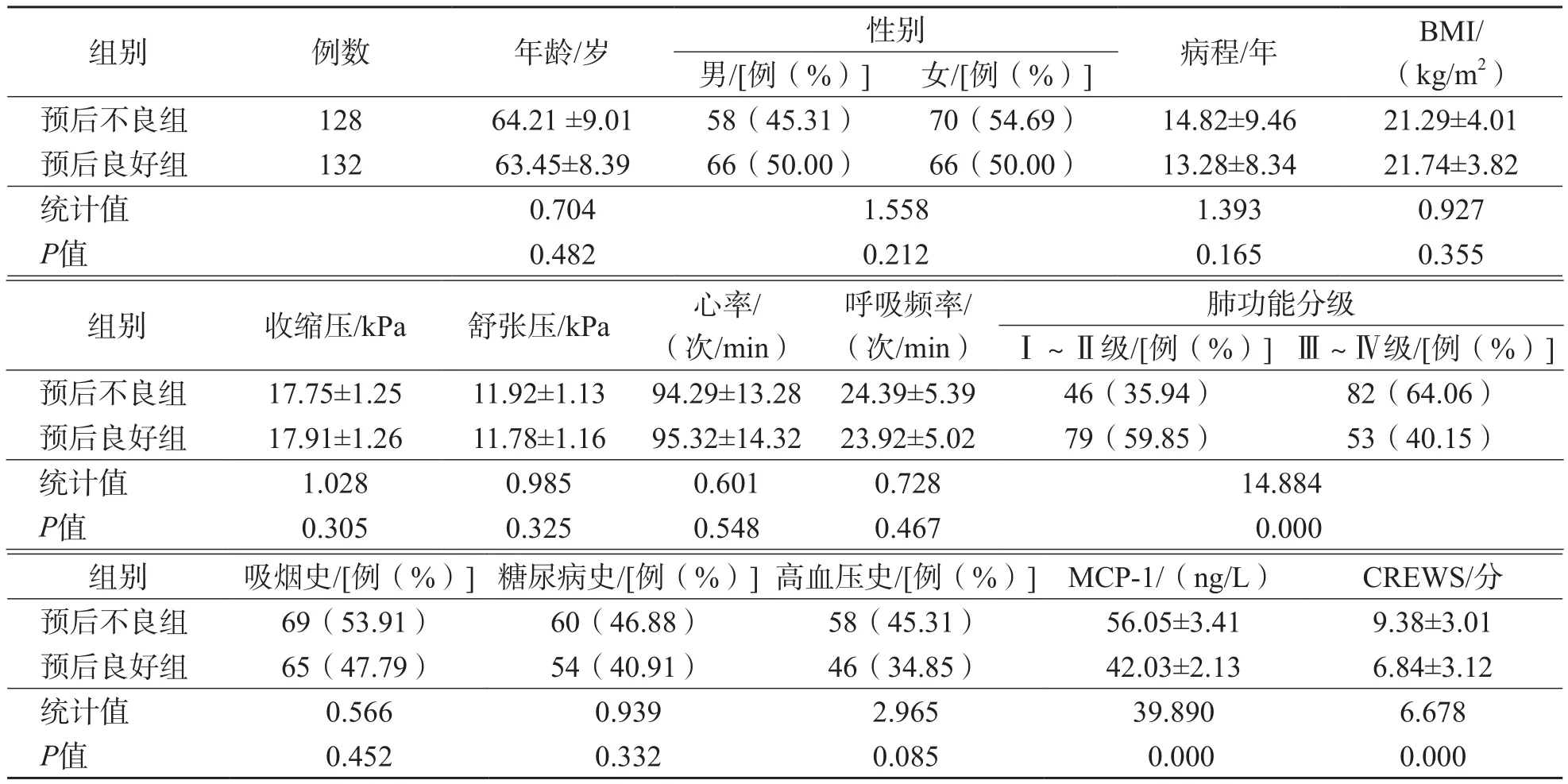
表1 预后不良组和预后良好组各项指标比较
2.2 AECOPD患者预后不良的危险因素
将预后不良组与预后良好组之间差异有统计学意义的因素(肺功能分级、MCP-1、CREWS)纳入多因素Cox回归分析。结果显示,肺功能分级、MCP-1、CREWS均为AECOPD患者预后不良的危险因素[比值比(odds ratio,OR)值分别为3.045、1.683、1.423,95%可信区间(confidence interval,CI)分别为1.467~4.638、1.132~4.248、1.138~1.865]。见表2。
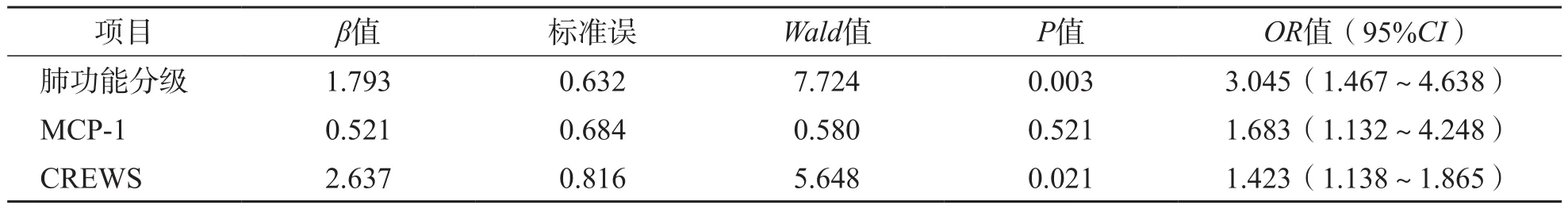
表2 AECOPD患者预后不良多因素Cox回归分析
2.3 MCP-1和CREWS单项检测及联合检测判断AECOPD患者预后不良的效能
采用二元回归分析得出MCP-1、CREWS联合检测方程为:Logit(P)= -0.586+0.25×MCP-1+0.032×CREWS。ROC曲线分析结果显示,MCP-1和CREWS单项检测及联合检测判断AECOPD患者预后不良(再入院或死亡)的曲线下面积(area under curve,AUC)分别为0.823、0.881、0.912,最佳临界值分别为42.19 ng/L、6分、0.48。见表3、图1。
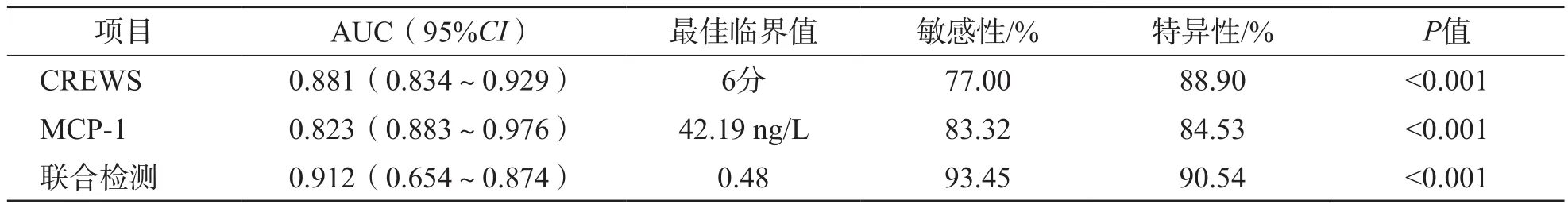
表3 MCP-1和CREWS单项检测及联合检测判断AECOPD患者预后不良的ROC曲线参数
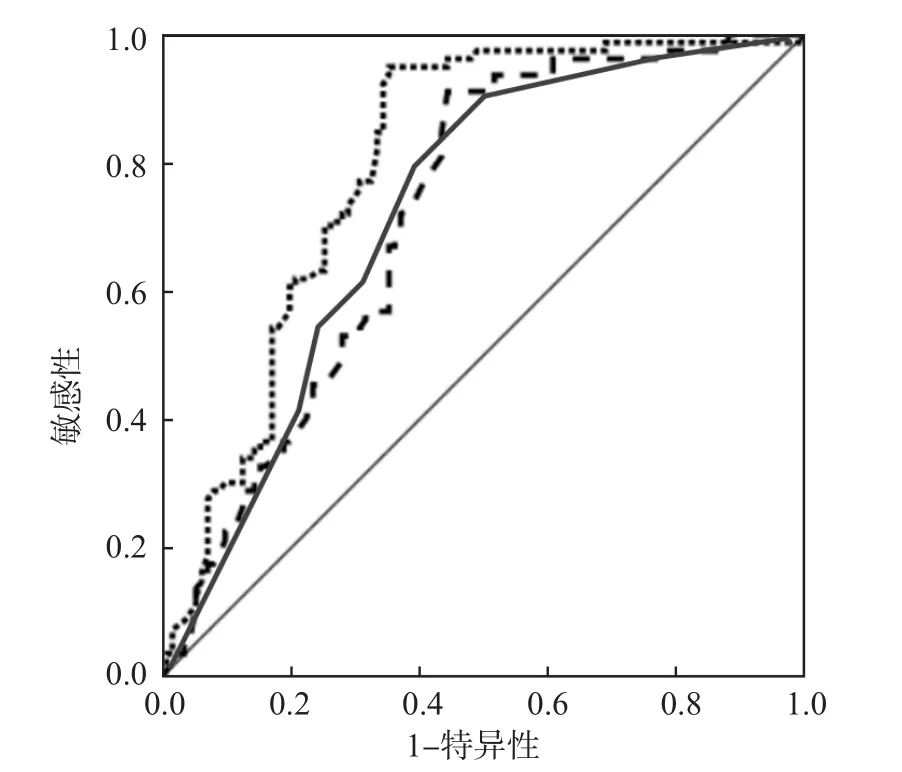
图1 MCP-1和CREWS单项检测及联合检测判断AECOPD患者预后不良的ROC曲线
2.4 MCP-1联合CREWS对AECOPD患者不良预后的影响
根据CREWS和MCP-1的最佳临界值,将CREWS<6分且MCP-1<42.19 ng/L的AECOPD患者归入低危组(78例),CREWS≥6分且MCP-1≥42.19 ng/L的AECOPD患者纳入高危组(87例),其他AECOPD患者纳入中危组(95例)。Kaplan-Meier生存曲线分析结果显示,低危组、中危组和高危组无事件生存率分别为92.31%、85.26%和78.16%,3个组之间无事件生存率差异均有统计学意义(χ2=9.383,P<0.001)。见图2。

图2 低危组、中危组和高危组的Kaplan-Meier生存曲线
3 讨论
慢性气道炎症被认为是导致气道重构、进行性气道阻塞及肺部病变的重要原因[10]。潜在的气道持续性炎症使COPD患者极易受微生物感染、烟草烟雾及其他有害颗粒的影响,使炎性细胞增多并释放相关蛋白水解酶,外周血中的炎症因子因此进入肺内,产生炎症放大效应,降低患者的免疫力,使气道黏液分泌物增多,肺实质被破坏,肺结构发生改变,出现小气道狭窄、阻力增加,从而发生进行性气流受限,严重者会发生呼吸功能衰竭,甚至死亡[11]。
MCP-1是一种含有7个跨膜区的G蛋白偶联受体,是趋化因子家族成员之一,可趋化单核细胞,并诱导多种炎性细胞向病变部位集聚,释放炎症因子[12]。有研究发现,高水平MCP-1可导致肺动脉内膜增厚,在血管平滑肌细胞增殖中也发挥着重要作用[13]。有研究结果显示,AECOPD患者MCP-1水平高于稳定期COPD患者(P=0.000),且呼吸衰竭组MCP-1水平高于无呼吸衰竭组(P=0.000)[14]。BIAN等[15]将AECOPD患者分为门诊组、入住普通病房组和入住重症监护病房组,结果显示3个组之间MCP-1水平差异均有统计学意义(P=0.000)。MOHAMED等[16]认为,MCP-1或可作为AECOPD患者病情加重的预测指标。本研究结果显示,MCP-1水平升高是AECOPD患者预后不良(再入院或死亡)的危险因素(OR=1.683,95%CI为1.132~4.248),提示MCP-1在一定程度上可反映AECOPD患者病情的严重程度。
CREWS在评估AECOPD患者死亡或预后方面具有中高程度的预测效能[17],但由于其评分指标依赖于患者的配合程度,因此敏感性稍差。本研究结果显示,CREWS升高是AECOPD患者预后不良(再入院或死亡)的危险因素(OR=1.423,95%CI为1.138~1.865)。
本研究ROC曲线分析结果显示,MCP-1和CREWS单项检测及联合检测判断AECOPD患者预后不良(再入院或死亡)的AUC分别为0.823、0.881、0.912。根据ROC曲线分析得出的CREWS和MCP-1的最佳临界值,本研究对AECOPD患者进行分层分析,结果显示,高危组无事件生存率显著低于低危组和中危组(P<0.001),提示MCP-1或可弥补CREWS的缺点,二者联合检测有助于提高判断AECOPD患者不良预后的效能。由于COPD是由多种炎症介质共同参与的病理过程,但本研究未纳入白细胞介素6、血清淀粉样蛋白A等其他炎症因子进行分析,因此结果可能会受一定的影响。后续研究将纳入更多可能影响AECOPD预后的指标进行分析。
综上所述,MCP-1水平和CREWS对AECOPD患者不良预后有一定的预测价值,二者联合应用预测价值更高。

