MUC16对骨肉瘤细胞增殖和侵袭能力的影响
李名武, 王勤志, 孙法瑞
(鄂东医疗集团市 黄石市中心医院 湖北理工学院附属医院骨科,湖北 黄石 435000)
骨肉瘤好发于儿童和青少年人群,随着治疗方法的不断改进,患者生存率有所提高[1],但由于骨肉瘤的侵袭性强、复发率高、易早期发生远隔转移,使得患者总体预后仍然较差[2]。黏蛋白16(mucin 16,MUC16)是黏蛋白家族成员,在上皮保护和修复中发挥着重要作用,与信号通路传导调控及免疫应答关系密切[3]。有研究发现,MUC16参与了卵巢癌[4]、胆囊癌[5]、子宫内膜癌[6]、肺癌[7]等多种恶性肿瘤的发生、发展过程。然而,关于MUC16与骨肉瘤关系的研究较少。为此,本研究拟探讨MUC16对人骨肉瘤细胞系U2OS增殖和侵袭能力的影响。
1 材料和方法
1.1 仪器与试剂
人骨肉瘤细胞系U2OS购自上海通派生物科技有限公司,McCoy's 5A培养液购自上海研生生物技术科技有限公司,胎牛血清、胰蛋白酶、青霉素、链霉素均购自美国Gibco公司。MUC16干扰序列和对照序列由上海美轩生物科技有限公司设计合成。Lipofectamine 2000脂质体转染试剂和Trizol提取试剂均购自美国Invitrogen公司,逆转录和聚合酶链反应(polymerase chain reaction,PCR)扩增试剂购自宝生物工程(大连)有限公司,MUC16和内参引物序列由生工生物工程(上海)股份有限公司设计合成。噻唑蓝(methyl thiazolyl tetrazolium,MTT)购自上海科华生物工程股份有限公司,二甲基亚砜(dimethyl sulfoxide,DMSO)购自北京博润莱特科技有限公司,Transwell小室购自美国Corning公司,基质胶购自美国BD公司。兔抗人MUC16单克隆抗体购自英国Abcam公司,兔抗人上皮型钙黏蛋白(epithelial-cadherin,E-Cad)多克隆抗体、兔抗人神经型钙黏蛋白(neuropathic-cadherin,N-Cad)单克隆抗体均购自美国Santa Cruz公司。StepOne实时荧光定量PCR仪购自美国ABI公司,DP-6100型酶标仪购自北京亚欧德鹏科技有限公司。
1.2 方法
1.2.1 细胞培养 采用含10%胎牛血清的McCoy's 5A培养液于37 ℃、5% CO2条件下培养U2OS细胞。培养24 h后,用胰蛋白酶消化,传代培养。取对数生长期细胞,用胰蛋白酶消化,接种于6孔板,密度为2.5×106/孔,待细胞融合度为80%以上时,按Lipofectamine 2000脂质体转染试剂说明书对细胞进行分组转染。(1)sh-MUC16组:转染MUC16干扰序列sh-1(5'-ACAGCAGCATCAAGAGTTATT-3')、si-2(5'-GGAGCAAGTCTTTCTAGATAA-3');(2)sh-Control组:转染阴性对照序列(5'-GGAATCTCATTCGATGCATAC-3');(3)空白组:不作任何处理。转染后继续培养48 h。
1.2.2 实时荧光定量PCR检测MUC16 mRNA表达 取各组转染后培养48 h的U2OS细胞,胰蛋白酶消化,加入细胞裂解液,采用Trizol提取试剂提取总RNA,采用UV-1801紫外/可见分光光度计(北京瑞利分析仪器公司)检测纯度和浓度,以吸光度(A)260nm/A280nm比值>1.80为合格。采用逆转录试剂将RNA逆转录为互补DNA(complementary DNA,cDNA),以cDNA为模板进行扩增。PCR条件:94 ℃ 3 min;94 ℃ 30 s,62 ℃ 30 s,74 ℃ 30 s,36个循环;74 ℃延长3 min。每份样本设6个复孔。MUC16上游引物为5'-ACATCAACTCCTGCCTTCCCAGAA- 3',下游引物为5'-ACCAGTGGGCATTCCAGAAAGAGA-3';β-actin上游引物为5'-TCCCTGGAGAAGAGCTACG-3',下游引物为5'-GTAGTTTCGTGGATGCCACA-3'。采用2-ΔΔCt法计算MUC16 mRNA相对表达量。
1.2.3 U2OS细胞增殖活性检测 采用MTT法检测U2OS细胞增殖活性。取各组U2OS细胞,胰蛋白酶消化,接种于96孔板,密度为5 000个/孔,继续培养,分别于12、24、48、72和96 h时每孔加入20 μL MTT液(5 mg/mL),继续培养4 h,小心弃去培养液,加入150 μL DMSO,充分振荡5 min,使结晶充分溶解后,采用DP-6100型酶标仪测定各孔490 nm波长处的A值。重复3次。
1.2.4 细胞迁移实验 取各组转染后培养48 h的U2OS细胞,胰蛋白酶消化,磷酸盐缓冲液冲洗3次,离心取沉淀,用不含血清的培养液重悬,取200 μL(约1×105个细胞)置于Transwell小室的上室,下室加入含血清的完全培养液600 μL,培养24 h,去除散落细胞,用甲醛固定,结晶紫染色,用CKX53型显微镜(日本 OLYMPUS公司)观察,随机取5个高倍镜视野计数穿膜细胞数。
1.2.5 细胞侵袭实验 取基质胶50 μL,稀释后均匀涂抹在Transwell小室上室,过夜风干备用。其他实验步骤同“细胞迁移实验”。
1.2.6 U2OS细胞MUC16、E-Cad和N-Cad表达 采用免疫印迹法检测U2OS细胞的蛋白表达。取各组转染后培养48 h的U2OS细胞,胰蛋白酶消化,收集U2OS细胞并置于裂解液中,提取总蛋白,采用二喹啉甲酸(bicinchoninic acid,BCA)法定量测定。取50 μg总蛋白,采用10%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳进行分离,电转至聚偏二氟乙烯(polyvinylidene fluoride,PVDF)膜,5%脱脂奶粉封闭60 min,分别加入兔抗人MUC16单克隆抗体(1∶500稀释)、兔抗人E-Cad多克隆抗体(1∶1 000稀释)、兔抗人N-Cad单克隆抗体(1∶800稀释),4 ℃过夜孵育,三羟甲基氨基甲烷-吐温缓冲液冲洗3次,加入辣根过氧化物酶标记二抗(青岛捷世康生物科技有限公司),室温孵育120 min,采用化学发光法显影,采用Image J图像分析软件(美国国立卫生研究院)进行分析,以甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)为内参蛋白,计算MUC16、E-Cad和N-Cad的相对表达量。
1.3 统计学方法
采用SPSS 17.0软件进行统计分析。呈正态分布的计量资料以±s表示,多组间比较采用单因素方差分析,两两比较采用LSD-t检验。以P<0.05为差异有统计学意义。
2 结果
2.1 sh-MUC16组、sh-Control组和空白组MUC16 mRNA表达比较
sh-MUC16组、sh-Control组和空白组之间MUC16 mRNA相对表达量差异有统计学意义(F=106.005,P<0.001)。sh-MUC16组MUC16 mRNA相对表达量(0.33±0.09)显著低于sh-Control组(1.03±0.12)和空白组(1.00±0.07)(P<0.05),而sh-Control组与空白组之间差异无统计学意义(P>0.05)。
2.2 sh-MUC16组、sh-Control组和空白组细胞增殖活性比较
sh-MUC16组培养24、48、72和96 h细胞增殖活性(A值)低于sh-Control组和空白组(P<0.05)。见表1、图1。
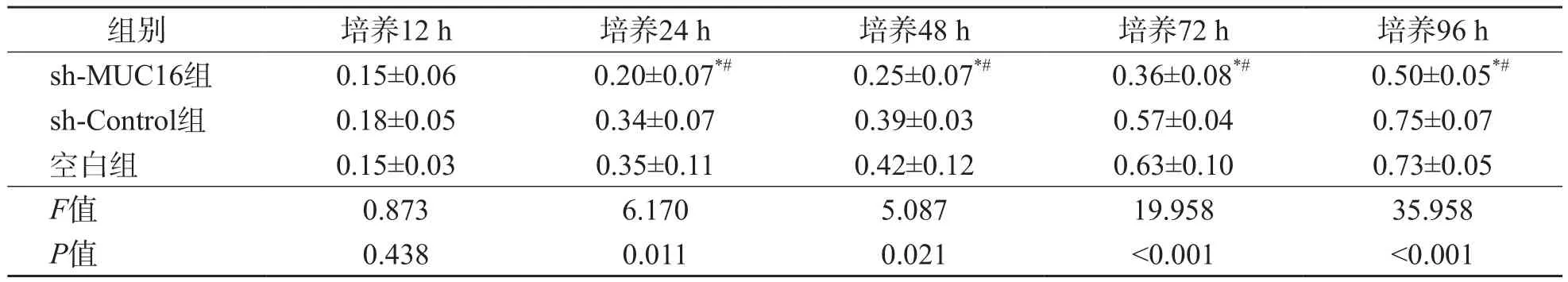
表1 sh-MUC16组、sh-Control组和空白组培养不同时间细胞增殖活性(A值)比较
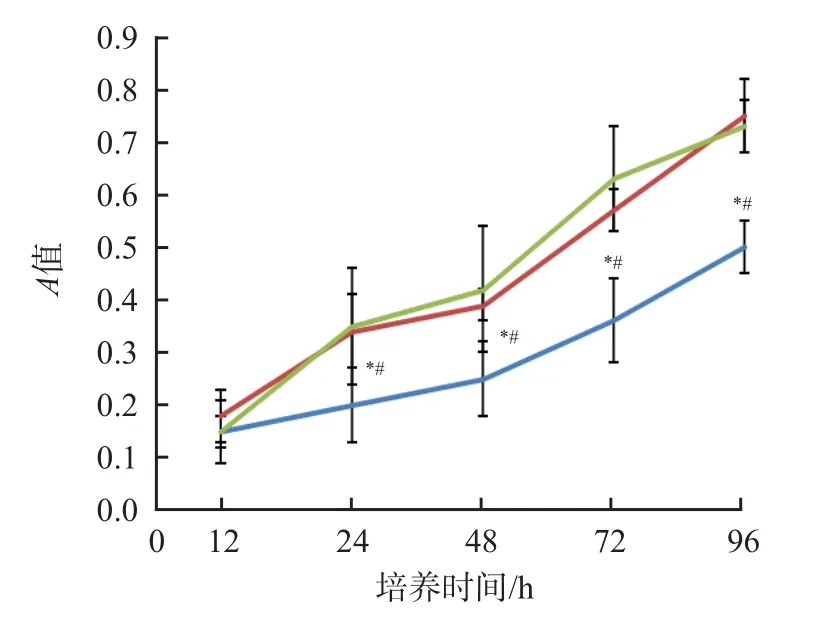
图1 sh-MUC16组、sh-Control组和空白组培养不同时间细胞增殖活性(A值)比较
2.3 sh-MUC16组、sh-Control组和空白组细胞迁移和侵袭能力比较
sh-MUC16组迁移和侵袭细胞数均低于sh-Control组和空白组(P<0.05)。见表2、图2和图3。

表2 sh-MUC16组、sh-Control组和空白组细胞迁移和侵袭细胞数比较
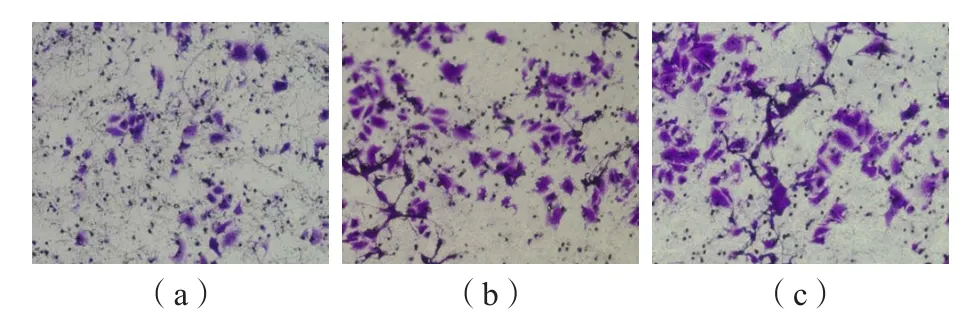
图2 sh-MUC16组、sh-Control组和空白组细胞迁移情况(×200)

图3 sh-MUC16组、sh-Control组和空白组细胞侵袭情况(×200)
2.4 sh-MUC16组、sh-Control组和空白组MUC16、E-Cad和N-Cad表达比较
sh-MUC16组MUC16和N-Cad相对表达量均低于sh-Control组和空白组(P<0.05),E-Cad相对表达量高于sh-Control组和空白组(P<0.05)。sh-Control组与空白组之间MUC16、E-Cad和N-cad相对表达量差异均无统计学意义(P>0.05)。见表3、图4。
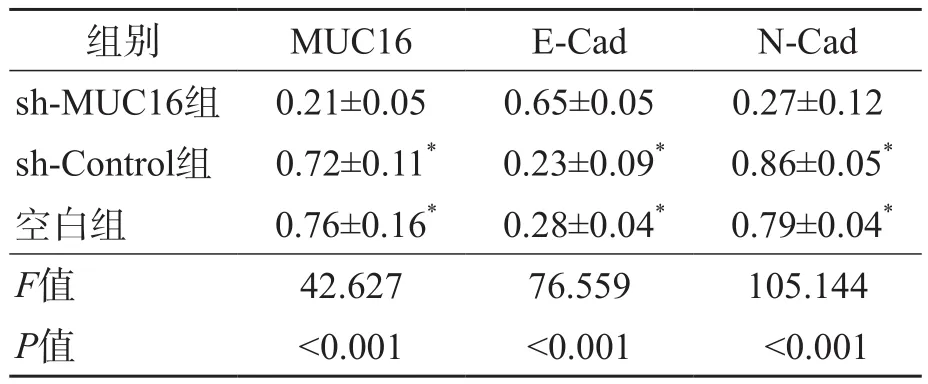
表3 3个组MUC16、E-Cad和N-Cad相对表达量比较

图4 3个组MUC16、E-Cad和N-Cad表达免疫印迹图
3 讨论
骨肉瘤是一种起源于间充质细胞的恶性肿瘤,临床目前以手术切除辅以化疗的综合治疗方案为主,但复发率、转移率高[8]。随着分子生物学技术的发展,从分子生物学角度寻找与骨肉瘤发生、发展相关的敏感基因,为肿瘤的早期诊疗及改善预后提供了新的方向。
黏蛋白作为一种高相对分子质量、高度糖基化的蛋白,参与了疾病的发生、发展,且与肿瘤发生密切相关[9]。MUC16蛋白是黏蛋白家族中最大的一种,定位于人染色体19p13.2,其阳性表达可促进胆囊癌的发生,与胆囊癌的恶性程度和浸润程度密切相关,可作为胆囊癌的标志物[10]。另外,MUC16还与多种肿瘤相关,可促进肺腺癌细胞侵袭转移[11],也可作为卵巢癌重要的免疫治疗靶基因[12]。本研究通过转染干扰序列的方法特异性沉默U2OS细胞中MUC16基因的表达。结果显示,sh-MUC16组MUC16 mRNA和蛋白表达量均低于sh-Control组和空白组(P<0.05),说明sh-MUC16组MUC16表达被成功抑制。有研究结果显示,MUC16过表达可赋予上皮来源的肿瘤细胞抗凋亡的能力[13]。本研究结果显示,sh-MUC16组培养24、48、72和96 h细胞增殖活性低于sh-Control组和空白组(P<0.05),说明沉默U2OS细胞的MUC16基因表达可抑制细胞增殖活性,提示MUC16可能参与了骨肉瘤细胞的增殖过程。KANWAL等[14]发现,MUC16基因过表达可促进肺癌细胞的增殖、迁移和侵袭。本研究结果显示,sh-MUC16组迁移和侵袭细胞数均低于sh-Control组和空白组(P<0.05),说明沉默U2OS细胞中的MUC16基因表达可抑制细胞迁移和侵袭,提示MUC16与骨肉瘤细胞迁移和侵袭有关。
目前,关于MUC16参与恶性肿瘤发生、发展的机制研究较多。SHEN等[15]的研究结果显示,MUC16通过Janus激酶2(Janus kinase 2,JAK2)/信号转录和转录激活因子3(signal transducer and activator of transcription 3,STAT3)磷酸化介导的环氧合酶-2表达增强了宫颈癌细胞的增殖和侵袭能力。李新等[16]的研究结果表明,MUC16通过磷酸肌醇3-激酶/蛋白激酶B通路调节胆囊癌细胞的增殖和迁移。MUC16的C'端通过与β-连环蛋白的相互作用激活Wnt信号通路,促进肿瘤的发生和转移[17]。上皮-间质转化在骨肉瘤细胞的增殖、侵袭中发挥了重要作用[18],而在这个过程中,上皮标志物E-Cad表达减少,间充质标志物N-Cad表达增多,从而使骨肉瘤细胞的迁移能力更强[19]。本研究结果显示,sh-MUC16组N-Cad相对表达量低于sh-Control组和空白组(P<0.05),而E-Cad相对表达量高于sh-Control组和空白组(P<0.05),说明沉默U2OS细胞中的MUC16基因表达可抑制上皮-间质转化。
本研究尚有不足之处:(1)未设计干扰后恢复表达的实验;(2)仅选用了1株细胞,未用第2株骨肉瘤细胞进行验证;(3)未深入探讨MUC16的具体作用过程及涉及的信号通路。下一阶段将开展多株骨肉瘤细胞的研究,同时对可能涉及的机制开展进一步的验证性研究。
综上所述,沉默U2OS细胞中的MUC16基因表达可抑制细胞增殖活性,减少细胞迁移和侵袭,其机制可能与抑制上皮-间质转化有关。

