基于外周血炎症指标的列线图模型早期诊断新生儿败血症的价值
何学联, 何子翼, 刘月阳, 余炎芝, 张思颖
(1.重庆大学附属涪陵医院儿科,重庆 408000;2.重庆市妇幼保健院质量管理科,重庆 401120)
新生儿败血症是指新生儿在宫内、分娩过程中或出生后与外界环境接触发生局部感染,进而迅速发展为全身性感染的严重感染性疾病,极易继发感染性休克、多器官功能损伤、弥散性血管内凝血等危重症状,是导致新生儿死亡的主要原因之一[1]。随着医疗技术水平的发展,我国败血症的整体发病率已被降低至0.1%~1.0%,但新生儿败血症的病死率仍高达13%~50%[2]。新生儿免疫功能尚不完善,易通过多种途径受到感染,感染后败血症的发生率也较高。患儿在感染初期通常无明显的临床症状[3],合并早产、难产等特殊情况时易出现漏诊、误诊,当临床确诊时可能已经错过最佳治疗期[4]。因此,尽早对败血症作出诊断并给予相应治疗是降低新生儿死亡率的关键。目前,临床主要通过血培养来诊断新生儿败血症[5],这也是公认的诊断金标准,但病原菌培养需要耗费较长时间才能获得结果,且结果呈假阴性的情况较多,易受抗菌药物干扰,不利于快速诊断[6]。C反应蛋白(C-reactive protein,CRP)和降钙素原(procalcitonin,PCT)是与感染和炎症密切相关的指标,已被广泛用于感染的诊断[7]。白细胞介素6(interleukin-6,IL-6)参与了机体的免疫调节与炎症反应,对感染相关因素高度敏感[8],因此IL-6可用于新生儿败血症的早期诊断[9]。本研究拟通过检测败血症患儿血常规指标、CRP、PCT和IL-6水平,分析新生儿发生败血症的独立危险因素,同时建立列线图模型,以期能对新生儿败血症的早期诊断提供新的思路。
1 材料和方法
1.1 研究对象
选取2017年7月—2021年1月在重庆大学附属涪陵医院和重庆市妇幼保健院分娩并确诊为败血症的新生儿137例,其中男75例、女62例。诊断标准参照文献[10],出生3 d内存在异常临床表现且符合以下任意1项:(1)血液非特异性项目≥2项阳性;(2)脑脊液检查为化脓性脑膜炎改变;(3)血液中检出致病菌DNA。随机选取96例败血症患儿作为败血症组,其中男52例、女44例,体质量(3.10±0.73)kg,胎龄(38.24±1.76)周;另41例患儿纳入模型验证组,其中男23例、女18例,体质量(3.08±0.54)kg,胎龄(38.43±1.62)周。选取重庆大学附属涪陵医院和重庆市妇幼保健院同期分娩且需住院的114例非感染新生儿,其中男68例、女46例,包括早产儿39例、高胆红素血症53例、咽下综合征22例。排除标准:(1)患有地中海贫血等先天性疾病;(2)采血前已接受抗菌药物治疗。随机选取其中96例作为对照组,其中男57例、女39例,体质量(3.05±0.79)kg,胎龄(38.46±1.25)周;另18例纳入模型验证组,其中男11例、女7例,体质量(3.09±0.49)kg,胎龄(38.31±1.28)周。模型验证组共59例,败血症患儿与非感染新生儿比例为7∶3。各组间性别、体质量和胎龄差异均无统计学意义(P>0.05)。
1.2 方法
收集所有患儿的临床资料,包括性别、体质量、胎龄、住院天数、预后情况。在无菌环境下采集败血症患儿出生后24 h内且未经药物治疗的外周静脉血5 mL,其中2 mL用于血培养,3 mL用于其他各项指标的测定。采集非感染新生儿外周静脉血3 mL。采用XN-3000全自动血液分析仪(日本Sysmex公司)及配套试剂检测血常规指标[白细胞(white blood cell,WBC)计数、血红蛋白(hemoglobin,Hb)、血小板(platelet,PLT)计数、淋巴细胞百分比(lymphocyte percentage,LYMPH%)、中性粒细胞百分比(neutrophil percentage,NEUT%)、血细胞比容(hematocrit,HCT)]。采用PA990全自动生化分析仪(广东普门公司)及配套试剂检测CRP水平。采用cobas e411全自动电化学免疫分析仪(瑞士罗氏公司)及配套试剂(电化学发光法)检测血清PCT、IL-6水平。完成检测后,标记剩余的血液,离心后于-80 ℃冷冻保存。新生儿败血症各项指标的阳性判定标准为:血培养阳性;WBC计数≥20×109/L或WBC计数≤5×109/L;PLT计数≤100×109/L;CRP≥8 mg/L;PCT≥2 μg/L;IL-6≥86.16 pg/L。
1.3 统计学方法
采用SPSS 22.0软件进行统计分析。呈正态分布的计量资料以±s表示,2个组之间比较采用t检验。计数资料以例或率表示,组间比较采用χ2检验。采用Logistic回归分析评估新生儿败血症发生的危险因素。采用R 4.0.2软件建立列线图模型,采用受试者工作特征(receiver operating characteristic,ROC)曲线和决策曲线分别评价列线图模型的诊断效能和临床净获益率,采用校准曲线和偏差校正C-index评价列线图模型的实用性。采用X-tile 3.6.1软件获取列线图模型积分临界值,采用Kaplan-Meier生存曲线和Log-rank时序检验评价不同风险组的败血症发生率。以P<0.05为差异有统计学意义。
2 结果
2.1 败血症组与对照组一般资料比较
败血症组与对照组之间WBC计数、PLT计数、Hb和NEUT%差异均有统计学意义(P<0.05),LYMPH%和HCT差异均无统计学意义(P>0.05)。见表1。
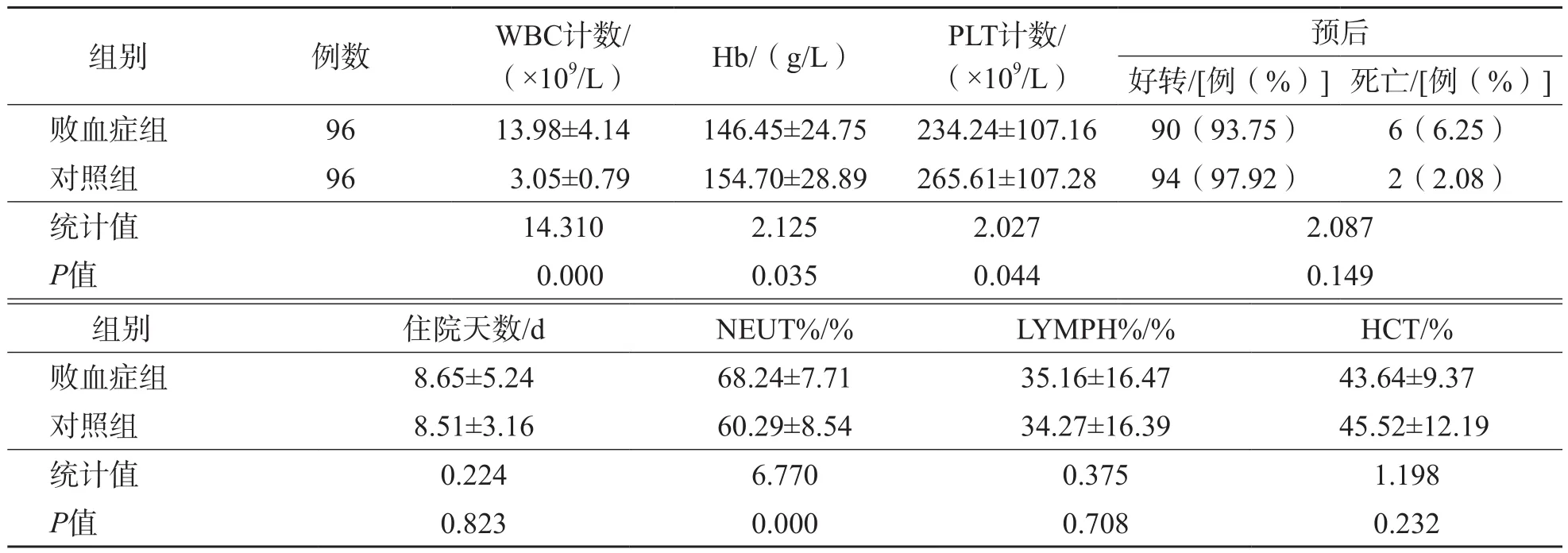
表1 败血症组与对照组一般资料比较
2.2 败血症组与对照组CRP、PCT、IL-6水平比较
败血症组CRP、PCT和IL-6水平均显著高于对照组(P<0.05)。见表2。

表2 败血症组与对照组CRP、PCT、IL-6水平比较
2.3 败血症患儿病原菌分布情况及与患儿预后的关系
96例败血症患儿中革兰阳性菌感染44例、革兰阴性菌感染36例、真菌感染16例。见表3。
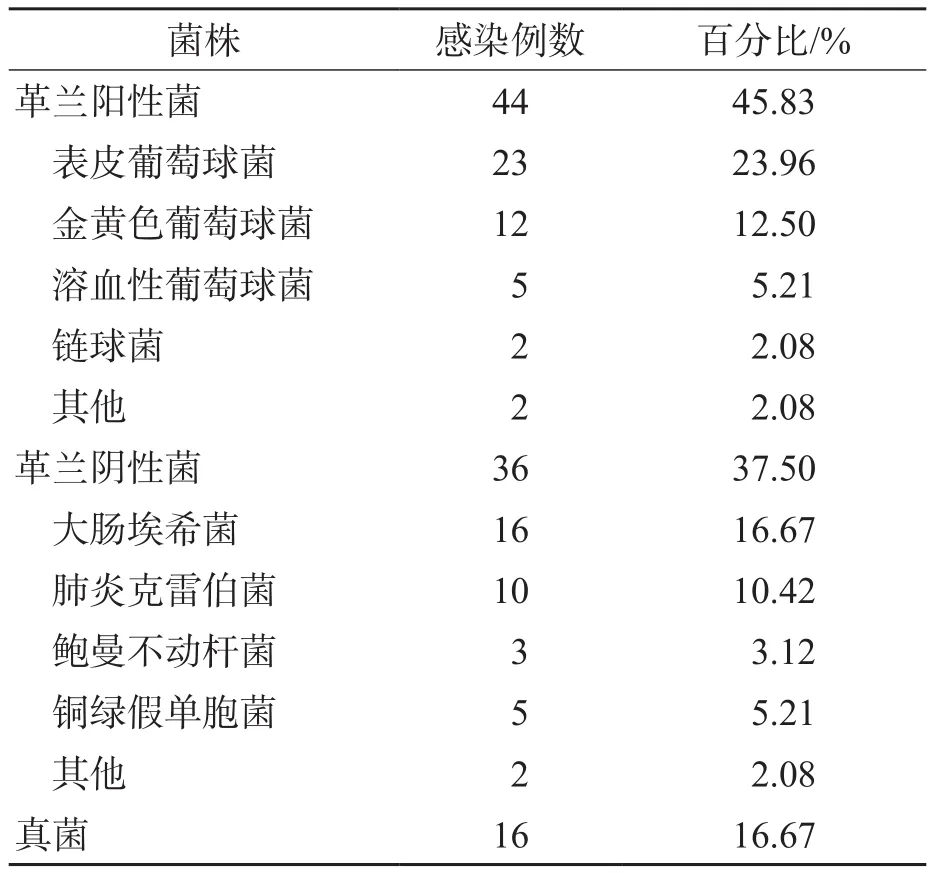
表3 败血症患儿病原菌感染情况
将败血症患儿根据预后情况分为好转组(90例)和死亡组(6例),2个组之间革兰阳性菌、革兰阴性菌和真菌感染例数差异无统计学意义(χ2=1.832,P=0.400)。见表4。

表4 好转组和死亡组病原菌感染情况 例
2.4 新生儿发生败血症的危险因素分析
Logistic回归分析结果显示,CRP、PCT和IL-6水平升高是新生儿发生败血症的危险因素[比值比(odds ratio,OR)值分别为2.943、2.862、2.915,95%可信区间(confidence interval,C I)分别为2.4 2 5~3.3 8 4、2.531~3.269、2.487~3.556,P<0.05]。见表5。

表5 新生儿发生败血症的危险因素
2.5 基于外周血炎症指标建立诊断新生儿败血症的列线图模型
列线图中各危险因素的长度对应该因素诊断新生败血症的效能。CRP、PCT、IL-6积分分别为74.24、83.65、81.89分,所有危险因素积分相加后的总分为239.78分,该分值对应的新生儿败血症发生率为71.86%。见图1。
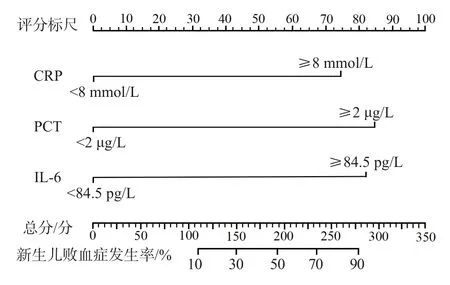
图1 诊断新生儿败血症的列线图模型
2.6 新生儿败血症列线图诊断模型性能评价
以模型验证组作为验证集数据对列线图模型诊断新生儿败血症的效能进行评价和验证。ROC曲线分析结果显示,列线图模型诊断新生儿败血症的曲线下面积(95%CI)为0.831(0.765~0.924)(P<0.001),敏感性为82.1%,特异性为80.4%,C-index值(95%CI)为0.934(0.872~0.985)(P<0.001),列线图模型的区分度较高。校准曲线显示理想曲线与实际曲线较为贴近,提示该模型对新生儿败血症的诊断情况与实际情况相近。决策曲线的曲线下面积(95%CI)为0.792(0.686~0.857)(P<0.001),模型曲线远离极端曲线,提示该模型临床净获益率较高,安全、可靠,实用性强。见图2。
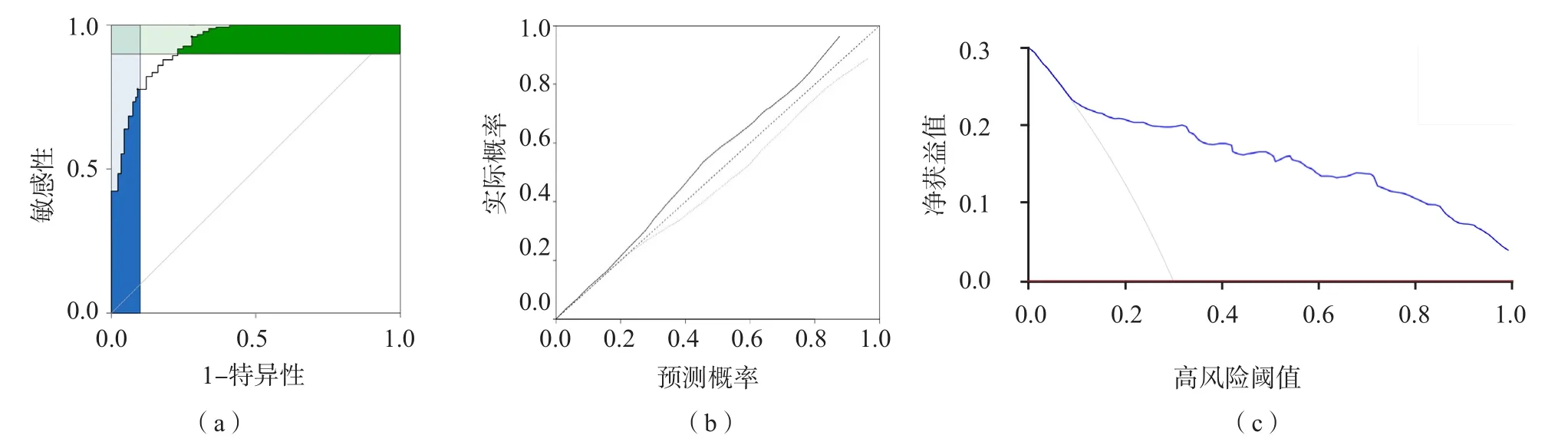
图2 列线图模型诊断新生儿败血症的ROC曲线、校准曲线和决策曲线
2.7 新生儿发生败血症的Kaplan-Meier生存曲线分析
根据列线图模型积分的临界值分为新生儿败血症发生率低风险(≤83.65分)、中风险(>83.65~≤157.89分)和高风险(>157.89分)3个组。低风险组新生儿败血症发生率为29.47%,中风险组为45.57%,高风险组为83.33%,各组间差异均有统计学意义(P<0.05)。见图3。
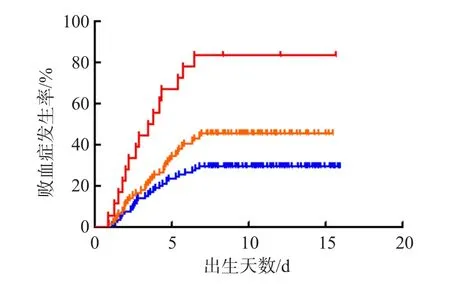
图3 新生儿发生败血症的Kaplan-Meier生存曲线
3 讨论
新生儿败血症多由血浆凝固酶阴性革兰阳性菌感染引起,少数为革兰阴性菌感染,极少数为真菌感染[11]。这些病原微生物进入新生儿体内后会迅速大量繁殖并向血液中释放毒素,导致患儿从局部感染发展为全身性感染,继而引发败血症。新生儿败血症的早期症状有进食少或拒绝进食、嗜睡、哭声低、精神萎靡、持续发热等,这些症状均为非特异性症状,不易判断,诊治不及时可能会导致患儿出现脏器功能损伤、中枢神经系统损伤等后遗症[12],甚至死亡。有研究表明,新生儿败血症的治疗时间提前1 h能够降低患儿10%的死亡风险[13]。因此,寻找高敏感性、高特异性并能对病情发展程度作出判断的早期诊断指标一直是新生儿败血症诊治方面的研究重点。
本研究结果显示,败血症组外周血炎症指标CRP、PCT和IL-6水平均明显高于对照组(P<0.05)。CRP是一种非特异性炎症标志物,在机体受到感染时其水平会明显升高。一般情况下,血液中的CRP水平会在新生儿受到感染后的6~12 h升高,2 d后达到高峰,通过一定治疗后,CRP水平会恢复正常[14]。CRP水平变化在细菌感染时非常明显,但在病毒感染时其水平变化程度较小或无明显变化,且CRP水平在机体内出现组织损伤、溶血或缺氧缺血性脑病等非炎症情况时也会上升[15]。因此,采用CRP作为新生儿败血症的诊断指标时通常会联合其他指标结果来提升诊断的准确性。PCT是由116个氨基酸残基组成的肽类物质,是降钙素的前体[16]。在机体出现全身性感染时,血清PCT水平会迅速升高,在感染后3~6 h即可测得,6~12 h达到高峰,2~3 d后恢复至正常水平,PCT水平不受机体免疫状态的影响,仅与机体感染严重程度呈正相关,稳定性较好,特异性也较高[17]。谷磊等[18]回顾分析了156例细菌感染败血症新生儿和245例呼吸窘迫综合征或窒息新生儿的临床资料,发现PCT与高敏CRP联合检测诊断效能更高。IL-6是一种糖蛋白细胞因子,具有造血、免疫调节等多种生物学功能[19]。当机体受到感染后,入侵的病原体与其产物和人Toll样受体发生相互作用,刺激核转录因子-κB与其他多种激酶,导致炎症因子被大量生成和释放。IL-6与相应受体结合后会刺激宿主细胞启动下游信号通路,激活巨噬细胞、淋巴细胞、单核细胞等免疫相关细胞,启动炎症反应[20]。新生儿受到感染并出现缺氧、缺血时,组织损伤与器官衰竭发病的一个关键因素就是炎症细胞因子[21]。有研究结果显示,IL-6能够对机体内感染作出即时反应,其血清水平在感染发生2 h内即可到达峰值[22]。LIU等[23]对比分析了66例早发性新生儿败血症患儿与63例健康新生儿出生后4~6 h和出生后12~24 h的血液检测结果,发现出生6 h内的血清IL-6水平对新生儿败血症有早期诊断价值,并确定了IL-6诊断早发性败血症的最佳临界值(86.16 pg/L)。SUN等[24]发现,血清IL-6诊断新生儿败血症的特异性与敏感性均高于CRP。血清IL-6水平在新生儿感染初期的诊断中具有较高敏感性,但其峰值在血液中维持时间较短,24 h后敏感性会降低,且IL-6检测成本较高,单独使用IL-6作为新生儿败血症的诊断指标存在一定的局限性[25]。有研究发现,IL-6与CRP、PCT等其他诊断标志物联合使用能够明显提升诊断的敏感性、特异性与准确性[26]。
本研究分析了新生儿发生败血症的独立危险因素,并根据分析结果构建了列线图模型。ROC曲线、决策曲线和校准曲线评价结果显示该列线图模型的准确度较高,区分度较好,临床净获益率较高。通过X-tile软件获取列线图模型积分临界值,并绘制了新生儿发生败血症的生存曲线,Log-rank检验结果显示该模型效能良好,具有较高的预测价值。
本研究尚存在一些不足之处:(1)采用回顾性分析的方式进行研究,资料收集时间跨度较大,可能存在偏移因素;(2)资料来源单一,样本量较小,研究结果有一定局限性;(3)缺乏不同时期败血症患儿体内炎症指标变化的纵向分析。
综上所述,基于CRP、PCT和IL-6构建的列线图模型对新生儿败血症早期诊断的价值较高,对于提升新生儿败血症诊断效能,指导临床治疗,降低新生儿死亡率有着重要的意义。

