PRV △gE/TK/US3基因缺失株的构建及对小鼠的免疫效力
邓梦梦,郭子仪,丁晨梦,许夕雅,孙亚威,韩紫薇,石蒙蒙,陈 陆
(河南农业大学 动物医学学院,河南 郑州 450046)
伪狂犬病病毒(pseudorabies virus,PRV)属于疱疹病毒科(Herpesviridae)α疱疹病毒亚科(alphaHerpesririnae)[1-2]。猪是其自然宿主,感染后妊娠母猪可出现流产、种猪不育、新生仔猪脑脊髓炎和腹泻等症状。PRV复制周期短、感染速度快,能引起细胞裂解性感染,且能在神经细胞中建立潜伏感染,导致机体感染耐受后终身带毒[3]。当机体免疫水平降低或处于应激状态时,潜伏感染的病毒被激活,从而引起复发性感染[4]。该病目前尚无有效治疗药物,疫苗免疫仍是预防和控制该病发生和流行的主要措施。随着伪狂犬病基因缺失标记疫苗的广泛使用以及配合鉴定诊断技术和阳性带毒猪淘汰净化等综合措施,该病在我国得到有效控制[5]。2011年末,伪狂犬病在免疫Bartha-K61株疫苗的猪场再次暴发和流行,给我国养猪业造成严重的经济损失,使得伪狂犬病防控和疫苗研究再次成为热点[6-8]。
gE、TK基因是PRV的主要毒力基因,且不参与病毒复制,缺失该基因后不仅可明显降低病毒的侵袭力和毒力,还可保持良好的免疫原性,是目前基因缺失疫苗的主要缺失靶点[9-11]。US3也是PRV的毒力基因,且通过抑制Ⅰ型IFN反应、干扰MHC-Ⅰ介导的抗原递呈、阻止感染细胞被NK细胞裂解和抑制细胞凋亡进而逃避宿主的免疫监视[12-14]。为了研究能被有效抗原递呈以被免疫系统识别,诱导机体产生更高免疫反应的疫苗,本试验在PRV △gE/TK株基础上缺失US3基因,构建PRV △gE/TK/US3基因缺失株,并测得其安全性和免疫效力,以评价其作为疫苗株的潜力。
1 材料与方法
1.1 质粒、毒株、菌株和细胞pBluescript SK(-)真核表达载体、pEGFP重组质粒、pcGlobin2-Cre质粒均由本实验室保存;PRV QYY2012变异株和PRV △gE/TK基因缺失株均为本实验室分离、构建与保存;E.coliDH5α感受态细胞、Vero细胞、293 T细胞均由本实验室保存。
1.2 主要试剂限制性核酸内切酶EcoRⅠ、SpeⅠ、HindⅢ、KpnⅠ、T4DNA ligase为TaKaRa公司产品;Opti-MEM培养基、DMEM培养基、2×DMEM培养基为Gibco公司产品;Lipofectamine 2000 Reagen为美国Invitrogen公司产品。
1.3 实验动物6周龄健康雌性昆明小鼠购自河南省实验动物中心。
1.4 引物设计与合成根据GenBank中PRV HN1201(KP722022.1)序列设计系列引物(表1),由生工生物工程(上海)股份有限公司合成。

表1 引物序列信息
1.5 病毒增殖及基因组提取分别将PRV QYY2012株和△gE/TK株接种Vero细胞,待细胞病变至80%时收毒,利用酚氯仿法提取病毒DNA。
1.6 PRV US3基因左、右侧同源臂、EGFP的扩增及回收以PRV QYY2012株DNA为模板,利用引物US3L-F/R和US3R-F/R分别扩增PRV US3基因左、右侧同源臂。PCR反应条件:95℃ 5 min;95℃ 30 s,60℃ 30 s,72℃ 1 min,32个循环;72℃ 10 min,4℃保存。以pEGFP重组质粒为模板,利用加Loxp位点的引物EGFP-F/R扩增EGFP。PCR反应条件:95℃ 3 min;95℃ 30 s,56℃ 30 s,72℃ 2 min,32个循环;72℃ 10 min,4℃保存。分别将回收纯化的PCR产物克隆至pMD18-T载体中,构建重组质粒pMD-US3L、pMD-US3R和pMD-EGFP并进行测序,将测序结果通过Blast比对,以确定序列正确性。
1.7 转移载体pSK-US3-LR-EGFP构建及鉴定pMD-US3L和pMD-US3R分别经KpnⅠ、HindⅢ和EcoRⅠ、SpeⅠ双酶切获得线性片段US3L和US3R,将其定向克隆至相同双酶切处理的pBluescript SK(-),获得质粒pSK-US3-LR。将质粒pMD-EGFP经Hind Ⅲ、EcoRⅠ双酶切获得线性片段EGFP,将其连接至相同双酶切的pSK-US3-LR。经酶切及测序鉴定正确所构建的转移载体命名为pSK-US3-LR-EGFP。
1.8 重组质粒pSK-US3-LR-EGFP绿色荧光标签表达盒启动子活性鉴定脂质体转染法将2 μg重组质粒pSK-US3-LR-EGFP转染293 T细胞,转染后6 h换细胞维持液,24 h后在荧光显微镜下观察是否表达绿色荧光。
1.9 重组病毒PRV △gE/TK/US3/EGFP+株的获得与鉴定脂质体转染法将重组质粒pSK-US3-LR-EGFP和PRV △gE/TK株基因组共转染293 T细胞。转染后6 h换细胞维持液,待出现80%细胞病变时收毒。离心取上清接种Vero细胞,铺设含低熔点琼脂糖的细胞维持液,挑选绿色荧光蚀斑,经蚀斑纯化直至荧光显微镜下观察到的蚀斑均为绿色荧光,纯化病毒命名为PRV △gE/TK/US3/EGFP+株。将PRV △gE/TK/US3/EGFP+株接种Vero细胞,提取DNA,利用引物US3-F/R进行PCR扩增,鉴定US3基因缺失结果。扩增反应条件:95℃ 5 min;95℃ 30 s,58℃ 30 s,72℃ 2 min 30 s,32个循环;72℃ 10 min,4℃保存,PCR产物经凝胶电泳进行鉴定。
1.10 重组病毒PRV △gE/TK/US3株的获得与鉴定将pcGlobin2-Cre质粒和PRV △gE/TK/US3/EGFP+株基因组共转染293 T细胞,利用Cre-Loxp重组酶系统去除EGFP基因。转染后6 h换细胞维持液,待出现80%细胞病变时收毒,离心取上清接种Vero细胞,蚀斑纯化不带绿色荧光标签的重组病毒命名为PRV △gE/TK/US3株。将PRV △gE/TK/US3株接种Vero细胞,提取DNA,利用引物US3-F/R进行PCR扩增,鉴定US3基因缺失情况。扩增反应条件:95℃ 5 min;95℃ 30 s,58℃ 30 s,72℃ 1 min,32个循环;72℃ 10 min,4℃保存,PCR产物经凝胶电泳进行鉴定。
1.11 重组病毒PRV △gE/TK/US3株遗传稳定性PRV △gE/TK/US3株在Vero细胞上连续传10代,提取各代病毒基因组,利用引物gD-F/R和△US3-F/R经PCR鉴定验证PRV △gE/TK/US3株遗传稳定性。
1.12 重组病毒PRV △gE/TK/US3株一步生长曲线测定将PRV QYY2012、△gE/TK和△gE/TK/US3株病毒液分别接种到长满单层Vero细胞的35 mm细胞培养皿中,每隔6 h收集病毒液,反复冻融3次,1 000 r/mim离心8 min,取上清液根据Reed-Muench法测定、计算病毒滴度,绘制一步生长曲线。
1.13 小鼠安全性试验将6周龄健康雌性昆明小鼠随机分为4组,每组8只,3个感染组分别后肢肌肉接种1×106TCID50的PRV QYY2012、△gE/TK和△gE/TK/US3株,空白对照组后肢肌肉接种DMEM溶液,每天观察并记录小鼠的临床反应及存活率。
1.14 重组病毒PRV △gE/TK/US3株免疫小鼠中和抗体消长测定将6周龄健康雌性昆明小鼠随机分为3组,每组8只,2个免疫组分别经后肢肌肉接种1×106TCID50的PRV △gE/TK和△gE/TK/US3株,空白对照组接种DMEM溶液,首免后2周同样剂量和接种途径加强免疫。免疫后每周采集小鼠血清,利用PRV QYY2012株经中和试验测定其抗PRV中和抗体水平。
1.15 重组病毒PRV △gE/TK/US3株免疫小鼠攻毒试验将6周龄健康雌性昆明小鼠随机分为4组,每组8只,3个免疫组分别经后肢肌肉接种1×106TCID50的PRV △gE/TK、△gE/TK/US3和Bartha-K61株,空白对照组接种DMEM溶液,首免后2周同样剂量和接种途径加强免疫。二免后4周后肢肌肉接种4×104TCID50的PRV QYY2012株攻毒,每天观察并记录小鼠的临床反应及存活率。
2 结果
2.1 PRV US3基因左、右侧同源臂和EGFP基因扩增PRV US3基因左、右侧同源臂和EGFP基因PCR扩增电泳结果显示,分别扩增出658,778,1 620 bp 目的条带,与预期一致(图1)。分别经回收纯化克隆至pMD18-T载体,构建重组质粒并测序,Blast比对结果均正确。
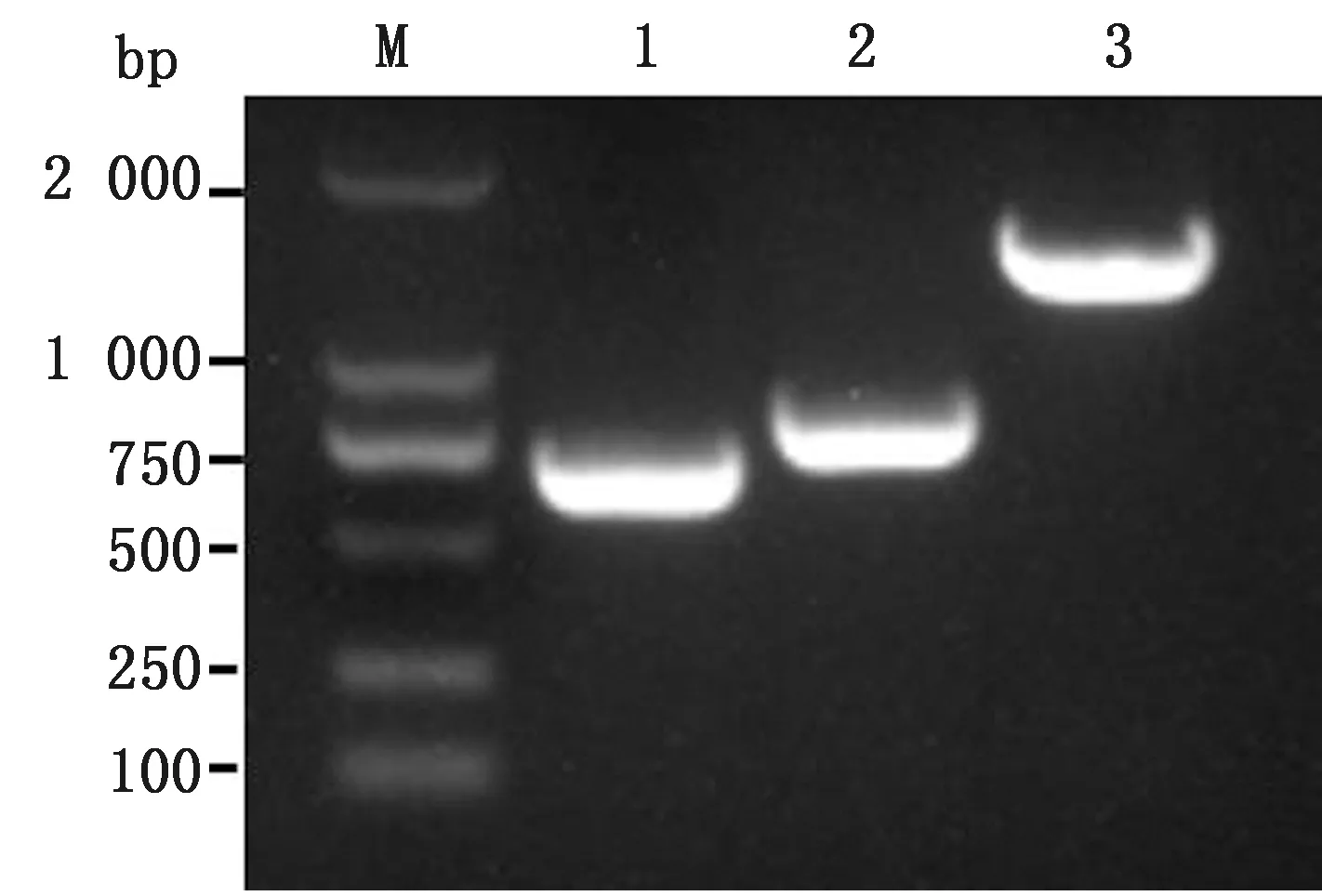
M.DL2000 DNA Marker;1.US3左侧同源臂片段;2.US3右侧同源臂片段;3.EGFP片段
2.2 重组质粒pSK-US3-LR-EGFP酶切鉴定构建的重组质粒pSK-US3-LR-EGFP大小为5 974 bp,双酶切鉴定结果显示与预期一致(图2),证明重组质粒pSK-US3-LR-EGFP构建成功。

M.DL5000 DNA Marker;1.HindⅢ/EcoRⅠ(1 620,4 354 bp);2.EcoRⅠ/KpnⅠ(2 358,3 616 bp)
2.3 重组质粒pSK-US3-LR-EGFP表达盒启动子活性鉴定pSK-US3-LR-EGFP转染293 T细胞24 h后在荧光显微镜下可观察到绿色荧光(图3),表明重组质粒EGFP表达盒启动子具有活性,可启动转录表达绿色荧光蛋白,pSK-US3-LR-EGFP可用于PRV △gE/TK株US3基因缺失同源重组打靶。

A.荧光视野;B.明场视野
2.4 重组病毒PRV △gE/TK/US3/EGFP+株的纯化pSK-US3-LR-EGFP和PRV △gE/TK株基因组共转染293 T细胞后进行蚀斑筛选,48 h后在荧光显微镜下可观察到少量绿色荧光病毒蚀斑,经8轮挑斑纯化获得所有病变均带荧光的重组病毒PRV △gE/TK/US3/EGFP+株(图4)。
2.5 重组病毒PRV △gE/TK/US3/EGFP+株PCR鉴定将纯化的荧光蚀斑病毒接种Vero细胞进行增殖,利用引物US3-F/R经PCR鉴定,扩增PRV QYY2012株条带应为1 617 bp,PRV △gE/TK/US3/EGFP+株因US3基因缺失925 bp,插入荧光标签EGFP为1 640 bp,扩增片段应为2 332 bp。电泳结果显示与预期相符(图5)。
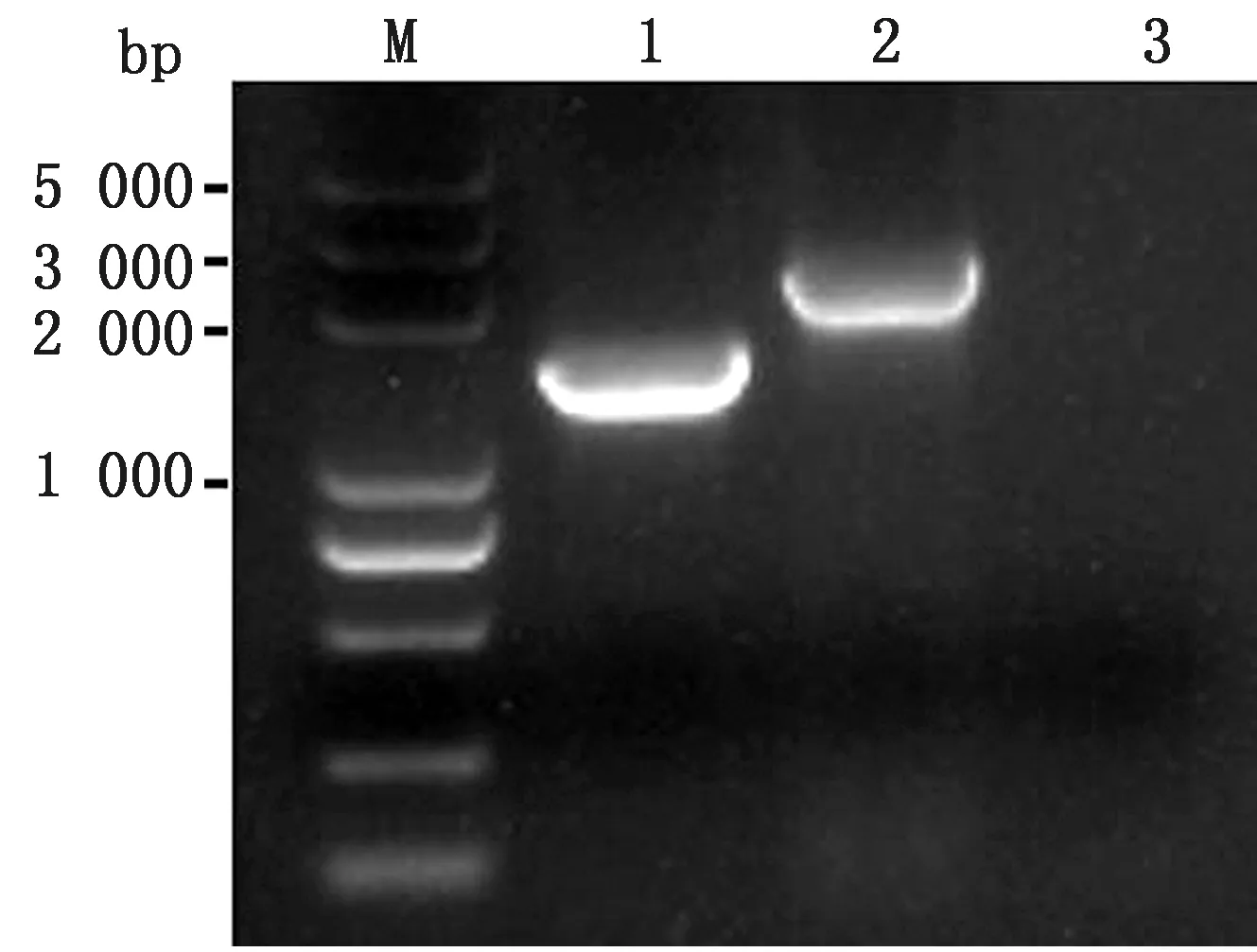
M.DL5000 DNA Marker;1.PRV QYY2012株扩增片段;2.PRV △gE/TK/US3/EGFP+株扩增片段;3.阴性对照
2.6 重组病毒PRV △gE/TK/US3/EGFP+株荧光标签的剔除pcGlobin2-Cre质粒和PRV △gE/TK/US3/EGFP+株基因组共转染293 T细胞后取上清接种Vero细胞,48 h后在荧光显微镜下观察到有不带绿色荧光的蚀斑,经4轮蚀斑纯化获得所有病变均不带荧光的重组病毒PRV △gE/TK/US3株(图6)。

A.荧光视野;B.明场视野
2.7 重组病毒PRV △gE/TK/US3株PCR鉴定将获得的PRV △gE/TK/US3株接种Vero细胞增殖,利用引物US3-F/R经PCR鉴定,PRV QYY2012株扩增条带应为1 617 bp,PRV △gE/TK/US3株因US3基因缺失925 bp,所以扩增条带应为692 bp。电泳结果显示与预期相符(图7)。
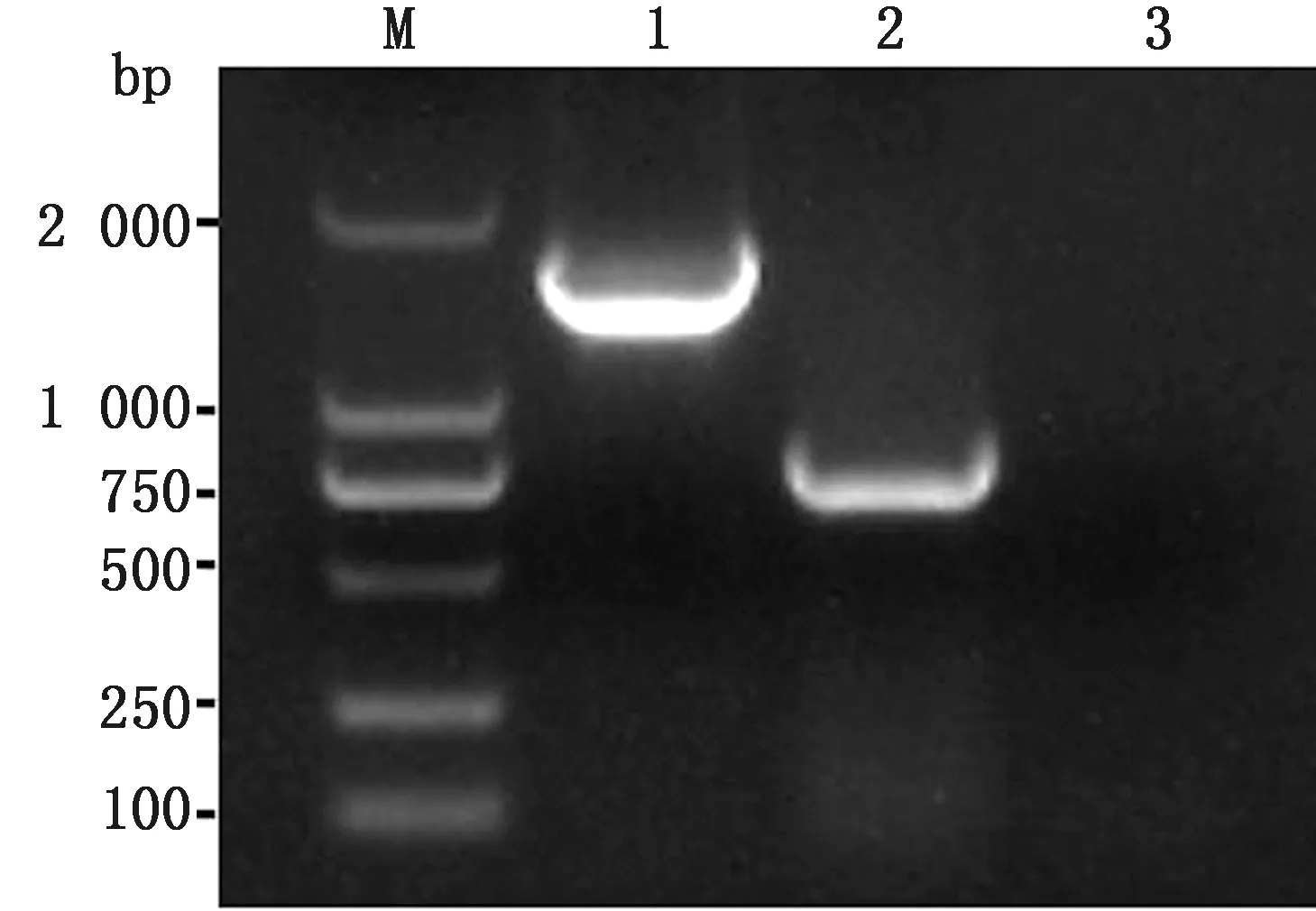
M.DL2000 DNA Marker;1.PRV QYY2012株扩增片段;2.PRV △gE/TK/US3株扩增片段;3.阴性对照
2.8 重组病毒PRV △gE/TK/US3株遗传稳定性评价PRV △gE/TK/US3株在Vero细胞上增殖10代,利用引物gD-F/R和△US3-F/R进行PCR鉴定。电泳结果显示,使用gD-F/R扩增出572 bp目的条带(图8A),与预期一致,且测序结果显示不同代次gD基因未发生变异。使用△US3-F/R扩增PRV △gE/TK/US3株不同代次毒株,均无扩增条带(图8B),证明PRV △gE/TK/US3株没有发生US3基因回复突变,具有良好的遗传稳定性。

A.gD基因扩增片段;B.US3基因扩增片段。M.DL2000 DNA Marker;1~10.1~10代PRV △gE/TK/US3株;11.PRV QYY2012株;12.阴性对照
2.9 重组病毒PRV △gE/TK/US3株一步生长曲线测定△gE/TK株病毒滴度分别在接毒后30和36 h 达到最高,PRV △gE/TK/US3株在接毒后42 h 达到最高(图9)。与PRV QYY2012和△gE/TK株相比,PRV △gE/TK/US3株病毒滴度较低,说明US3基因缺失毒株增殖能力下降,US3基因与病毒复制能力有一定关系,但PRV △gE/TK/US3株仍具有良好的体外增殖能力。

图9 重组病毒PRV △gE/TK/US3株在Vero细胞上的一步生长曲线
2.10 小鼠安全性试验PRV QYY2012株试验组在攻毒后第3天开始出现间歇性兴奋、食欲减退、转圈、瘙痒等典型临床症状,攻毒后1周内全部死亡。PRV △gE/TK和△gE/TK/US3株试验组和空白对照组小鼠均健康存活,且精神、食欲均正常。结果表明,US3基因作为PRV的毒力基因,缺失后可显著降低对小鼠的致病性,由此可证明PRV △gE/TK/US3株的安全性。
2.11 免疫小鼠血清抗PRV中和抗体水平消长情况PRV △gE/TK和△gE/TK/US3株免疫组在一免后1周均产生中和抗体,二免后4周均达到最高水平(图10)。PRV △gE/TK/US3株免疫组能诱导更高水平抗体,且能维持更长时间,具有良好的免疫原性。
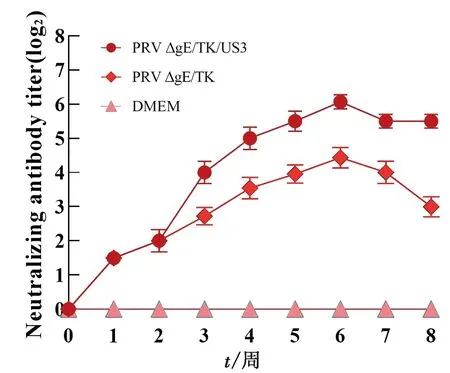
图10 重组病毒PRV △gE/TK/US3株免疫小鼠血清中抗PRV中和抗体水平消长变化情况
2.12 重组病毒PRV △gE/TK/US3株免疫小鼠攻毒试验Bartha-K61株免疫组小鼠对PRV QYY2012毒株攻击的抵抗力较低,PRV △gE/TK株免疫组小鼠对其耐受力较强,而PRV △gE/TK/US3株免疫组小鼠可对PRV强毒攻击提供完全保护力(图11)。
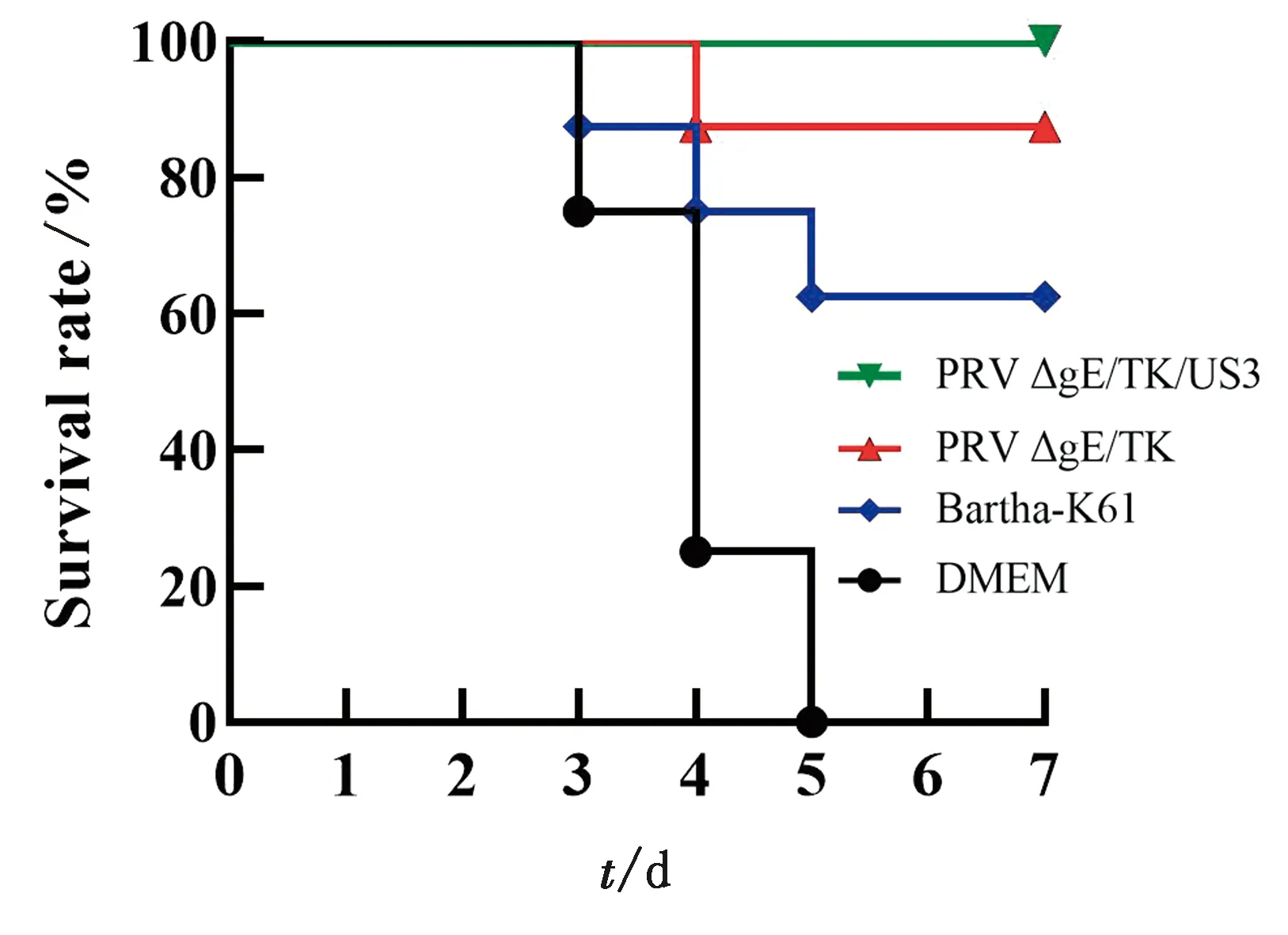
图11 重组病毒PRV △gE/TK/US3株免疫小鼠攻毒后7 d 小鼠存活情况
3 讨论
目前防控猪伪狂犬病(PR)主要依靠疫苗接种,随着Bartha-K61的广泛使用,PR已得到有效控制[15]。但自2011年以来,我国接种PR疫苗的猪场暴发严重的PR,意味着现有疫苗已不能对当前流行的PRV变异株提供完全的保护力,因此研制可防控、根除PRV变异株的新型疫苗成为重中之重。
PRV的毒力受不同基因编码蛋白的调控,不同程度地缺失毒力基因可对病毒侵袭能力、传播性能造成一定影响,这为研制新型PRV疫苗创造条件[16-18]。缺失gE、TK基因可显著降低病毒毒力,但不影响病毒增殖,且保留良好的免疫原性,是目前基因缺失疫苗的主要靶基因[19]。LI等[20]比较PRV △gE/gI和△TK/gE/gI的免疫效力发现进一步缺失TK可为小鼠和猪只提供更强的保护力。US3基因也是PRV毒力基因,且通过下调MHC-Ⅰ类分子表达、干扰Ⅰ型IFN反应和抑制细胞凋亡参与免疫逃逸[21-22]。为验证US3基因缺失后作为疫苗的免疫效力,本试验构建了3基因缺失株PRV △gE/TK/US3,该毒株US3基因缺失925 bp,可在Vero细胞内稳定传代,虽病毒滴度较原毒株低,但仍具有良好的增殖能力。使用该基因缺失株接种小鼠是安全可靠的,能产生较高水平的抗PRV中和抗体,且能维持较长时间,具有良好的免疫原性。吴化叶等[23]也证实了HSV-1 US3基因修饰突变减毒株M4表现出良好的减毒表型,免疫小鼠可产生高水平中和抗体并诱导特异性T免疫反应,提高机体的体液免疫和细胞免疫应答。本试验结果可初步证实接种PRV △gE/TK/US3株后作为抗原能被机体有效递呈以被免疫系统识别,诱导产生更强的免疫反应,这是PRV △gE/TK/US3基因缺失株有望作为PR基因缺失疫苗候选种毒株的有力证明。此外PRV △gE/TK/US3株免疫后小鼠可对PRV QYY2012强毒攻击提供完全保护力,进一步表明该缺失株具有良好的免疫保护力。后期还将对PRV △gE/TK/US3基因缺失株免疫效力进行全面评价,以期为防控当前PRV变异毒株引起的PR疫情提供新型高效疫苗。

