前列腺素F2α剂量依赖性对黄体溶解效果评价及其调控基因表达模式分析
杨 恒,李利财
(西南大学 动物医学学院,重庆 荣昌 402460)
黄体(corpus luteum,CL)是雌性哺乳动物发情排卵后,由残留的卵泡颗粒细胞和内膜细胞迅速增生变大,吸收大量黄色类脂质形成的一个暂时性内分泌器官。其主要由大、小CL细胞组成,能够合成和分泌类固醇激素孕酮(progesterone,P4),对于维持妊娠具有不可或缺的作用[1-2]。正常繁殖周期内,如果卵子受精,这些CL细胞将分泌P4参与调节受精卵着床以及妊娠的早期维持。相反,在没有受精的情况下,CL将会消融、体积缩小、功能降低,并在其位置留下一个小的疤痕状结构,称为白体。这一过程导致体内P4浓度下降,卵泡抑制被解除,从而促进卵泡生长、发情周期启动[3]。可见,CL形态和功能的改变在哺乳动物正常的生殖周期中发挥着重要的调控作用。
目前,普遍认为前列腺素家族(PGs)是调控CL形态和功能的主要“开关”,决定着周期性CL的寿命及其发展方向[2-4]。作为一种内源性的局部激素,PGs广泛分布于哺乳动物体内,并涉及大量的生殖过程,例如排卵、着床、分娩、CL消融等[5-8]。早在1966年,BABOCK[9]报道并提出了子宫端释放的PGs家族成员PGF2α是导致母体卵巢端CL发生周期性变化的重要物质,继而开启了PGF2α在哺乳动物繁殖领域的深入研究及广泛应用。例如,JUENGEL等[10]研究发现低剂量PGF2α可引起CL功能减弱、体内P4含量呈现短暂降低,但并未导致CL体质量降低(即结构性溶解尚未发生);然而,高剂量PGF2α处理(10倍剂量)时,发现其体内P4含量显著下降,并伴随CL发生结构性溶解。类似地,CEZINANDE等[11]报道也发现,较低剂量PGF2α处理时,母体体内P4水平24 h后会发生明显降低,但在48 h后又再次升高;但较高剂量PGF2α处理时,其CL则会发生完全的功能性退化和结构性溶解,可见雌性动物CL溶解退化的程度可能与PGF2α剂量有关。然而,另一研究发现,与单剂量相比,双倍剂量PGF2α诱导母体发生完全CL溶解的比例更高,但3倍剂量时并未出现更有效的处理效果[12],提示在PGF2α诱导CL溶解退化过程中似乎存在一个临界值,即在该临界值范围内PGF2α剂量的增加会使其CL溶解退化效果呈现相应的剂量依赖性关系。不过,有关PGF2α对雌性动物个体CL组织的功能变化及形态改变的剂量依赖性影响仍有待进一步研究。为此,本试验设置5个不同剂量梯度,通过H.E染色观察CL形态差异,ELISA检测体内P4含量变化,同时利用RT-PCR检测CL功能基因及凋亡相关基因表达情况,旨在探析雌性动物CL溶解与PGF2α剂量依存关系,为后续雌性动物繁殖技能障碍(如持久CL)及优化PGs主导的高效繁殖技术方案研究奠定坚实的理论基础。
1 材料与方法
1.1 实验动物及饲养管理试验动物购自重庆恩斯维尔生物技术有限公司,取60只60日龄、体质量相近(32±2)g,无繁殖障碍性疾病的健康雌性昆明小鼠(SPF级),饲养于西南大学动物医学院动物房。同一饲养环境,室内温度控制为25℃,自然光照,自由采食、饮水,定期更换垫料,做好消毒,保证饲养环境舒适。适应性饲养1周后用于试验。
1.2 主要试剂PGF2α购自上海梯希爱化成工业发展有限公司;H.E染色试剂盒购自北京索莱宝科技有限公司;PrimeScriptTMRT Master Mix和TB Green Premix Ex TagⅡ购自日本TaKaRa公司;小鼠P4ELISA试剂盒购自江苏晶美生物科技有限公司。
1.3 小鼠发情周期监测试验小鼠适应性饲养1周后,逐一编号并标记。采用外阴观察法、阴道脱落细胞涂片(H.E染色)监测发情周期。观察小鼠阴门开张状态、黏膜颜色、阴道分泌物及其性质和外阴肿胀情况,拍照记录。(1)小鼠阴道脱落细胞及观察:将雌鼠保定,暴露阴道口,用无菌生理盐水浸泡过的棉签伸入小鼠阴道约0.5 cm,轻轻转动棉签,采集细胞,先横向再纵向轻轻且均匀涂抹在干净的载玻片上,自然晾干后进行H.E染色。(2)H.E染色操作步骤:95% 乙醇固定3 min;自来水冲洗30 s;苏木素染色1 min 20 s;自来水冲洗30 s;伊红染色1 min 30 s;自来水冲洗30 s;自然晾干,显微镜下观察。参考文献[13],各发情时期小鼠阴门状态和阴道脱落细胞特点总结见表1。

表1 小鼠发情周期外部观察和阴道细胞H.E染色鉴定方法
1.4 试验小鼠腹腔注射处理通过外阴观察法和阴道脱落细胞涂片,选择发情周期正常的60只小鼠,随机分为6组(n=10),进行阴道脱落细胞涂片直到发情间期(CL活跃期)时,按照不同剂量梯度(1,10,50,100,200 μg),腹腔注射PGF2α。
1.5 CL形态学观察各组小鼠经腹腔注射药物36 h 后(避免此时CL组织发生生理性周期性退化)颈椎脱臼方式处死,皮肤消毒后剪开皮肤,剥离皮下组织和肌肉。打开腹腔,快速摘取卵巢,在体视显微镜下将卵巢周围的脂肪组织剥离干净,分离CL,转入无菌无酶冻存管。采集的子宫、卵巢组织于-80℃保存、备用。采集的CL用4%多聚甲醛直接固定,待包埋切片后,利用苏木素-伊红(H.E)染色,直接观察CL组织形态。
1.6 血液采集、处理与激素测定小鼠断颈处死前先采用眼眶取血法采血,转入1.5 mL离心管中,室温静置1 h,4℃,3 000 r/min离心5 min,吸取上层淡黄色血清,转入新的1.5 mL离心管,置于-20℃冰箱保存备用。利用酶联免疫测定(ELISA)试剂盒检测血清中的P4浓度,分析不同处理组中上述激素在体内的浓度变化。
1.7 qRT-PCR测定参照总RNA提取试剂盒说明书提取子宫、CL组织中总RNA,使用Nanodrop2000检测RNA的纯度及浓度。按照HiFiscript cDNA Synthesis Kit试剂盒说明书反转录成cDNA,使用Nanodrop 2000检测cDNA的纯度及浓度,保存于-20℃。qRT-PCR检测3个引物(表1),由Sangon Biotech公司合成。按照TB Green Premix Ex Taq Ⅱ(Tli RNaseH Plus)试剂盒说明书操作实施qRT-PCR检测:TB Green Premix Ex Tag Ⅱ(Tli RNaseH Plus)(2×)10 μL,PCR Forward Primer(10 μmol/L)0.8 μL,PCR Reverse Primer(10 μmol/L)0.8 μL,ROX Reference Dye(50×)0.4 μL,DNA模板2 μL,灭菌水6 μL。PCR扩增程序为95℃预变性30 s;55个循环:95℃ 5 s,56℃ 30~34 s。

表1 实时荧光定量PCR反应引物序列
1.8 统计分析试验所得数据用GraphPad Prism 8.0软件进行t检验分析,分析结果用柱状图表示,其中*表示差异显著(P<0.05),**表示差异极显著(P<0.01)。
2 结果
2.1 小鼠发情周期不同阶段的阴门状态及阴道细胞涂片使用阴门外部观察法和卵巢切片H.E染色的方法监测小鼠发情周期,每次涂片前记录观察其阴门开张、阴门黏膜颜色及外阴肿胀情况,连续跟踪监测3个发情周期。外观结果显示:发情前期(图1A1)阴道口微张,外阴略有肿胀,黏膜呈淡粉红色、较湿润,有少量清亮阴道分泌物;发情期(图1B1)阴门显著扩张,黏膜潮红,外阴皱襞肿胀明显、湿润,分泌物黏稠;发情后期(图1C1)阴道口回缩、阴唇肿胀基本消退,黏膜呈灰白色,无分泌物;发情间期(图1D1)阴门紧闭、如“Y”样,黏膜苍白、干燥、无分泌物,肿胀完全消退。H.E染色结果显示:发情前期(图1A2)以有核上皮细胞为主,部分白细胞,白细胞胞核溶解;发情期(图1B2)几乎为大而扁平的完全角化上皮细胞;发情后期(图1C2)多为完全角化上皮细胞和白细胞,有核上皮细胞少量分布;发情间期(CL活跃期,图1D2)细胞数量少,以白细胞为主,可见极少有核上皮细胞。通过上述监测结果,发现昆明小鼠发情周期约为5~7 d,其中发情间期(即CL活跃期)约为3~4 d,这为准确判断昆明小鼠CL活跃期及在此期开展PGF2α有关研究奠定了坚实基础。
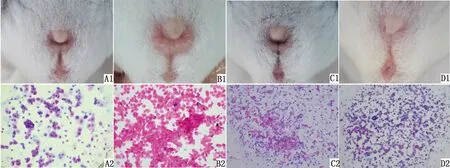
A.发情前期;B.发情期;C.发情后期;D.发情间期
2.2 不同PGF2α剂量处理后CL形态学变化采集不同剂量PGF2α处理小鼠的卵巢分别进行H.E染色,结果显示:对照组中,小鼠的卵巢纵切面几乎全部被CL组织覆盖,各CL之间相互邻接,且外周CL组织突出于卵巢表面(图2A);1 μg PGF2α处理组中1/3卵巢纵切面被CL组织覆盖,染色较浅,部分CL组织突出于卵巢表面,并伴有部分结构性溶解(图2B);10 μg PGF2α处理组中卵巢纵切面仅有少部分CL组织覆盖,CL发生明显的结构性溶解(图2C);50 μg PGF2α处理组中卵巢纵切面已无CL组织覆盖,CL已发生完全结构性溶解,并伴有少量成熟卵泡发生(图2D);100 μg PGF2α处理组中卵巢纵切面尚有大小不等的CL残迹,CL组织仅发生不完全退化(图2E);200 μg PGF2α处理组中4/5卵巢纵切面被CL组织覆盖,且CL组织结构未发生明显溶解,CL结构清晰可见(图2F)。

A~F.分别为对照组(Control),1,10,50,100,200 μg PGF2α处理小鼠的卵巢组织H.E染色
2.3 不同PGF2α剂量处理后小鼠血清孕酮浓度变化血清P4水平的变化是活体CL功能性退化的重要标志。利用ELISA法检测P4浓度,结果如图3所示:与对照组相比,1,100 μg PGF2α处理组中小鼠血清中P4浓度呈显著降低(P<0.05);10,50 μg PGF2α处理组中P4浓度呈极显著下降(P<0.01);而高剂量200 μg PGF2α处理组中P4浓度变化不明显。此外,结果显示50 μg PGF2α处理时,小鼠血清中P4浓度出现明显谷值(P<0.01)。
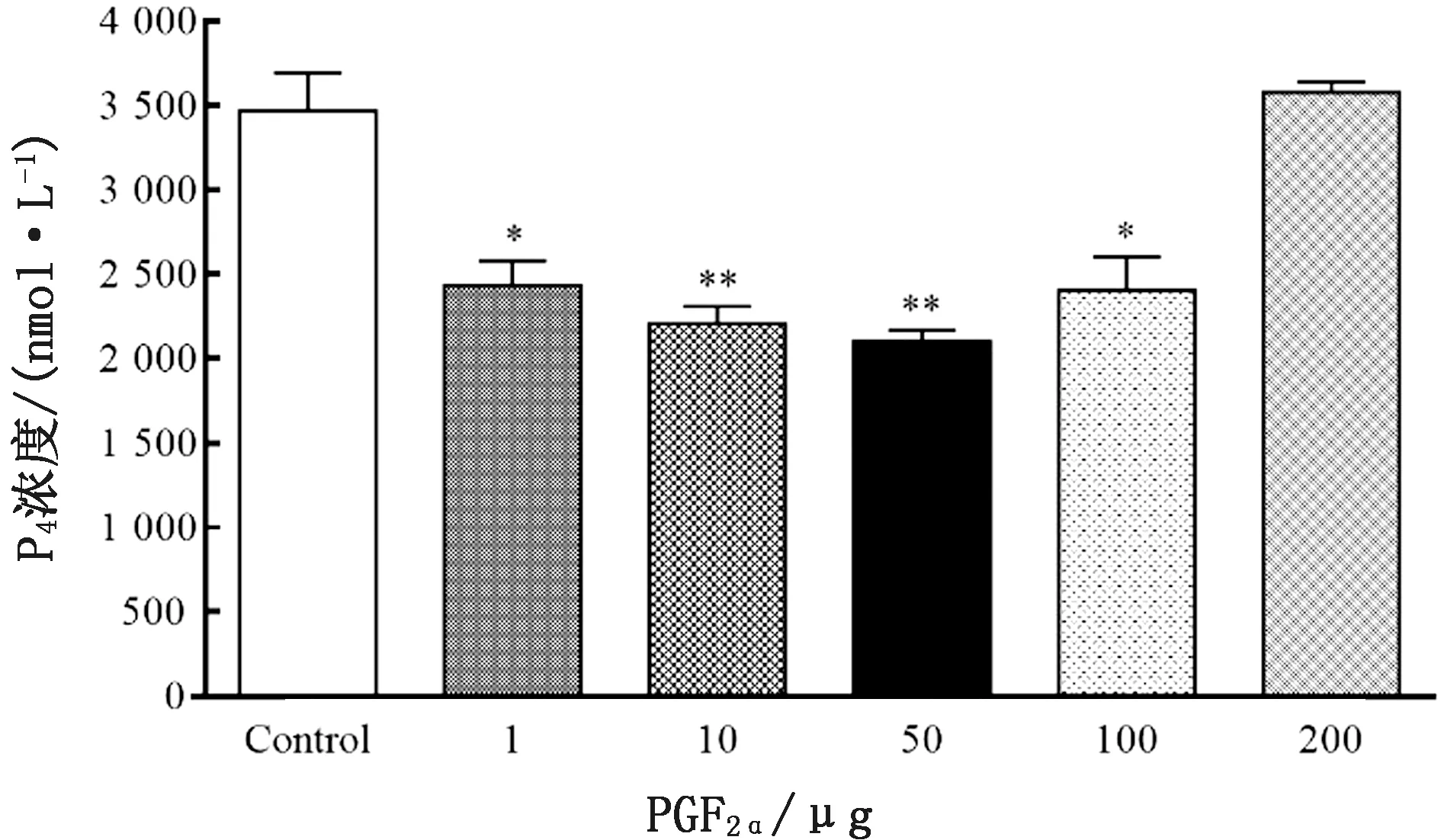
图3 不同剂量PGF2α对CL溶解过程中P4浓度的影响
2.4 不同PGF2α剂量处理后孕酮合成关键基因表达变化StAR和3β-HSD是孕酮合成关键酶,可作为CL孕酮合成功能的可靠衡量指标。结果如图4所示:与对照组相比,10 μg PGF2α处理组中StAR mRNA 表达量呈显著下调(P<0.05),而50,100 μg 处理组中StAR mRNA 表达量呈极显著下调(P<0.01),其余处理组中StAR mRNA表达量稍有下调但均不显著(图4A);同时,100 μg处理组中3β-HSD mRNA 表达量呈显著下调(P<0.05),而50 μg处理组中3β-HSD mRNA 表达量呈极显著下调(P<0.01),其余处理组中3β-HSD mRNA 表达量变化均不显著(图4B)。
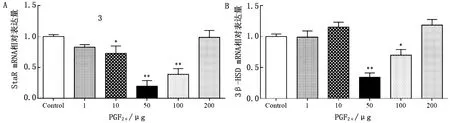
图4 不同组别中P4合成关键酶mRNA相对表达水平变化
2.5 不同PGF2α剂量处理后凋亡关键基因表达变化BAX/BCL-2/Caspase-3信号通路是CL发生结构性溶解的重要指征。结果如图5所示:与对照组相比,10,100 μg PGF2α处理组中BAX mRNA相对表达量呈显著上调(P<0.05),1,50,200 μg PGF2α处理组中BAX mRNA相对表达量呈极显著上调(P<0.01)(图5A);同时,10,200 μg PGF2α处理组中BCL-2 mRNA相对表达量显著下调(P<0.05),50,100 μg PGF2α处理组中BCL-2 mRNA相对表达量呈极显著下调(P<0.01)(图5B);然而,相较于上述二者单独来说,BAX/BCL-2比率是决定凋亡调控的关键因素,结果发现50 μg PGF2α处理组中BAX/BCL-2比值呈极显著上调(P<0.01),其余4个处理组中BAX/BCL-2比值均呈显著上调(P<0.05)(图5 C)。此外,与对照组相比,10,100 μg PGF2α处理组中Caspase-3 mRNA相对表达量呈显著上调(P<0.05),50 μg PGF2α处理组中Caspase-3 mRNA相对表达量呈极显著上调(P<0.01),其余处理组Caspase-3 mRNA相对表达量变化均不显著(图5 D)。

图5 不同组别中BAX/BCL-2/Caspase-3 mRNA相对表达水平变化
3 讨论
CL是雌性动物排卵后,经成熟卵泡转变成的临时性内分泌腺体,是建立和维持妊娠所必需的器官[4,14]。CL有规律的形成和溶解,是雌性动物生殖活动正常进行的关键。临床上,CL溶解过早或功能不全会使P4分泌不足,导致母体妊娠时发生早产、流产或死胎[15];然而,当母体进入空怀期,CL仍持续存在时则会形成持久CL或CL囊肿,导致母体空怀期延长、繁殖效率降低[16]。因此,CL溶解在雌性动物正常生殖功能调控和胚胎妊娠维持与建立过程中发挥至关重要的作用。
前列腺素是膜磷脂的衍生物,其合成的底物来源于膜磷脂转化得到的花生四烯酸,在花生四烯酸转化为PGH2之后,根据存在的特定PG合酶,可以产生不同类型的PGs。目前,普遍认为PGE2是维持CL的重要保护介质,而PGF2α则是CL溶解的主效促溶素[17-18]。其中,作为在繁殖领域最受关注的PGs家族成员,PGF2α对于启动CL溶解具有重要意义[18-19]。不过,大量研究发现在发情周期中处于CL早期阶段的CL对PGF2α并不会产生应答反应[20-21]。基于此,本试验为了确保PGF2α处理效果的准确性,在试验开展前期,课题组针对本次试验动物群体(昆明小鼠)进行了发情周期的监测工作。通过阴门外部观察和阴道细胞脱落H.E涂片,结果发现本试验选择的昆明小鼠发情周期为5~7 d;这与CALIGIONI[13]报道的小鼠发情周期特点相吻合,表明该组昆明小鼠群体发情周期正常、发情表现显著,符合本试验顺利开展的先决条件。同时,依据发情周期的四期分法,我们发现该批次昆明小鼠间情期为3~4 d(CL活跃期),这为本试验选择在CL应答阶段实施PGF2α处理提供了必要的试验依据。
目前,大量研究证实母体的CL溶解过程与PGF2α之间存在一定的剂量依赖性关系。例如,JUENGEL等[10]和WATANABE等[22]研究发现低剂量PGF2α导致P4分泌减少,但不引起CL发生结构性溶解;相反,高剂量PGF2α不仅能够引起P4分泌减少,而且还能够促使CL出现结构性溶解。类似地,CUERVO-ARANGO等[23]研究报道,也进一步证实与单剂量PGF2α处理相比,双剂量PGF2α处理的母体CL表现出了更完全的“消溶”现象;但是,与前者不同的是CUERVO-ARANGO等[24]在进行3倍剂量PGF2α处理时发现,此时母体的CL溶解效果并未随着PGF2α剂量的递增而出现明显的优势“促溶”效应,提示PGF2α在母体中对CL的“促溶”作用并非一直呈正相关性,而是存在剂量/效应的临界值。本试验通过设置1,10,50,100,200 μg PGF2α5个不同剂量梯度处理间情期昆明小鼠,H.E染色观察小鼠CL形态学变化发现,PGF2α在50 μg剂量处理时呈现出最佳的CL“促溶”效应;而当其剂量递增或递减时均会表现出弱于前者的“促溶”作用,这一结果与GRANADOS-VILLARREAL等[25]运用不同梯度处理母羊CL时观察得到的CL溶解结果一致。因此,在本试验中,研究表明PGF2α对母体内的CL“促溶”效应与其剂量之间存在特定的临界值,即仅在该临界值范围内,PGF2α对其母体的CL溶解效果才会呈现明显的剂量依赖性。
CL溶解主要包括功能性退化和结构性溶解两个阶段,前者主要表现为P4水平的下降,而后者则主要表现为CL组织的细胞凋亡,最终促使CL发生结构性溶解[26-27]。首先,在CL功能性退化中,P4浓度的变化,是CL溶解过程中必不可少的关键环节。大量研究显示,CL退化过程中PGF2α水平的升高,通常会引起雌性动物体内P4分泌水平的下降[24,26-28]。不过,JUNIOR等[29]在研究瘤牛的CL溶解时发现,高剂量PGF2α处理母体时,并不总是诱导P4含量发生显著地变化,提示 PGF2α在CL的功能性退化过程中可能存在一定的剂量依赖性范围。在本试验中,通过ELISA法检测上述昆明小鼠外周血液的P4含量发现,PGF2α在50 μg剂量时昆明小鼠体内的P4含量呈现最低水平;与此类似,qRT-PCR结果显示,P4关键合成酶基因StAR和3β-HSD mRNA在PGF2α50 μg剂量时在昆明小鼠的CL中也呈现最低表达;这一结果与上述ELISA检测P4水平结果一致,说明在母体中CL的功能性退化效果确实与PGF2α剂量之间存在特定的临界值,即仅在该临界值范围内,CL的功能性退化程度才会呈现最佳剂量依赖性效果。不过,相较于功能性退化,CL结构性溶解显示出更为完全的CL组织的消失,主要表现为CL的细胞凋亡、引起CL组织结构的消融[30-31]。众所周知,BCL-2家族是介导细胞凋亡的重要调控中心[32-33];其中,抗凋亡BCL-2基因和促凋亡BAX基因是调节细胞存活和凋亡的两种关键因子[34],尤其是二者的比率变化更被认为是启动细胞凋亡发生的关键闸门[35]。有研究显示,与中期CL和妊娠早期CL相比,抗凋亡BCL-2基因在退行期CL中呈现较低表达,而促凋亡BAX基因则呈现较高表达[36-37],同时伴随着BAX/BCL-2比率的显著增加[38-39],这一结果提示BAX和BCL-2基因表达在CL退化溶解过程中发挥着重要作用。在本试验结果显示,随着PGF2α剂量的变化,BAX和BCL-2基因的表达也分别呈现不同程度的递增或递减;但却在50 μg时出现了明显的峰值与谷值,尤其是在此剂量时二者之间的比率呈现了唯一极显著上调(P<0.05),说明PGF2α在该临界值时表现出了最佳的促CL结构性溶解效果[12]。此外,作为细胞凋亡的最后执行者,Caspase-3在各种因素启动的凋亡程序中均起着最后枢纽的作用[39-41]。目前,已有大量研究证实,在不同的动物中,PGF2α均能够诱导CL中Caspase-3基因表达上调,从而开启CL细胞的凋亡过程[40-42]。类似地,在本试验中,研究结果也显示不同剂量的PGF2α处理组别中,Caspase-3基因的表达水平均呈现了不同程度的上调,且其表达变化趋势与上述BAX/BCL-2比率变化趋势结果一致,即在PGF2α50 μg时呈现最高水平,进一步说明PGF2α在该临界值时呈现出了最佳的促CL结构性溶解效应。因此,我们不难发现无论是在CL的功能性退化中还是在结构性溶解中,PGF2α对CL的溶解效果确实存在特定的剂量临界值范围,即仅在该范围内二者之间才会呈现明显的剂量依赖性关系。
总之,本试验通过监测昆明小鼠的发情周期,在明确了小鼠的CL活跃期的前提下,开展PGF2α剂量依赖性试验,发现外源性PGF2α对母体的CL溶解效果(功能性退化和结构性溶解)存在一定的剂量依赖性关系。但是,这种剂量依赖性关系存在一定的临界值,即仅在该临界值范围内,PGF2α才会与CL溶解呈现最佳的剂量依赖性效果,这为探析雌性动物的繁殖障碍性疾病机理(如持久CL或CL囊肿)、优化PGF2α主导的高效繁殖技术方案提供了新的科学依据。

