规模化猪场PRRSV血清驯化对母猪生产性能的影响
李 洋,杜兴乾,李志伟,马志倩,焦 点,荆 扬,何 员,冯英桐,肖书奇
(西北农林科技大学 动物医学学院,陕西 杨凌 712100)
猪繁殖与呼吸综合征(porcine reproductive and respiratory syndrome,PRRS)是由猪繁殖与呼吸综合征病毒(porcine reproductive and respiratory syndrome virus,PRRSV)引起的一种病毒性传染病[1]。据报道,PRRS每年对美国造成的经济损失高达6.64亿美元[2]。1996年,PRRSV首次在中国被分离[3],此后,2006年出现的高致病性PRRSV(HP-PRRSV)给中国养猪业造成了巨大的经济损失[4-5]。2013年前后,NADC30-like PRRSV开始在中国出现,并逐渐成为占有优势地位的流行毒株[6-9]。PRRSV是已知变异速度最快的RNA病毒之一,其核苷酸取代率约为每年4.7×10-2~ 9.8×10-2/碱基[10-12]。此外,PRRSV基因组间同源性较低,毒株多样性丰富,易于发生突变和重组而持续性进化,现有的疫苗难以对猪群提供充足保护,特别是针对近些年流行的NADC30-like PRRSV[13-18]。
除疫苗免疫外,研究人员正逐步探索出一种新的较为有效的PRRSV防控方案,即血清驯化,其在美国部分养猪场已有多年的运用历史[19-20]。血清驯化即通过野毒感染或人工弱毒感染健康猪的方式制备PRRSV阳性血清。再将采集的大量阳性血清按一定比例稀释后接种至全群,以诱导其他猪产生有效PRRSV抗体,从而实现对PRRSV防控的目的[21-22]。随着国内规模化养猪场的迅速发展,已有部分猪场尝试借鉴美国血清驯化的经验进行PRRS防控。杨玉坚等[23]以100日龄的后备母猪为研究对象进行了血清驯化,结果表明后备母猪的健康指数虽受到了影响,但平均值仍高于100,且血清驯化并未明显影响受驯化母猪的生产性能。曹玉美等[24]的研究结果表明受驯化母猪在血清驯化前、后的受胎率及分娩率均未发生明显变化,不过坚持1年后受驯化母猪的配种分娩率及存活子猪数量均有了明显升高,且猪群产生了较为稳定的PRRSV抗体。伍少钦等[21]对广西省某规模化养猪场的后备母猪进行封群管理并实施了血清驯化,最终成功在该场实现了PRRS净化。张宁等[25]的研究比较了血清驯化方案和传统疫苗免疫方案诱导母猪产生PRRSV抗体的能力,并评估了两者对受驯化母猪生产性能的影响,发现2种方案产生的效果并没有显著差异,表明血清驯化似乎可以作为常规疫苗接种防控PRRSV的替代方案。孙龙等[26]同样比较了猪场经血清驯化或常规疫苗免疫后防控PRRSV的效果,结果表明,这2种方案对受驯化母猪的生产水平影响不大,但血清驯化方案可以节省疫苗注射成本。
2013年前后,NADC30-like PRRSV开始在中国大陆流行,时至今日已逐渐成为优势流行毒株[27-30]。基于NADC30-like PRRSV毒株的血清驯化方案报道较少,探索NADC30-like PRRSV血清驯化方案具备实际意义[31-32]。
本研究对某曾暴发PRRS的养猪场进行种毒筛选分离PRRSV,以此为基础制定合理的NADC30-like PRRSV血清驯化方案,并科学评估血清驯化诱导的PRRSV抗体水平及对该猪场后备母猪生产性能的影响,以期为规模化养猪场防控PRRSV,特别是NADC30-like PRRSV提供新的数据支持和经验参考。
1 材料与方法
1.1 实验动物、细胞及试验试剂研究主要在山东省某规模化猪场和西北农林科技大学动物医学学院完成。MARC-145细胞和PAM细胞由本实验室保存;荧光抗体购自Abcam公司;制备大量驯化血清时所用的种公猪为该养猪场自国外引进,受驯化的后备母猪为该养猪场自留猪;PRRSV抗体检测试剂盒购自IDEXX公司;DNA聚合酶、反转录酶、荧光定量PCR试剂等购自南京诺唯赞生物科技股份有限公司;引物交由陕西中科羽瞳生物科技有限公司合成;测序交由北京擎科生物科技有限公司西安分公司完成。
1.2 引物序列本研究所用的病原检测引物如表1所示,分离毒株全基因组测定所需引物如表2所示。

表1 病原检测引物序列

表2 分离毒株全基因组测定引物
1.3 相关参考毒株见表3。
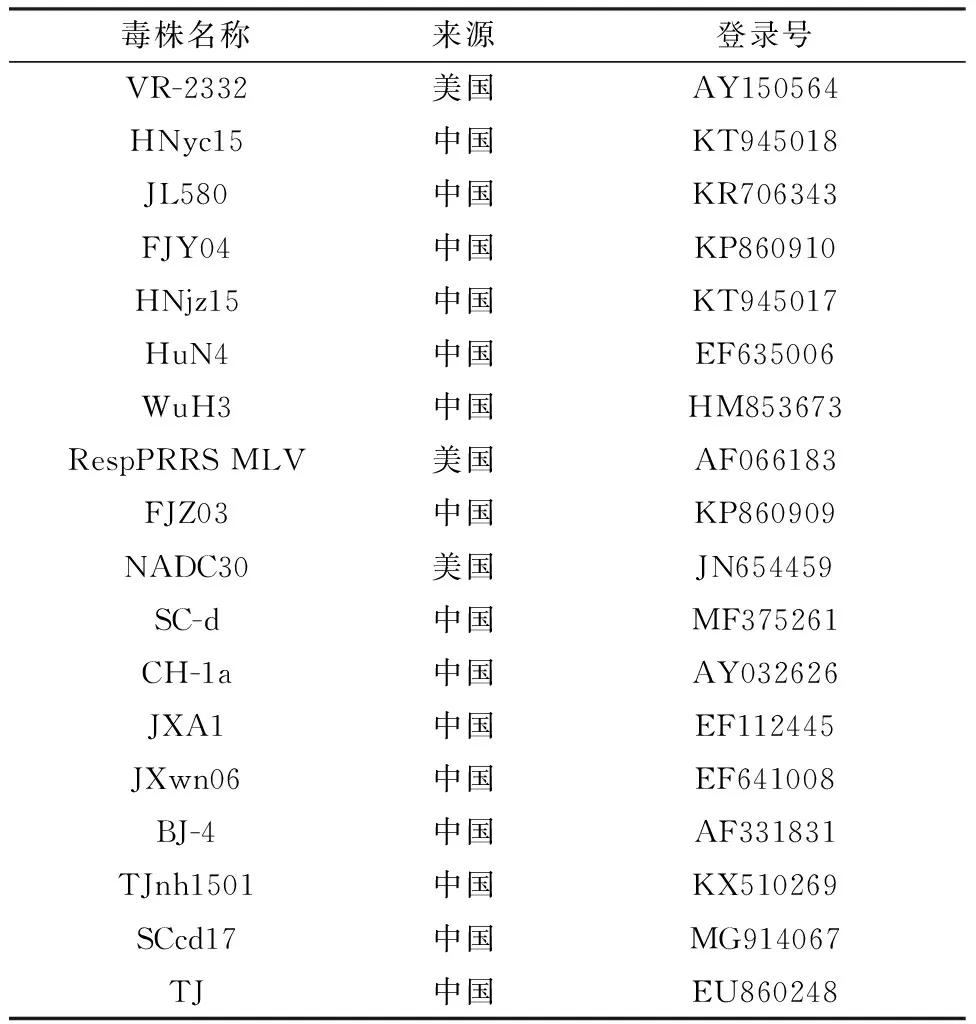
表3 参考毒株信息
1.4 相关分子生物学分析涉及的软件MegAlign、Editseq、SeqMan、SnapGene、BioEdit、SeqMan等用于分离毒株基因组测定及特性分析;GraphPad Prism 5.0用于数据处理,Photoshop、Adobe Illustrator CS6等用于图片处理;P<0.01表示差异极显著,P<0.05表示差异显著,P>0.05表示差异不显著。
1.5 样品的采集、处理与鉴定2016年初,山东省某规模化养猪场出现了疑似PRRS症状的大量症候猪群,采集发病猪血清后提取核酸并利用表1引物进行PCR鉴定。
1.6 PRRSV流行毒株分离及基因组特性分析选择PRRSV阳性血清进行病毒分离。将血清经0.22 μm滤器过滤后,接入长至单层的MARC-145细胞和PAM细胞上,于37℃、5% CO2条件下培养,每日观察CPE,待有显著CPE产生时,参照文献[32]方法对其进行IFA鉴定。
用表2中的引物测定分离毒株的全基因组,以表3中相关毒株作为参考毒株,对该PRRSV毒株的Nsp2基因、ORF5基因和全基因组分别进行进化分析及核苷酸同源性分析,以探究其在PRRSV毒株中的分类情况。
1.7 大量血清制备及血清中抗原检测血清驯化需制备大量目标PRRSV的阳性血清,用于制备大量血清的猪需无关抗原及PRRSV抗体水平呈阴性。注射上述NADC30-like PRRSV阳性血清至该养猪场自国外引进的健康种公猪体内,注射前1周在种公猪的饮水中添加阿莫西林,观察其临床表现。待猪出现明显临床症状时采集前腔静脉血分离血清200 mL/头。混合所有采集血清,无菌分装后冻存备用,随机选择3份送至实验室检验,核实其除PRRSV外其他无关抗原均保持阴性。
1.8 阳性血清稀释比的确定驯化血清中的病毒滴度是血清驯化效果的重要影响因素。血清稀释度过低会使待驯化母猪接受过量的PRRSV,增加了其发病的风险。血清稀释度过高时,血清中有效病毒含量较低,难以诱导受驯化猪快速产生高水平PRRSV抗体。因此,需探究合适的驯化血清稀释比例。在本研究中,将原始血清分别按1∶5 000,1∶1 250,1∶1 000,1∶500,1∶250,1∶200和1∶125的比例稀释至生理盐水中,提取RNA后用荧光定量PCR进行定量测定,以检测稀释血清样品中的PRRSV含量,最终根据测定结果估计阳性血清的稀释比。
为进一步验证上述稀释比(1∶250)可以满足血清驯化的需求,本研究先在60头健康猪体内按上述比例接种稀释血清,进行了持续3个月的血清驯化,并评估了按1∶250驯化后的PRRSV抗原和抗体水平。
1.9 对后备母猪实行血清驯化并评估其生产性能按上述稀释比将稀释血清肌肉注射至未免疫PRRSV疫苗的后备母猪体内实施血清驯化,同时注射1头份易速达。血清驯化前7 d在驯化母猪的饮水中添加阿莫西林,10 mg/kg。此后引进的健康猪在转入基础母猪群前均需先在隔离舍中完成血清驯化。
观察所有受驯化母猪的临床表现,定期采血测定其PRRSV抗体水平,记录各项生产指标,包括平均每月母猪死亡数、窝均木乃伊胎比、平均每月母猪死亡数、窝均断奶数、平均每月流产数、断奶仔猪数、每头母猪每年所能提供的断奶仔猪头数(PSY)等,以评估血清驯化诱导的PRRSV抗体水平,并探究其对规模化养猪场后备母猪生产性能的影响。
2 结果
2.1 发病猪血清病原检测及毒株分离采集发病猪的血清样品提取核酸并用表1中的引物对其进行病原检测。PCR检测结果表明样品为PRRSV阳性,且测序结果显示送检样品中Nsp2基因及ORF5基因序列均保持一致,即该场感染的PRRSV毒株为同一株PRRSV(结果未显示)。
在MARC-145细胞和PAM细胞上对猪场PRRSV阳性血清中的病毒进行分离,结果如图1所示,该PRRSV毒株(RD-YL)可在PAM细胞上产生明显CPE(图1A),但在MARC-145细胞上盲传3代仍无CPE产生。此外,IFA结果显示,该毒株在PAM细胞上能与PRRSV阳性血清发生反应,镜下可观察到明显的绿色荧光,但MARC-145细胞上未见荧光(图1B)。结果表明该PRRSV分离毒株能感染PAM细胞,但对MARC-145细胞失去了感染性。

图1 病毒分离的CPE(A)及IFA(B)鉴定
2.2 PRRSV分离毒株全基因组测定及进化分析如前所述测定PRRSV RD-YL毒株的全基因组序列,测序结果可知该PRRSV毒株的全基因组长度为15 044 bp。以表3毒株为参考,分别就Nsp2基因、ORF5基因和全基因组序列对该PRRSV分离株进行进化分析,结果见图2。
结果表明,RD-YL PRRSV毒株基于Nsp2基因(图2A)、ORF5基因(图2B)和全基因组序列(图2C)构建的进化树中,该毒株均与NADC30毒株处于同一进化分支上,与NADC30-like PRRSV集群的亲缘关系较近。
2.3 PRRSV分离毒株核苷酸同源性分析进一步在核苷酸水平对该毒株进行了同源性分析,结果见图3。
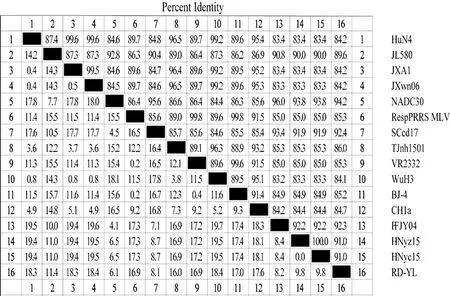
图3 RD-YL毒株核苷酸水平同源性分析
PRRSV RD-YL分离毒株与CH1a、JXA1、NADC30、VR2332等毒株核苷酸相似性分别为84.7%,84.2%,94.2%和85.3%,与NADC30 PRRSV同源性最高,表明其属于目前处于优势地位的NADC30-like PRRSV。
2.4 驯化血清的大量制备及抗原检测选择该养猪场引入的健康种公猪注射上述PRRSV阳性血清,大量采集血清后混匀,随机选出3份进行病原检测,结果见表4。检测结果显示制备的大量血清中PRRSV抗原均阳性,其余无关抗原均为阴性,符合预期。
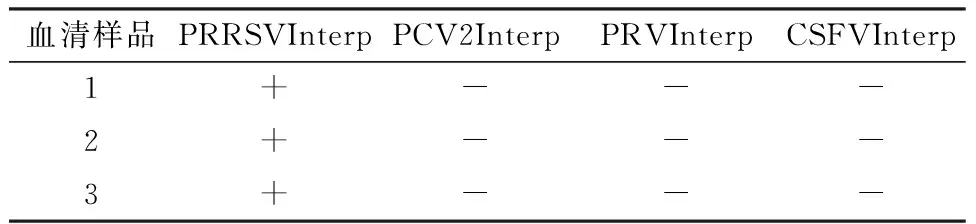
表4 大量制备的PRRSV阳性血清抗原检测
2.5 驯化血清稀释比的确定将稀释好的系列阳性血清提取RNA进行RT-qPCR,以确定合适的稀释比例,所用的标准品为PRRSV-ORF7 基因所构建的质粒。最终,当稀释比例为1∶125,1∶200和1∶250时,qPCR检测起峰明显,Ct值小于30;1∶500稀释时,起峰晚,置信度低;当按1∶1 000,1∶1 250,1∶5 000稀释时,未见起峰,无Ct值。结果表明,可尝试按1∶250的稀释比进行血清驯化。
为了进一步验证上述摸索的稀释比能否满足需求,本研究按该稀释比在60头健康母猪上进行了小规模的血清驯化,为期3个月,结果如表5所示。

表5 血清驯化前、后PRRSV抗原及抗体检测
结果显示驯化前、后后备母猪均未检出PRRSV抗原,符合预期;此外,驯化后1个月,出现PRRSV抗体血清转化的母猪比例达50%,此后逐月升高;在血清驯化持续3个月时,驯化母猪PRRSV抗体阳性率达100% (过程中有2头猪因无关原因死亡)。综上,该稀释比符合预期,可以按该比例进行后续血清驯化。
2.6 受驯化母猪PRRSV抗体水平及生产性能评估该养猪场在血清驯化前曾暴发过PRRS,为了进一步比较血清驯化对该猪场后备母猪生产性能的影响,将驯化前PRRSV发病期、驯化前时期、驯化后时期3个阶段的各项生产指标放在一起进行了比较分析。
2.6.1受驯化母猪PRRSV抗体水平 2018年10月起,本研究对该养猪场的后备母猪进行了血清驯化,并连续6个月随机采血测定了受驯化母猪的PRRSV抗体水平,结果见表6。
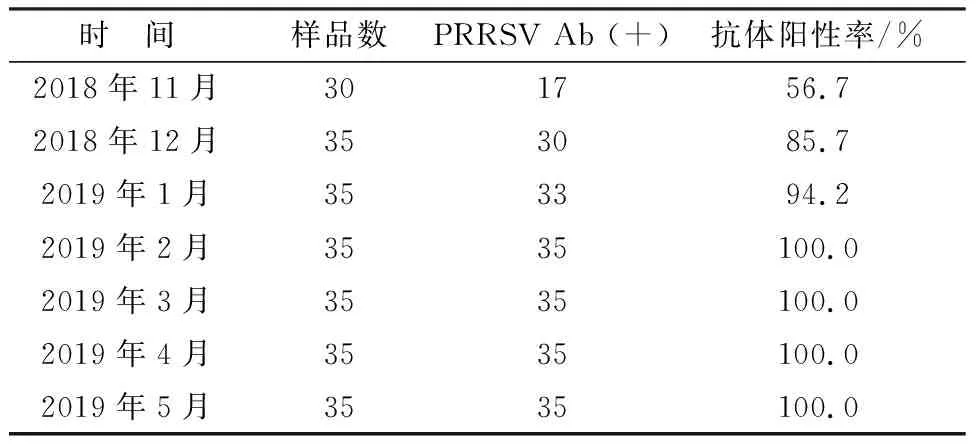
表6 血清驯化后母猪PRRSV抗体水平
结果显示,接受血清驯化1个月后,有56.7%的母猪实现了PRRSV抗体的血清转化,此后PRRSV抗体阳性率逐月升高,驯化后3个月时有94.2%的受驯化母猪体内产生了PRRSV抗体;驯化后4个月时抽检的受驯化母猪均产生了PRRSV抗体,抗体阳性率达100%。结果表明,在该规模化养猪场进行的NADC30-like PRRSV血清驯化成功诱导母猪群产生了较高水平的PRRSV抗体。
2.6.2后备猪群平均每月流产数 由图4可知,驯化前PRRSV发病期流产数最高,驯化前和驯化后1年平均每月流产数均显著低于驯化前PRRSV发病期(P<0.01),驯化后1年平均每月流产数较驯化前平均每月流产数有所下降,降幅为3.1%,但并无显著性差异(P>0.05),表明血清驯化并未影响后备母猪平均每月流产数。

图4 该后备猪群平均每月流产数
2.6.3平均每月母猪死亡数 由图5可知,驯化前PRRSV发病期母猪死亡头数显著高于未发病期(P<0.01),但血清驯化前和血清驯化后1年的平均每月母猪死亡头数无显著性差异(P>0.05),表明血清驯化并未明显影响后备母猪的平均每月母猪死亡数。
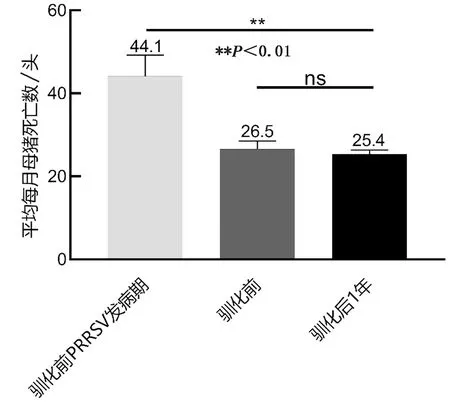
图5 该后备猪群平均每月死亡母猪数
2.6.4窝平均木乃伊胎比例 由图6可知,驯化前PRRSV发病期的窝均木乃伊胎比例最高,显著高于未感染PRRSV时期(P<0.01)。此外,驯化后1年窝均木乃伊胎比例显著低于血清驯化前(P<0.05),表明血清驯化能显著降低后备母猪窝均木乃伊胎比例。

图6 驯化前、后平均每窝产木乃伊胎比例
2.6.5窝均断奶数 由图7可知,驯化前PRRSV发病期窝均断奶仔猪的数量最低,显著低于未感染时(P<0.05)。血清驯化后1年与血清驯化前相比,窝均断奶数无显著性差异(P>0.05),表明血清驯化并未明显影响后备猪的窝均断奶数。
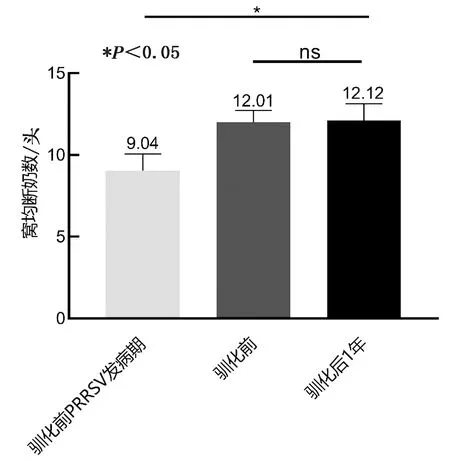
图7 驯化前、后窝均断奶数
2.6.6断奶仔猪头数 由图8可知,驯化前PRRSV发病期断奶仔猪数最低,但血清驯化前、驯化后的断奶仔猪数无显著性差异(P>0.05),表明血清驯化并未对该猪场的断奶仔猪头数造成显著影响。
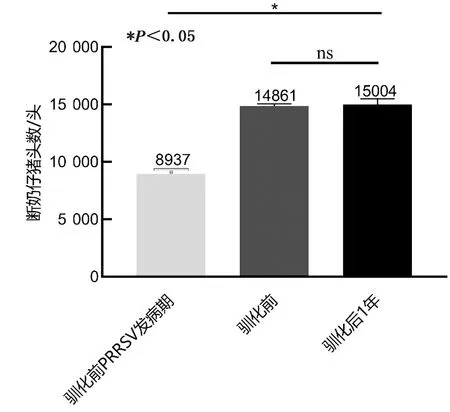
图8 驯化前、后断奶仔猪数
2.6.7PSY PSY是规模化猪场最关键的生产指标。该规模化猪场驯化前、后PSY的结果见图9。
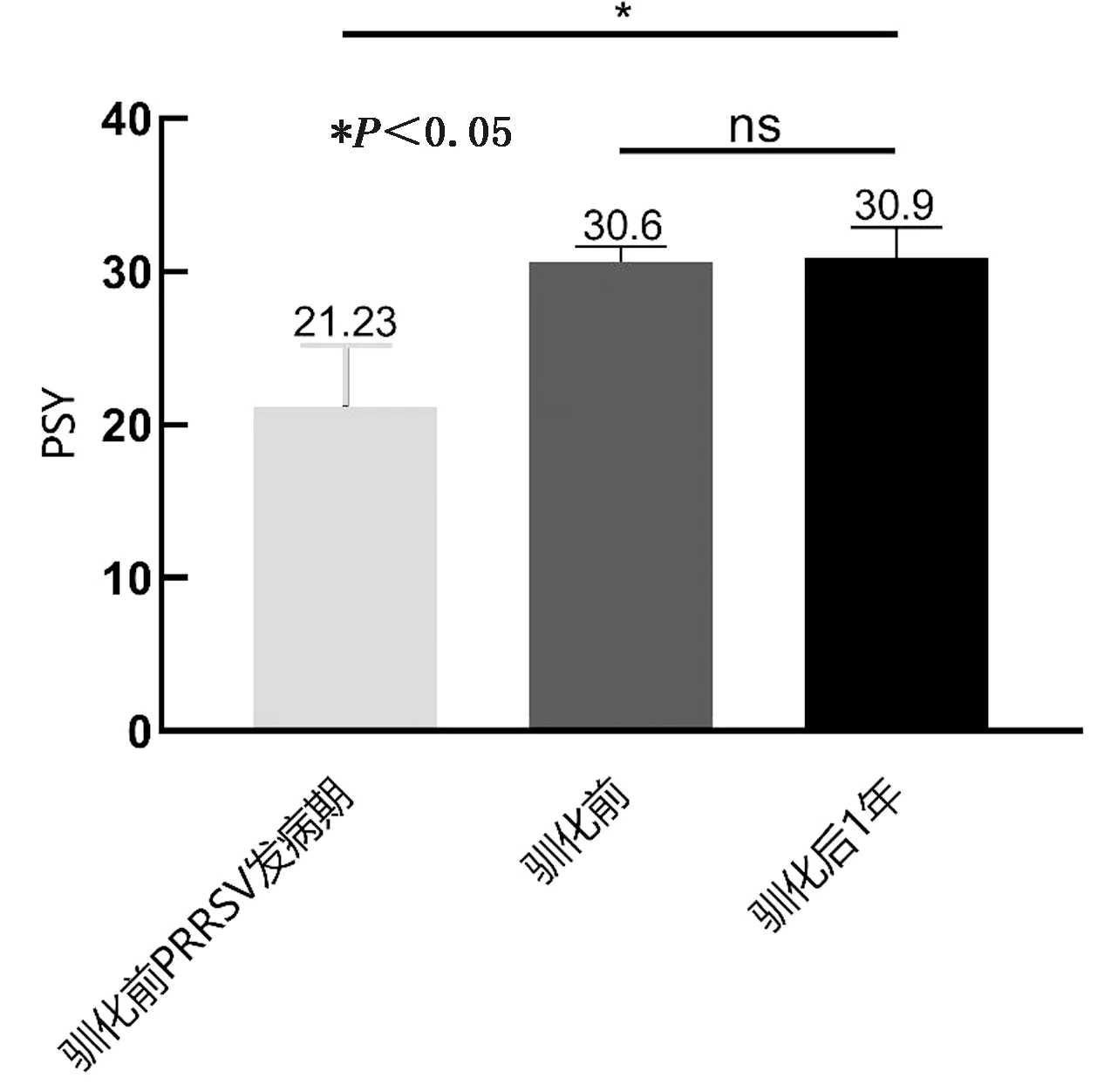
图9 驯化前、后PSY值
由图9可知,驯化前PRRSV发病期时该猪场的PSY值最低,为21.23,显著低于驯化前及驯化后水平(P<0.05)。但血清驯化前、后该猪场PSY并无显著性差异(P>0.05),表明血清驯化并未对该场PSY造成明显影响。
3 讨论
PRRSV是一种高度变异的RNA病毒,常规疫苗接种已逐渐难以对其提供有效的交叉保护,特别是针对近些年加大流行的NADC30-like PRRSV。本研究对山东省某暴发PRRS的规模化养猪场进行了病原分离鉴定并分析了其基因组特性,证实其属于NADC30-like PRRSV,与HP-PRRSV商品化疫苗和经典PRRSV商品化疫苗的原型毒株的亲缘关系均较远。鉴于该分离毒株是目前田间优势流行毒株,且是在该养猪场分离,具有一定的代表性,故以该分离毒株的阳性血清为原型进行血清驯化。
血清驯化的优点是具备程序性。一方面,猪群受驯化时间可以经人为控制而尽可能保持一致性。另一方面,由于驯化PRRSV血清类型的纯粹性,可以使猪群尽可能获得一致性的抗体,且可能在一定程度上提升母猪的繁殖性能和生产性能[34]。此外,血清驯化方案实施时具有一定的复杂性。如难以确定驯化血清的稀释比例。血毒载量过高时可能加剧PRRS的暴发,而亚病毒浓度的阳性血清又难以诱导机体在短时间内迅速产生高效的抗体,甚至可能由于抗体依赖增强(ADE)效应而引起严重的后果等[35]。最佳血清稀释比的确定是一个关键问题。刘德清等[36]将原始血清按1∶120,1∶150,1∶200,1∶300,1∶600,1∶1 200,1∶3 000等比例进行了系列稀释后进行了RT-PCR,发现当稀释度大于1∶1 200时PCR无法扩增出阳性条带,认为1∶1 200稀释是该批次血清的检测限,随后,其提升10倍按1∶120对血清进行稀释后进行了血清驯化。在本研究中,我们借助RT-qPCR的方法摸索了血清适宜的稀释度,具体操作是将原始血清按不同比例进行稀释,再经RT-qPCR分析其扩增情况,选择临近无扩增曲线的稀释度作为参考稀释度。之后在60头健康猪上按该比例进行血清驯化预试验,以评估该稀释比的安全性和有效性,结果表明该稀释度能有效诱导受驯化母猪产生PRRSV抗体且未检测到病毒,符合预期。值得注意的是,最佳血清稀释比有其专门的定义,以能产生较高水平抗体且不排毒的稀释度为最佳稀释比,且只能通过动物试验确定。本研究受条件所限,采用RT-qPCR来确定血清稀释比的方法并不十分严谨和科学,且受血清抗体效价、定量检测方法灵敏度、试验仪器等客观因素影响较大。在条件允许的情况下,仍建议对血清进行梯度稀释后通过动物试验来系统的确定最佳稀释比。
有研究结果显示血清驯化方案能使规模化猪场产生有效的PRRSV抗体,且能显著改善猪场内PRRSV感染的持续周期[37]。本研究中,经过血清驯化的猪群在1个月后即有56.7%的母猪产生了PRRSV抗体,4个月时PRRSV抗体已覆盖抽检的全部猪群,表明血清驯化确实在短时间内诱导母猪产生了高效的PRRSV抗体。
伍少钦等[21]的研究结果显示受驯化母猪群的分娩率和窝产活仔数均显著提高。本研究中,血清驯化前和血清驯化后1年该猪场的平均每月流产数、平均每月母猪死亡数、窝均断奶数、断奶仔猪头数和PSY等生产指标并无显著性差异,但驯化后1年的窝均木乃伊胎比例较驯化前显著降低,表明在该场进行的NADC30-like PRRSV血清驯化并未对受驯化母猪的生产性能造成不良影响,甚至降低了其窝均木乃伊胎比例。
刘德清等[36]的研究比较了疫苗免疫与血清驯化防控PRRS的效果,试验结果显示血清驯化与疫苗免疫均能提高猪群的PRRSV抗体水平,且在影响母猪生产性能方面有相似的效果。本研究中用到的阳性血清的原型毒株是NADC30-like PRRSV,目前尚无以该类毒株为原型毒株的疫苗面市,现有疫苗对其防护效果并不十分充足,且考虑到尽可能避免由人为引入多种PRRSV毒株而造成的重组毒株的出现,本研究在进行血清驯化时并未设置同型疫苗组对照。
综上,本研究自山东省某规模化养猪场采集阳性血清并分离了PRRSV流行株RD-YL。基因组特性分析表明该毒株为NADC30-like PRRSV,属于近年流行的优势毒株。用该毒株阳性血清注射健康猪制备大量血清,按1∶250稀释后对后备母猪进行血清驯化。结果显示驯化后猪群短时间内产生了高水平的PRRSV抗体。此外,血清驯化并未对受驯化母猪的生产性能产生不良影响,甚至显著降低了其木乃伊胎比例。这表明血清驯化是该规模化猪场防控PRRS的有效方案。本研究为规模化猪场通过血清驯化防控PRRSV,特别是NADC30-like PRRSV提供了数据支持和经验参考。

