经一氧化氮吸入治疗的新生儿持续肺动脉高压患儿死亡的早期影响因素分析
钱爱民 朱雯 杨洋 卢刻羽 王加莉 陈许 郭楚楚 陆亚东 戎惠 程锐
(南京医科大学附属儿童医院新生儿医疗中心,江苏南京 210008)
新生儿持续肺动脉高压(persistent pulmonary hypertension of the newborn,PPHN)是新生儿危重症,病死率高达7.3%~20.6%[1-3]。一氧化氮(nitric oxide,NO)为选择性肺血管扩张剂,是PPHN病情严重的足月儿和近足月儿的标准治疗手段。然而,并非所有患儿在NO吸入(inhaled NO,iNO)治疗后都有氧合改善的反应。据报道,仅有60%~70%PPHN患儿对iNO治疗显效[4]。因此,即使采用了iNO治疗的PPHN患儿病死率仍较高。在病程早期发现此类患儿死亡的影响因素,将有助于临床医生识别高危患儿、制定治疗策略,对降低PPHN患儿病死率至关重要。
有研究表明不同患儿对iNO 治疗反应时间不同[5]。iNO 治疗后1 h 内氧合改善被多数研究作为iNO 早期反应的指标[6-8]。理论上,iNO 早期反应的患儿能尽早逆转低氧血症、改善灌注、避免长时间使用高呼吸机参数及高吸入氧浓度,其临床预后应该比非早期反应的患儿好。但真实世界是否如此,目前尚缺乏相关研究。本研究旨在探索iNO 治疗的PPHN 患儿死亡的早期影响因素,并探讨iNO非早期反应与患儿死亡的关系。
1 资料与方法
1.1 研究对象
收集2017 年7 月至2021 年3 月我院新生儿医疗中心收治的PPHN患儿的临床资料进行回顾性分析。纳入标准:胎龄≥34 周;入院日龄<7 d。排除标准:治疗过程中未使用iNO治疗;外院或转运途中(即入院前)已使用iNO治疗;iNO治疗前输注红细胞悬液;有紫绀型先天性心脏病;伴有其他重要畸形;有染色体、基因病;有遗传代谢性疾病。根据出院时临床结局分为存活组和死亡组。死亡组包括在院死亡和放弃治疗后24 h 内死亡的患儿(放弃治疗原因与PPHN 程度有关)。iNO 治疗后1 h 血氧饱和度指数(oxygen saturation index,OSI)下降≥5%定义为iNO 早期反应;反之,iNO治疗后1 h OSI下降<5%、无变化或上升定义为iNO非早期反应。本研究已获得本院伦理委员会批准(202110092-1)。
1.2 PPHN诊断标准
临床表现为难治性低氧血症,并且至少合并以下3项标准中的1项[9]:(1)超声心动图证实的肺动脉压力升高(导管/心房水平右向左或者双向分流);(2) 导管前与导管后动脉血氧分压(partial pressure of oxygen,PaO2)的差异至少10~20 mm Hg;(3)导管前与导管后经皮血氧饱和度(arterial oxygen saturation,SaO2)梯度≥0.05。本研究中所有患儿的心脏超声均由我院专业的心脏超声医生床边完成。所有患儿PPHN的诊断均由超声证实。
1.3 资料收集
通过查阅电子病历收集患儿资料。(1)一般资料:性别、胎龄、出生体重、开始iNO 时的日龄;(2)围生期情况:分娩方式、有无胎儿宫内窘迫、是否多胎、有无胎膜早破、羊水胎粪污染、Apgar 评分、有无产房复苏;(3)孕母情况:孕母年龄、有无子痫、有无糖尿病;(4)入院12 h 内生理相关指标:最低平均血压、最低体温、最低PaO2/吸入氧浓度(fraction of inspired oxygen,FiO2)值、最低血气pH 值、尿量;(5)入院12 h 内的治疗方法:是否使用高频通气、肺表面活性物质;(6)超声指标:肺动脉压力;(7)引起PPHN的主要病因:胎粪吸入综合征(meconium aspiration syndrome, MAS)、 新 生 儿 呼 吸 窘 迫 综 合 征(respiratory distress syndrome,RDS)、宫内感染性肺炎、窒息、败血症(包括临床诊断和确定诊断)[10];(8)有无合并症:气胸、肺出血、急性肾功能损伤(肾功能在48 h 内迅速减退,血肌酐升高≥0.3 mg/dL,或较基础值升高≥50%;每小时尿量<0.5 mL/kg 超过6 h)[11];(9)iNO 治疗前及治疗后1 h的OSI值,OSI=平均气道压×FiO2×100/血氧饱和 度 (oxygen saturation as measured by pulse oximetry,SpO2)[12];(10)iNO治疗是否早期反应;(11)预后情况(存活、死亡);(12)开始iNO 治疗至出院或死亡的时间。MAS、RDS、窒息、宫内感染性肺炎、先天性膈疝、胎儿水肿、肾发育不全、气胸、肺出血的诊断标准见《实用新生儿学》第5版[13]。
1.4 iNO治疗原则
PPHN 诊断明确,综合治疗(包括机械通气、循环支持、纠正酸中毒等)后不能改善呼吸衰竭,氧合指数(oxygenation index,OI)>25的情况下开始iNO治疗。起始吸入浓度20 ppm,SpO2逐步平稳并维持在94%~98%,考虑逐渐下调FiO2(维持SpO2在94%~98%,且每小时FiO2下降不能大于10%)。当FiO2≤60%时,NO 浓度从20 ppm 降到10 ppm,等待30 min 按照上述方法逐步下调FiO2。能耐受的情况下每4 h下调1次NO浓度(10 ppm至5 ppm,5 ppm 至3 ppm,3 ppm 至2 ppm,2 ppm 至1 ppm),浓度为1 ppm时,FiO2增加10%,停止NO吸入。耐受的定义为PaO2下降≤20%或者SpO2下降≤5%并能维持FiO2。如不能耐受NO 下调,回到原先NO浓度,4 h后重新开始下调NO浓度。每次下调NO后等待30 min再下调FiO2。
1.5 统计学分析
应用SPSS 26.0 统计软件对数据进行统计学分析。正态分布的计量资料以均数±标准差(±s)表示,不符合正态分布的计量资料以中位数(四分位数间距)[M(P25,P75)]表示,计数资料以百分率(%)表示。以开始iNO治疗至出院或死亡的时间为时间变量,是否死亡为结局变量,文中所列的临床变量为协变量,采用单因素Cox回归分析患儿死亡的可能影响因素,进一步应用多因素Cox回归分析(向前:LR法)探索PPHN患儿死亡的独立影响因素。采用受试者工作特征(receiver operating characteristic,ROC)曲线计算独立影响因素(定量数据)预测患儿死亡的截断值及预测价值。P<0.05为差异有统计学意义。
2 结果
2.1 一般情况
研究期间共收治胎龄≥34 周的PPHN 患儿164例,158 例入院日龄<7 d,排除紫绀型先天性心脏病26 例、未使用iNO 治疗15 例、其他重要畸形共6例、外院或转运途中已使用iNO治疗2例、iNO治疗前输注红细胞悬液2例、异戊酸血症1例、染色体病1例,最终纳入iNO治疗的PPHN患儿105例。其中男70 例,女35 例,胎龄(38.4±1.9)周,出生体重(3299±600)g。存活组79 例(75.2%),死亡组26 例(24.8%)。105 例iNO 治疗的患儿中,早期反应60 例(57.1%),非早期反应45 例(42.9%)。
2.2 105 例iNO 治疗PPHN 患儿预后因素的单因素Cox回归分析
单因素Cox 回归分析表明女性、胎龄大、1 min Apgar 评分≤3 分、5 min Apgar 评分≤3 分、入院12 h 内最低PaO2/FiO2值较低、入院12 h 内最低pH 值较低、高肺动脉压力及iNO 治疗非早期反应是iNO 治疗PPHN 患儿死亡的影响因素(均P<0.05),而病因RDS 为患儿死亡的保护因素(P=0.023)。见表1。
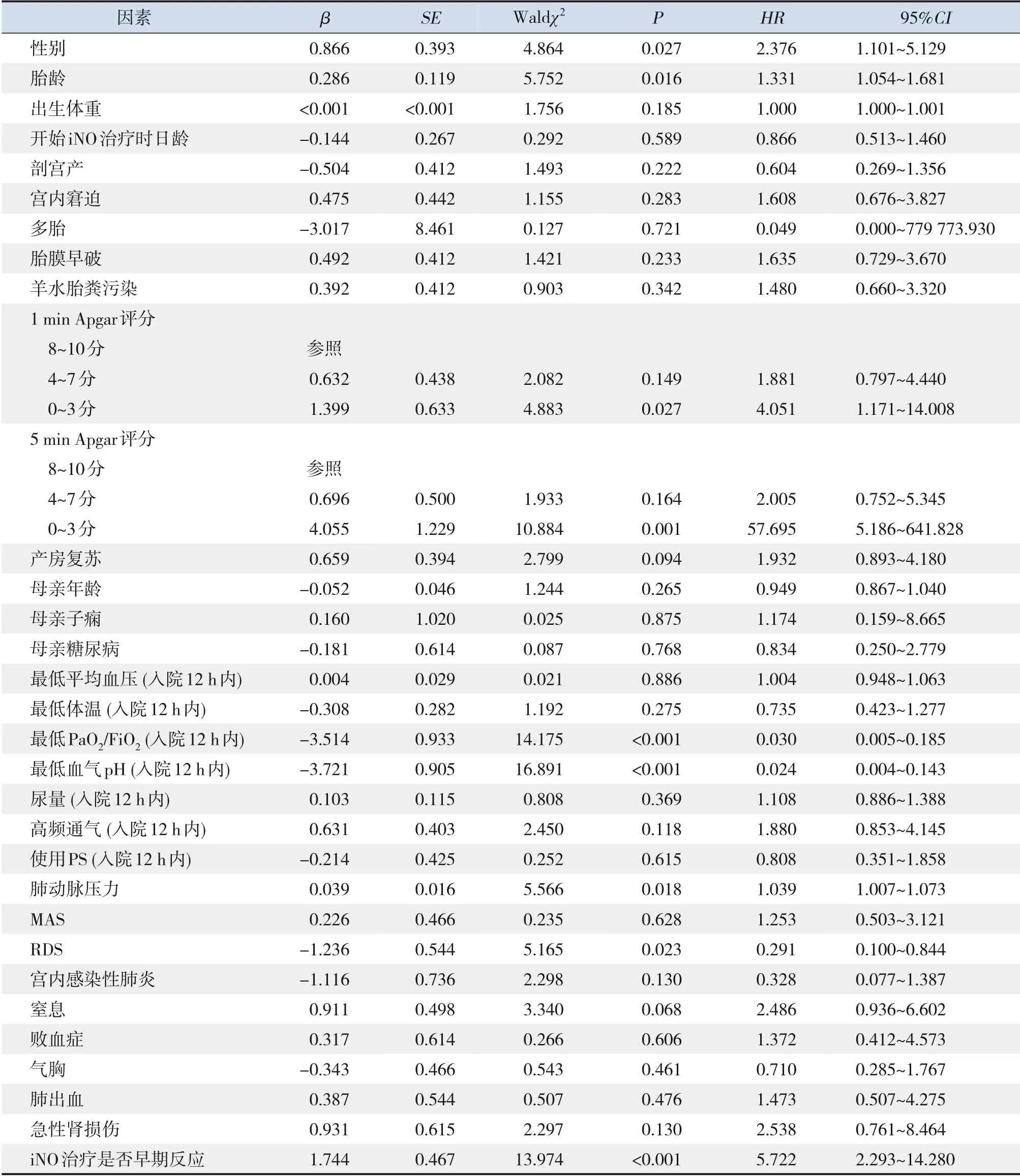
表1 105例iNO治疗PPHN患儿预后因素的单因素Cox回归分析
2.3 105 例iNO 治疗PPHN 患儿预后因素的多因素Cox回归分析
将单因素分析中有统计学意义的指标纳入多因素Cox 回归模型,结果显示,iNO 治疗非早期反应、1 min Apgar 评分≤3 分、入院12 h 内最低PaO2/FiO2值较低及最低血气pH 值较低是患儿死亡的独立影响因素(均P<0.05)。见表2。
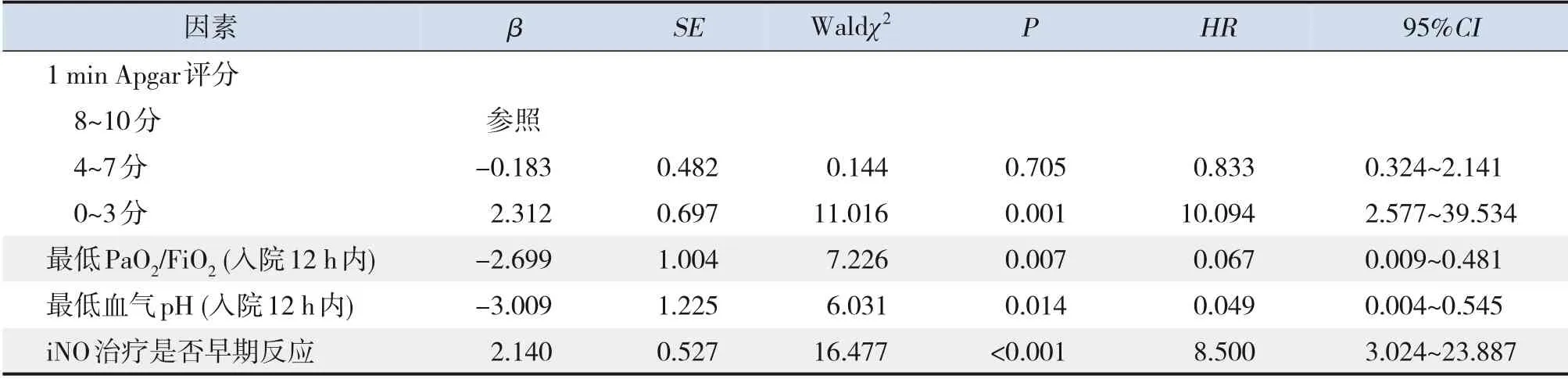
表2 105例iNO治疗PPHN患儿预后因素的多因素Cox回归分析
2.4 入院12 h 内最低PaO2/FiO2值及最低血气pH值预测死亡的ROC曲线分析
以入院12 h 内最低PaO2/FiO2值及最低血气pH值绘制ROC 曲线,曲线下面积(area under the curve,AUC)分别为0.783、0.746,约登指数分别为0.580、0.427,预测死亡的截断值分别为50、7.2,对应的灵敏度、特异度分别为84.6%、73.4%及76.9%、65.8%。见图1。
3 讨论
本研究结果显示iNO治疗的PPHN患儿病死率为24.8%,与既往研究报道的病死率(30%左右)相近[14-16]。鉴于此类患儿的高病死率,在病程早期识别死亡高危儿尤为重要。本研究发现,iNO治疗非早期反应、1 min Apgar 评分≤3 分、入院12 h内最低PaO2/FiO2值较低及最低pH值较低是患儿死亡的独立影响因素。上述指标临床上容易获得、易于计算,便于开展高危儿早期识别及危险分层,临床实用性较强。
既往研究采用不同的指标来评估患儿对iNO治疗 的 反 应, 包 括 OI、 PaO2、 PaO2/FiO2及SpO2[5,14,16-18],其中以PaO2或OI较为常见。但这2个指标均需采血测定PaO2,本研究作为一项回顾性研究,收集不同患儿的PaO2在采血时间点及标本取样位置(导管前、导管后)之间存在差异,这是本研究的难点。OSI与OI之间存在高度的相关性及一致性,已在儿童重症监护病房患者中作为评估呼吸衰竭及肺损伤严重程度的可靠指标[19-21]。同样的,OSI与OI之间良好的相关性在需要呼吸机支持的新生儿低氧性呼吸衰竭患儿中也已得以验证,可以用来评估低氧性呼吸衰竭及PPHN患儿的氧合状态[12,22]。故本研究采用OSI评估iNO治疗后患儿氧合状态的变化,避免了PaO2在时间点及标本取样位置上的异质性。Bischoff 等[18]研究发现iNO 治疗后1 h 起反应的患儿占比62.8% (115/183),Hwang等[16]的研究为54.9%(28/51),与本研究57.1%(60/105)相近。这亦证明了本研究采用OSI评估治疗反应的可行性及合理性,为后续这方面研究提供了新的思路及方法。
本研究发现非早期反应的患儿死亡风险为早期反应患儿的8.5 倍。非早期反应的患儿iNO 治疗时间延长将抑制内源性NO 合酶,导致内源性NO产生减少[23],并且长时间高浓度吸入氧增加了自由基的损伤[24]。同时这些患儿肺动脉高压无法及时逆转,将导致持续低氧、低灌注状态,进而加重肺动脉高压,形成恶性循环。这些均极大增加了非早期反应患儿死亡的风险。因此对于iNO治疗后1 h仍然无反应的患儿尝试其他替代治疗或许有助于改善预后。同时探寻非早期反应的影响因素,如适当放宽iNO适应证,是否能减少非早期反应的发生及改善患儿预后,是后续研究的焦点。
本研究结果显示1 min Apgar 评分≤3 分患儿的死亡风险是1 min Apgar评分8~10分患儿的10.1倍,这与过去研究结果窒息容易导致iNO治疗无反应相仿[14,16-17]。原因考虑如下。首先,出生时重度窒息会导致体内NO 合酶显著降低,内源性NO 生成减少[25],会引起肺血管收缩,干扰胎儿循环向成人循环过渡,增加了严重PPHN的风险。其次,窒息引起的氧化应激反应导致超氧阴离子的增加会影响NO的生物利用度,减弱iNO治疗作用[26]。最后,重度窒息临床上常合并左心功能不全。左心功能不全会导致肺静脉高压、肺水肿及体循环低灌注。iNO治疗后肺动脉血流增加会导致肺静脉压力进一步升高,加重肺水肿,同时体循环灌注进一步减少,使得病情恶化[27],这种情况下应谨慎使用iNO治疗。我们建议重度窒息患儿在iNO治疗前或者开始后效果不佳的情况下应尽快行心脏超声检查,明确有无左心功能不全,改善左心功能是关键。另外,本研究发现1 min Apgar评分4~7分不是死亡的影响因素,某种意义上体现了生后复苏“黄金1 分钟”的重要性[28],避免1 min Apgar评分≤3分,将有助于改善PPHN患儿的预后。
本研究还发现入院12 h 内最低PaO2/FiO2值及最低pH值是患儿死亡的独立影响因素。ROC分析发现入院12 h内最低PaO2/FiO2值及最低pH 值预测死亡的AUC分别为0.783、0.746,提示具有较好预测价值,其对应的截断值分别为50和7.2。也就是说,患儿入院12 h 内最低PaO2/FiO2值<50 或最低pH 值<7.2,其死亡的风险相对较大。PaO2/FiO2值<50及pH值<7.2反映了PPHN病情更严重,更容易导致死亡。其次这种程度的低氧合、酸中毒状态容易与肺动脉高压之间形成恶性循环,导致iNO治疗效果不佳。Morel 等[17]研究亦表明低PaO2值及pH 值容易导致iNO 治疗无反应。值得注意的是,PPHN常常与严重低氧血症有关,严重低氧血症容易导致严重代谢性酸中毒。而本文PaO2/FiO2值及pH 值预测死亡的截断值并非特别低,主要与为了能早期预测死亡,本文选取指标的时间范围为入院12 h 内有关。随着病程时间的延长,可能形成更严重的低氧血症及酸中毒。
综上所述,本研究发现iNO 治疗非早期反应、1 min Apgar 评分≤3 分、入院12 h 内最低PaO2/FiO2值<50及最低血气pH值<7.2是iNO治疗的PPHN患儿死亡的独立影响因素,需引起重视。本研究为单中心回顾性研究,需大样本多中心前瞻性研究验证。
利益冲突声明:所有作者均声明不存在利益冲突。

