LaFe0.5Co0.5O3光助-芬顿催化性能和催化机理
陈建新,卫培垚,张艺伟,刘力章,冯 斐,邵 莉
(1.南昌大学a.资源与环境学院;b.鄱阳湖环境与资源利用教育部重点实验室,江西 南昌 330031;2.江西省生态环境科学研究与规划院,江西 南昌 330077)
染料废水具有水量大、水质变化大、色度高等特点,是一类难降解有机工业废水。芬顿技术是难降解有机废水的高效处理技术之一[1,2],具有处理效率高、反应速度快等优点。在均相芬顿处理体系中,催化剂铁离子存在于液相中,反应结束后难以回收再利用;另外由于液相中铁离子随处理后的废水一起排出,存在二次污染的隐患[3]。利用固体催化剂作为铁源替换液态铁离子催化剂的多相芬顿技术能解决这一难题,因为固体催化剂可以通过简单的固-液分离操作避免铁离子的二次污染,同时实现催化剂的回收再利用[4]。
多相芬顿技术技术的核心是固体催化剂的开发。近年来,在掺杂金属氧化物固体催化剂的研究中,钙钛矿型催化剂是一个重要的分支[5]。钙钛矿是一种新型无机非金属光-电材料,其理想晶体结构为稳定的立方体结构[6],表示为ABO3,其结构见图1[7]。A位粒子半径比B位粒子半径大,通常A位粒子为稀土元素或碱金属元素,B位粒子一般为过渡金属元素。A位粒子与12个氧原子配位,位于立方体体心;B位粒子与6个氧原子配位,位于立方体面心,是主要的活性中心[7]。
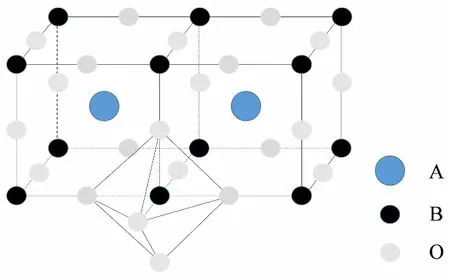
图1 ABO3钙钛矿型氧化物的结构[7]Fig.1 Structure of ABO3 Perovskite Oxides
ABO3钙钛矿作为多相芬顿的催化剂具有广泛的应用前景,其晶体A位或B位的元素都可被半径相近的其他金属离子部分或者全部替换,虽然钙钛矿晶体结构基本不变,但晶格上的元素离子往往会呈现不常见的氧化价态[8],从而表现出特殊的催化性能。
LaMnO3、LaFeO3等A位为La的LaBO3型钙钛矿具有较窄的带隙以及较高的稳定性,是一种理想的光催化材料[9]。其中,B位为Fe的铁酸镧(LaFeO3)在催化氧化性能和结构稳定性上有优异的表现[10,11],具有优异的电学和光学性能[12]。常晴等人研究发现,LaFeO3的带隙较窄,对光响应范围更广,是一种理想的光催化剂,通过改进其制备条件和方法,有望进一步提高其光催化性能[12]。
研究表明[13],对于LaBO3型钙钛矿,B位掺杂是一种有效提高材料光催化性能的方法。一方面,掺杂能够减小催化剂的带隙,使得其可以吸收更低能量的光子进行激发,从而提高光催化性能[14];此外,掺杂后的材料表面会产生氧空位缺陷,降低光生电子和光生空穴的复合率,进而加强光催化效果[10]。目前,B位掺杂铁酸镧在光助-芬顿体系中的催化机理尚不明确,特别是半导体光催化和光助-芬顿过程之间是否存在协同作用亟待深入研究,以期为钙钛矿型光助-芬顿催化剂开发提供理论依据。
前期对LaFeO3钙钛矿B位掺杂型光助-芬顿催化剂进行了大量的筛选研究,发现钴离子B位掺杂LaFeO3可以极大提高其催化性能;当Co元素以1:1的比例B位掺杂时,催化剂(LaFe0.5Co0.5O3,LFC)的催化能力最强。本文以偶氮染料橙Ⅱ作为探针分子,通过其脱色和矿化速率,考察了LaFe0.5Co0.5O3光助-芬顿催化能力;通过催化循环实验和物化表征,研究其催化的稳定性;通过自由基淬灭实验和羟基自由基浓度分析,探讨了其光助-芬顿催化机理,分析了其半导体光催化和光助-芬顿过程之间的协同作用,为多相光助-芬顿废水处理技术的开发应用提供理论依据。
1 材料与方法
1.1 实验仪器
PCX50C Discover多通道光催化反应系统(北京泊菲莱科技有限公司);SX2-4-10箱式电阻炉(上海实验仪器厂有限公司);Optima2100DV ICP发射光谱仪(美国PerkinElmer公司);QE65Pro光谱仪(美国Ocean Optics);Nicolet is50傅里叶变换红外光谱仪(美国热电尼高力公司);ESCALAB 25OXi型X射线光电子能谱仪(赛默飞世尔有限公司);V-1600可见分光光度计(上海翱艺仪器有限公司);UV-2300紫外分光光度计(中国上海天美科学仪器);79-1磁力加热搅拌器(金坛市大地自动化仪器厂);Multi N/C3100总有机碳分析仪(德国耶拿分析仪器股份有限公司)。
1.2 实验试剂
以下试剂如无特殊说明均为分析纯:硝酸钴、硝酸铁、柠檬酸购于上海麦克林生化科技有限公司;盐酸、硝酸、邻菲罗啉、乙酸、乙酸铵、硫酸(优级纯)、硫酸钛(化学纯)、磷酸氢二钠、磷酸二氢钠、亚硫酸钠、氢氧化钠、30%过氧化氢购于西陇科学有限公司;香豆素(99%)和橙Ⅱ(生物染色剂)购于Aladdin(上海);溶液均用去离子水配置。
1.3 催化剂的制备
LaFe0.5Co0.5O3采用溶胶凝胶法制备[15]:按照化学计量比,准确称量La(NO3)3·6H2O、Fe(NO3)3·9H2O和Co(NO3)2·6H2O,加一定量的去离子水使之溶解;再加入过量的柠檬酸(柠檬酸与金属离子的摩尔比为2),搅拌至完全溶解形成溶胶;将溶胶放置于105 ℃的烘箱中烘干至形成蜂窝状,取出研细后置于马弗炉中,先在400 ℃下预烧4 h,再升温至800 ℃煅烧4 h,研磨、过筛后即得黑色粉末状钙钛矿型催化剂LaFe0.5Co0.5O3。
1.4 实验及分析方法
反应在PCX50C Discover多通道光催化反应系统中进行,光源为254 nm的紫外灯光。具体的催化降解实验为:将1.0 g/L的催化剂、0.2 mmol/L pH值为3.0的橙Ⅱ溶液加入到反应瓶中,然后放入反应器;无光条件下,保持30 ℃恒温水浴并磁力搅拌(250 r/min)30 min达到吸附平衡;而后加入10 mmol/L的H2O2,同时打开紫外灯并开始计时,以此作为反应零时刻;最后在预设的反应时刻从预设的反应瓶中取样。
橙Ⅱ浓度测定采用分光光度计法,反应液用0.45 μm水相滤头过滤后,在484 nm波长处测吸光度,而后通过标准曲线进行浓度换算。
羟基自由基的定量分析用香豆素荧光光度法[16],在预设的时刻取反应溶液5 mL加入50 mL 2 mol/L香豆素溶液(pH=3.0)中,立刻将混合液放入另一个反应瓶在相同反应体系紫外灯下持续搅拌5 min;而后用0.45 μm水相滤头过滤,立即取2.2 mL滤液与0.5 mL终止剂(pH=7.2的NaH2PO4和Na2HPO4混合溶液)均匀混合,测量其460 nm处的荧光强度;通过标准曲线计算羟基自由基浓度。
H2O2浓度的测定采用钛盐分光光度法[17],预设时刻取样,用0.45 μm水相滤头过滤,取1 mL滤液与1 mL 4.8 mol/L的硫酸溶液、1 mL 80 mmol/L的硫酸钛溶液以及7 mL的去离子水均匀混合,在400 nm处用分光光度计测吸光度A1,剩余滤液在400 nm处分光光度计测量其吸光度A2,10A1-A2得到实际吸光度A,最后通过H2O2的标曲换算成相应浓度。
亚铁离子测定采用邻菲罗啉分光光度法[18],预设时刻取样后,通过0.22 μm水相滤头过滤,取4.3 mL滤液与0.2 mL 0.5%邻菲罗啉溶液和1 mL乙酸-乙酸铵缓冲溶液均匀混合后样品在510 nm处用分光光度计测量其吸光度A1,剩余滤液在510 nm处分光光度计测量其吸光度A2,(5/4.3)A1-A2得到实际吸光度A,最后通过亚铁离子标曲换算成相应浓度。
总铁浓度用ICP发射光谱仪测定,每组样测3次,取平均值。TOC测定使用总有机碳分析仪测量其TOC含量,每组样测3次,取平均值,差异系数小于5%。
催化剂使用前后用傅里叶红外光谱仪(FTIR)和X射线光电子能谱仪进行分析。第一次橙Ⅱ降解实验后的溶液静置、沉淀、干燥即得到一次循环回收的催化剂;第二次、三次循环实验催化剂的回收方法同上;催化剂循环使用过程未经过清洗。
2 结果与讨论
2.1 LaFe0.5Co0.5O3催化剂降解橙Ⅱ性能
无光条件下,LaFe0.5Co0.5O3吸附橙Ⅱ的动力学曲线如图2所示,该结果表明,催化剂对橙Ⅱ的吸附经过20 min即可达到平衡,故可以判断30 min后橙Ⅱ的脱色并非催化剂吸附所致。橙Ⅱ在不同体系中脱色情况如图3所示。UV照射或者单独H2O2氧化对橙Ⅱ基本没有脱色效果;UV-H2O2体系中,橙Ⅱ的脱色率在反应180 min时可以达到97.7%。研究表明,H2O2会被紫外线分解为·OH,后者具有很强的氧化能力,可将偶氮染料橙Ⅱ降解、矿化[19]:
(1)
·OH+橙Ⅱ→矿化产物(CO2、H2O)
(2)
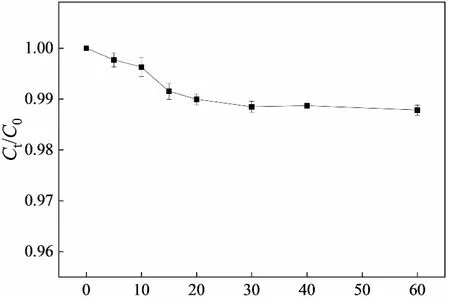
t/min图2 LaFe0.5Co0.5O3对橙Ⅱ的吸附Fig.2 Adsorption of LaFe0.5Co0.5O3 by Orange Ⅱ
由图3可见,无论有、无紫外光,LaFe0.5Co0.5O3均表现出了优异的催化能力。在LaFe0.5Co0.5O3+H2O2反应体系中,橙Ⅱ脱色率在120 min即可达到95.52%;而在UV+LaFe0.5Co0.5O3+H2O2体系中,经过60 min的反应,橙Ⅱ脱色率即可达到99.5%。
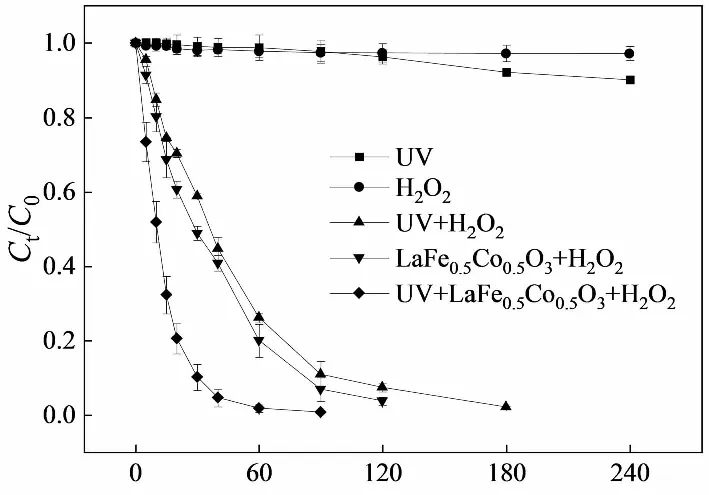
t/min图3 橙Ⅱ在不同降解体系中的脱色Fig.3 Decolorization of Orange Ⅱ in Different Degradation Systems
近年来的研究表明,在高效降解体系中,染料的脱色可以分成快速和慢速脱色2个阶段,对其脱色动力学采用分段拟合更为合理[4]。对于UV+LaFe0.5Co0.5O3+H2O2体系和LaFe0.5Co0.5O3+H2O2体系,40 min后橙Ⅱ脱色效率明显降低,故以40 min时刻为界进行分段,橙Ⅱ脱色动力学拟合结果见图4和表1。可见,有光照的体系中橙Ⅱ两个阶段的脱色速率常数均大于没有UV的体系,说明LaFe0.5Co0.5O3催化剂在UV条件下能表现出更好的催化性能。
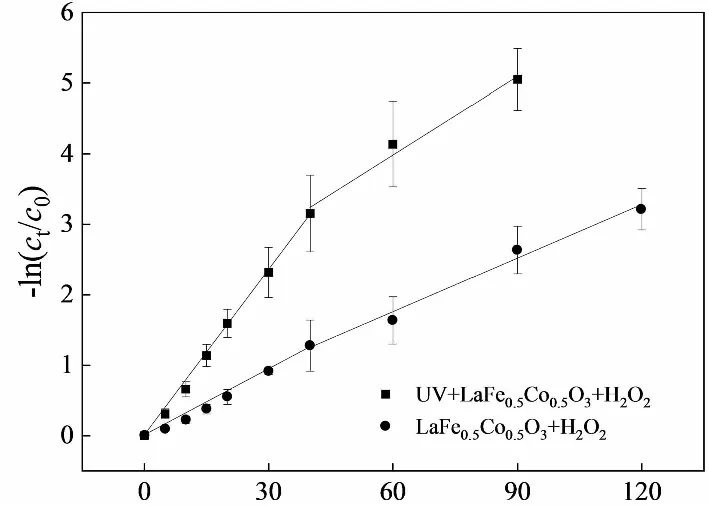
t/min图4 橙Ⅱ脱色一级动力学分段拟合Fig.4 Piecewise fitting of first-order kinetics of Orange Ⅱ decolorization
为研究橙Ⅱ在UV+LaFe0.5Co0.5O3+H2O2体系中的矿化情况,测定了不同反应时刻体系溶液的TOC值,结果见图5。可见,经过180 min的反应,体系中TOC去除率可达81.60%,说明UV+LaFe0.5Co0.5O3+H2O2体系可以高效降解和矿化偶氮染料橙Ⅱ。
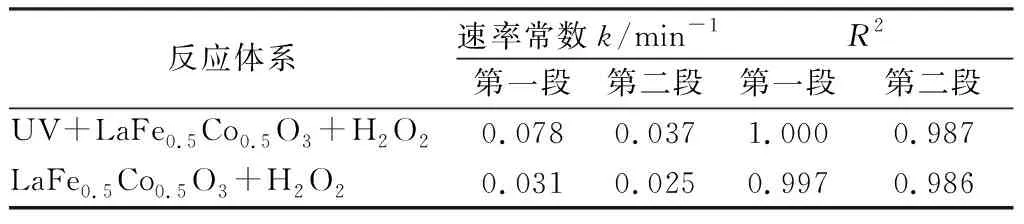
表1 橙Ⅱ脱色一级动力学速率常数Tab.1 First-order kinetic rate constant for Orange Ⅱ decolorization
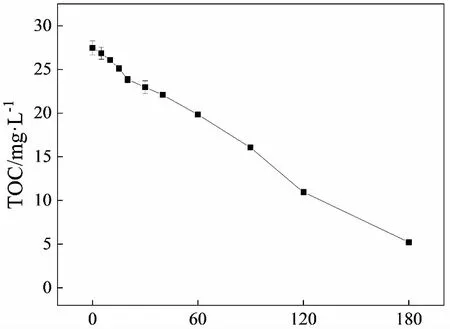
t/min图5 橙Ⅱ在UV+LaFe0.5Co0.5O3+H2O2体系中的矿化Fig.5 Mineralization of Orange Ⅱ in UV+LaFe0.5Co0.5O3+H2O2 system
2.2 LaFe0.5Co0.5O3催化剂降解橙Ⅱ的循环稳定性
为进一步验证催化剂的催化稳定性,进行了UV+LaFe0.5Co0.5O3+H2O2体系降解橙Ⅱ的循环实验,结果见图6。LaFe0.5Co0.5O3表现出了稳定的催化性能,随催化剂循环使用次数的增加,橙Ⅱ脱色的动力学基本维持不变。
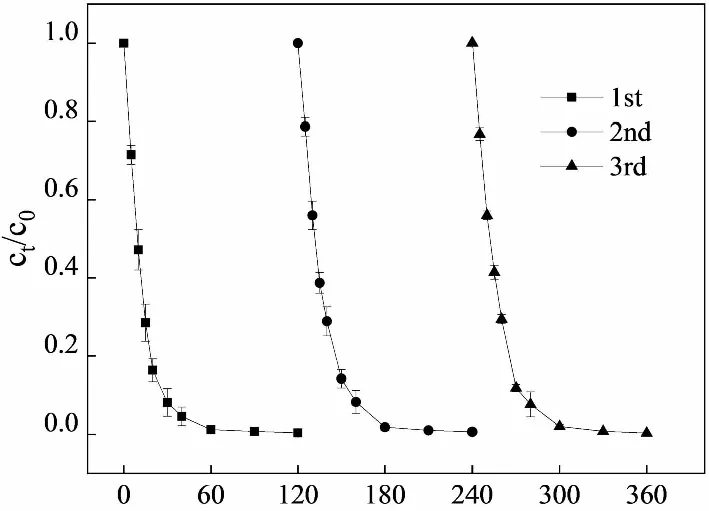
t/min图6 UV+LaFe0.5Co0.5O3+H2O2体系中催化剂循环使用对橙Ⅱ的脱色Fig.6 Decolorization of Orange Ⅱ by catalyst recycling in UV+LaFe0.5Co0.5O3+H2O2 system
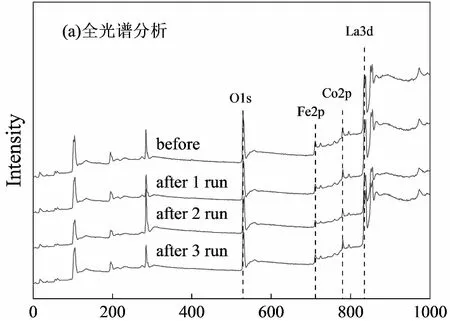
为考察催化剂LaFe0.5Co0.5O3在循环降解过程中的结构稳定性,对催化剂3次循环使用前后分别进行红外光谱、XPS全光谱、Fe2p的高分辨光谱以及XRD进行了分析,结果如图7,8,9所示。LaFe0.5Co0.5O3催化前后的傅里叶红外光谱图中(图7),2000~4000 cm-1范围内的振动吸收峰属于H2O与CO2产生的吸收峰,主要来自于环境中的H2O与CO2产生的吸收峰,以及材料粉体表面活性高,对空气中的H2O与CO2存在吸附作用进而产生的吸收峰[20]。钙钛矿结构的材料中,600 cm-1左右的峰来自B-O键的伸缩振动,400 cm-1左右的峰属于O-B-O的弯曲振动[21]。LaFe0.5Co0.5O3红外光谱图中,453 cm-1对应O-Fe-O/O-Co-O的弯曲振动,597 cm-1对应Fe-O/Co-O的伸缩振动,这两个吸收峰是由BO6八面体的不对称振动所引起的,都属于典型钙钛矿特征峰[22],说明Co掺杂铁酸镧B位所得到的材料为稳定的钙钛矿结构。需要特别指出的是,LaFe0.5Co0.5O3催化剂循环使用前后的红外光谱中没有出现与橙Ⅱ有关的吸收峰(例如1621 cm-1处苯环骨架中C=C键的伸缩振动与1508 cm-1处萘环的骨架伸缩振动等[23]),表明反应体系中溶液TOC值降低的主要原因是偶氮染料橙Ⅱ的矿化,而并非催化剂材料的吸附所致。
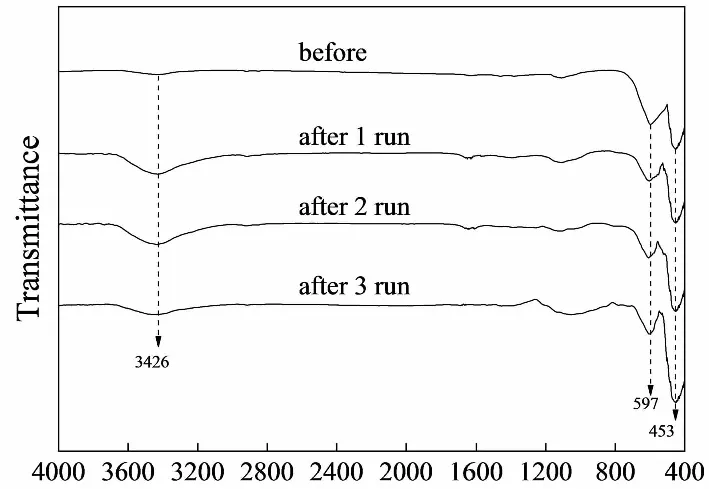
λ/cm-1图7 LaFe0.5Co0.5O3催化前后傅里叶红外光谱图Fig.7 FT-IR spectrum of LaFe0.5Co0.5O3before and after reaction
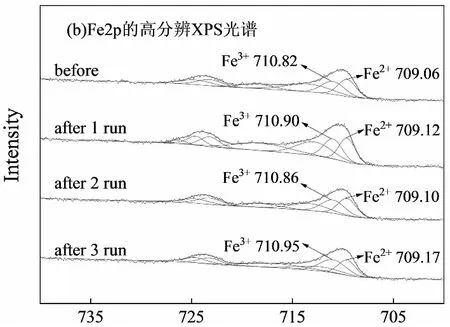
LaFe0.5Co0.5O3催化前后的光电子能谱图中出现了La3d、Co2p、Fe2p和O1s峰(图8),证明了催化剂材料主要成分是La、Co、Fe和O。710.8~711.0 eV的特征峰对应Fe3+,709.0~709.17 eV的特征峰对应Fe2+,对Fe2p的高分辨光谱分析可以发现,Fe在LaFe0.5Co0.5O3中以+2、+3价共存,这是由于在高温灼烧时,材料结构晶格中部分氧原子会发生逃逸现象,Fe3+吸收氧空位释放出来的电子转化成Fe2+[24]。这也是LaFe0.5Co0.5O3具有芬顿催化性能的原因。由图8可见,催化剂反应前后结合能没有明显变化,证明了催化剂材料的结构具有较高的化学性质稳定性。
Binding Energy/eV
Binding Energy/eV图8 LaFe0.5Co0.5O3催化前后XPS光谱图Fig.8 XPS spectrum of LaFe0.5Co0.5O3before and after reaction
图9为LaFe0.5Co0.5O3催化剂催化前后XRD图谱,用LaFe0.6Co0.4O3标准衍射卡片PDF#40-0224标定。由图可见,催化剂材料衍射峰型明显,属于正交钙钛矿晶系,体系中只有钙钛矿晶相特征峰,表明合成材料为预期钙钛矿材料。经过3次循环使用,催化剂材料衍射峰无明显偏移,进一步表明LaFe0.5Co0.5O3催化剂结构具备良好的晶体结构稳定性。

2θ图9 LaFe0.5Co0.5O3催化前后XRD图谱Fig.9 XRD spectrum of LaFe0.5Co0.5O3before and after reaction
2.3 LaFe0.5Co0.5O3光助-芬顿催化机理
研究表明[25-29],异丙醇可以与·OH发生非常迅速的选择反应,在UV-Fenton体系中常用来作·OH淬灭剂、确定·OH参与氧化过程的程度。异丙醇与·OH的夺氢反应如下[29]:
(CH3)2CHOH+·OH→(CH3)2·COH(85.5%)+(CH3)2CHO·(1.2%)+·CH2CHOHCH3(13.3%)
(3)
为进一步研究UV+LaFe0.5Co0.5O3+H2O2体系的反应机理,进行了异丙醇羟基自由基淬灭实验,结果见图10。可见,加入10 mmol/L异丙醇后,UV+LaFe0.5Co0.5O3+H2O2反应体系中橙Ⅱ脱色一阶段速率常数由0.078降至0.015 min-1,淬灭率为80.8%。该结果说明,体系中导致橙Ⅱ有效降解的氧化性活性物种主要是·OH。

t/min图10 异丙醇淬灭羟基自由基实验Fig.10 Experiment of isopropanol quenching hydroxyl radical
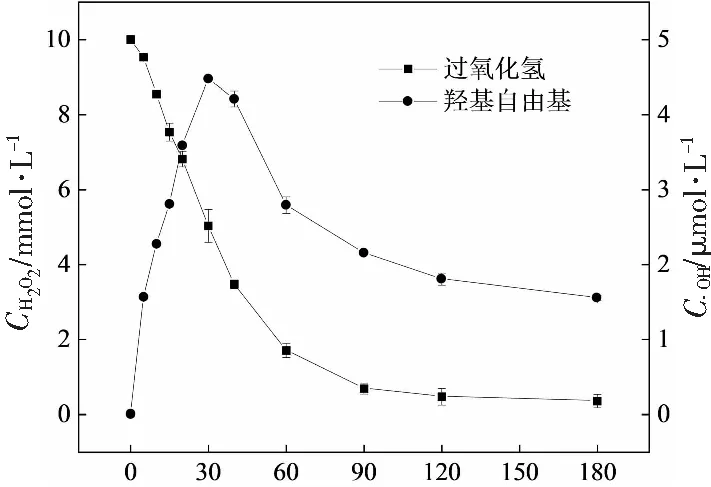
无论是均相还是多相芬顿反应,·OH均来自于H2O2的分解。UV+LaFe0.5Co0.5O3+H2O2反应体系橙Ⅱ脱色过程中H2O2和·OH的浓度变化情况见图11。在催化剂LaFe0.5Co0.5O3的作用下,
t/min图11 UV+LaFe0.5Co0.5O3+H2O2体系中H2O2和·OH浓度变化Fig.11 Changes of H2O2 and ·OH concentrations in UV+LaFe0.5Co0.5O3+H2O2 system
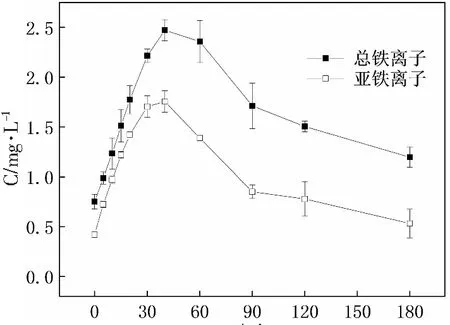
随反应的进行,H2O2快速分解;与此同时,·OH的浓度快速升高并在30 min左右达到峰值。与此相对应的,反应溶液中的铁离子总浓度与亚铁离子浓度也呈现先升高后降低的趋势(见图12)。
t/min图12 UV+LaFe0.5Co0.5O3+H2O2体系中总铁和亚铁离子浓度变化Fig.12 Changes of total iron and ferrous ion concentrations in UV+LaFe0.5Co0.5O3+H2O2 system
由图12可见,随反应的进行,溶液中铁离子总浓度和亚铁离子浓度均是先增加,在40 min左右达到峰值(2.55和1.76 mg·L-1),然后在180 min降至1.12和0.53 mg·L-1。在紫外灯的照射下,LaFe0.5Co0.5O3表面的≡FeⅢ转化为≡FeⅡ,部分≡FeⅡ与H2O2在催化剂表面发生反应生成·OH,另一部分≡FeⅡ在酸性条件下通过与H+的离子交换以Fe2+形式释放进入溶液并参与均相芬顿反应。基于以上讨论,可以发现均相和多相芬顿反应均能够产生·OH,涉及到的反应方程式如下所示:
(4)
≡FeⅡ+H2O2→≡FeⅢ+·OH+OH-
(5)
≡FeⅡ+H+→Fe2++≡H+
(6)
Fe2++H2O2→Fe3++·OH+OH-
(7)
(8)
Fe3++≡H+→≡FeⅢ+H+
(9)
需要指出的是,由图11可见,过氧化氢浓度在反应90 min后趋于水平基本不再分解,但·OH浓度却仍然能够维持较高浓度,表明体系中·OH除来自于过氧化氢分解外,还存在其他来源。
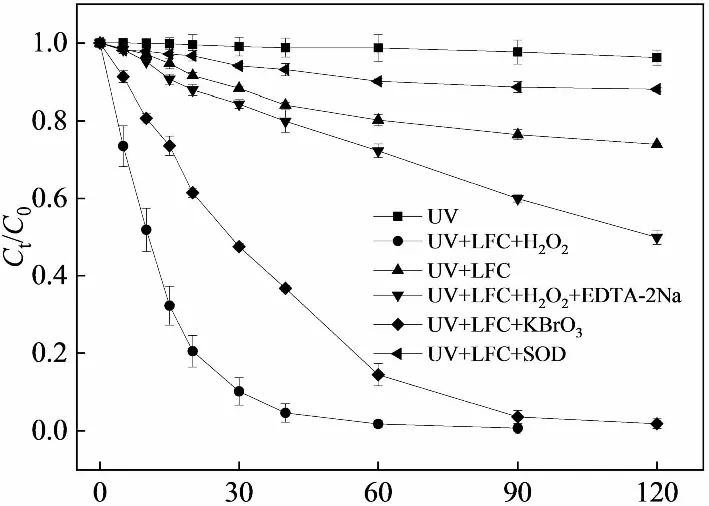
研究表明[30-32],钙钛矿是一种优良的半导体光催化材料,其能带结构由充满电子的低能价带和空穴的高能导带两部分构成。导带与价带之间的区域称为禁带,其价带顶端和导带底端的能量差称为禁带宽度或带隙[33]。当带隙Eg小于或等于入射光的光子能量(Eg≤hv),价带中的部分电子可以吸收光子激发到导带中,从而在导带中形成光生电子,在价带中形成光生空穴[30]。为了研究UV+LaFe0.5Co0.5O3(LFC)+H2O2体系中光生电子与空穴对橙Ⅱ降解的影响,本别用10 mM EDTA-2Na[34]和10 mM KBrO3[35]淬灭光生空穴和光生电子,结果见图13。
t/min图13 光生电子和空穴对橙Ⅱ降解的影响Fig.13 Effects of photogenerated electrons and holes on the degradation of Orange Ⅱ
从图13可以看出,橙Ⅱ单独进行紫外光照射时,几乎没有降解;加入LaFe0.5Co0.5O3催化剂同时进行紫外光照射时,经过120 min的反应,橙Ⅱ降解了26.4%。说明LaFe0.5Co0.5O3催化剂经紫外光照射产生的光生电子和光生空穴对橙Ⅱ的降解有一定的影响,但是由于光生电子和空穴产生后很快会发生复合,故其对橙Ⅱ降解的影响较小。

LFC+hv→LFC+e-+h+
(10)
(11)

加入空穴淬灭剂EDTA-2Na后,橙Ⅱ60 min降解率从98.2%下降到27.7%,表明在反应体系中光生空穴对橙Ⅱ的降解有很大影响。推测是光生空穴与H2O或者氢氧根离子反应生成了·OH降解橙Ⅱ(见式12、13),以及空穴氧化了吸附在催化剂表面的橙Ⅱ。
h++H2O→·OH+H+
(12)
h++OH-→·OH
(13)
进一步对LaFe0.5Co0.5O3催化剂零电点(pHPZC)进行测量,结果如图14所示,其零电点为8.06。说明在实验条件下LaFe0.5Co0.5O3催化剂表面带正电,橙Ⅱ作为一种阴离子染料本身带负电荷,因此橙Ⅱ可以被吸附到LaFe0.5Co0.5O3催化剂的表面,进而被光生空穴氧化分解。

pH图14 LaFe0.5Co0.5O3催化剂的零电点图Fig.14 Point of zero charge of LaFe0.5Co0.5O3 catalyst
研究表明[38,39],LaFeO3及其钛A位掺杂的钙钛矿型催化剂,均具有光催化和Fenton催化协同进行的特点。LaFeO3基催化剂催化过程中,Fenton反应改善了光生载流子的产率,光生电子又促进了铁离子的循环,进而能提高Fenton反应的效率。对LaFeO3基催化剂来说,两种反应过程不是简单的共存,而是互相耦合,进一步提高了催化体系对有机物的降解效率。
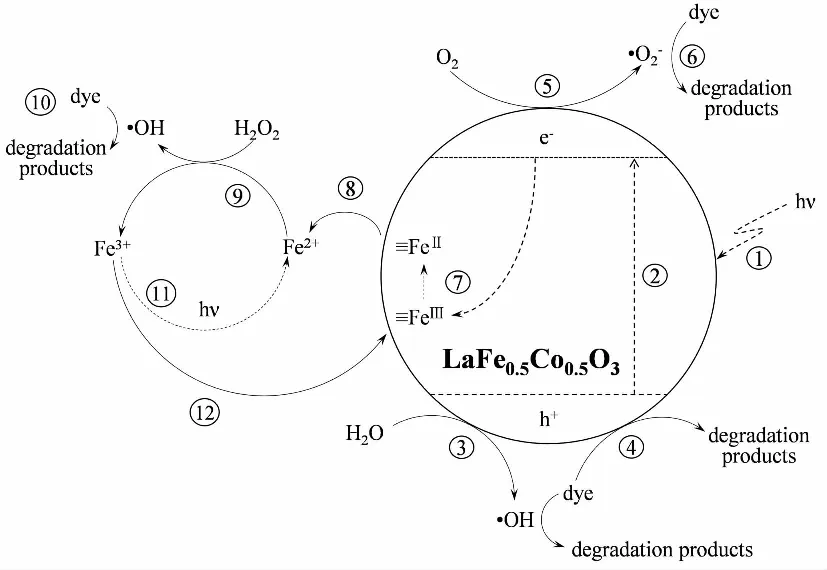
图15 LaFe0.5Co0.5O3催化剂光助-芬顿降解染料的催化机理图Fig.15 Catalytic mechanism of LaFe0.5Co0.5O3catalyst for photo-Fenton degradation of dyes
3 结论
使用溶胶-凝胶法合成了B位掺杂的钙钛矿结构催化剂LaFe0.5Co0.5O3,在pH=3,254 nm紫外光照射条件下催化H2O2降解橙Ⅱ,其脱色率60 min达到99.5%,“第一段”脱色速率常数为0.078 min-1;体系TOC去除率180 min高达81.60%。循环实验表明LaFe0.5Co0.5O3催化剂经过3次循环使用仍保持稳定的催化性能;循环前后傅里叶红外、XRD以及XPS等物化表征结果证明,该催化剂具备良好的结构稳定性。通过自由基淬灭实验以及分析总铁离子、亚铁离子、羟基自由基和过氧化氢等浓度变化,证明LaFe0.5Co0.5O3光助-芬顿催化过程包括光激发、空穴氧化、超氧自由基氧化、光生电子还原铁离子、亚铁离子释放、均相芬顿反应、铁离子再吸附等步骤,体系中橙Ⅱ的降解由光助-芬顿反应和光催化反应协同完成。

